
- •1 Параметры состояния рабочего тела
- •Примеры
- •2 Законы и уравнения состояния идеальных газов
- •Примеры
- •3 Газовые смеси
- •Примеры
- •4 Теплоемкость газов
- •Примеры
- •5 Первый закон термодинамики
- •Примеры
- •6 Процессы изменения состояния идеальных газов
- •Примеры
- •7 Второй закон термодинамики
- •Примеры
- •8 Водяной пар
- •Примеры
- •9 Истечение и дросселирование газов и паров
- •Примеры
- •10 Циклы двигателей внутреннего сгорания
- •Примеры
- •11 Циклы паросиловых установок
- •Примеры
- •12 Циклы холодильных установок
- •Примеры
- •13 Компрессоры
- •Примеры
- •14 Влажный воздух
- •Примеры
7 Второй закон термодинамики
Второй закон термодинамики определяет направление, в котором протекают процессы, устанавливает условия преобразования тепловой энергии в механическую, а также определяет максимальное значение работы, которая может быть произведена тепловым двигателем. Второй закон термодинамики математически может быть выражен формулой
![]() , (7.1)
, (7.1)
где dS – бесконечно малое приращение энтропии системы;
dQ – бесконечно малое количество теплоты, полученное системой от источника теплоты;
T –абсолютная температура источника теплоты.
Знак неравенства соответствует необратимым процессам, а знак равенства – обратимым. Следовательно, аналитическое выражение второго закона термодинамики для бесконечно малого обратимого процесса имеет вид
dq = TdS. (7.2)
Преобразуя уравнение (7.2) согласно первому закону термодинамики, используя выражения (5.2) и (5.4), получим
TdS = dU + pdV. (7.3)
Основным уравнением для определения изменения энтропии в обратимом процессе является выражение
![]() . (7.4)
. (7.4)
В теплотехнических расчетах приходится иметь дело с изменением энтропии Δs, а не с ее абсолютным значением, поэтому отсчет значений энтропии можно вести от любого ее состояния. Для газов принято считать значение энтропии равным нулю при н.у. Определение энтропии для любого состояния газа, отсчитанной от нормального состояния и определение изменения энтропии между двумя произвольными состояниями газа, производят по следующим формулам, приведенным в таблице 4.
Если работа совершается с помощью газа, параметры которого отличаются от параметров окружающей среды, то максимальная работа, которую может произвести этот газ, достижима лишь при условии его перехода от начального состояния к состоянию среды обратимым путем. При этом максимальная полезная работа меньше максимальной работы на величину работы вытеснения газа окружающей среды. Величина максимальной полезной работы определяется формулой
lmax(полезн) = u1 – u2 – T0(s1 – s2) – p0(v2 – v1). (7.5)
Таблица 4
Формулы для определения энтропии
Параметр |
Энтропия, отсчитанная от нормального состояния, s |
Изменение энтропии, Δs = s2 – s1 |
Переменная теплоемкость |
|
|
Постоянная теплоемкость |
|
|
Так как выражения u1 – u2 и T0(s1 – s2) представляют собой соответственно абсолютную величину работы адиабатного и изотермического процессов – уравнения (6.13) и (6.8), то формулу (6.34) можно представить в виде
lmax(полезн) = lад - lиз – p0(v2 – v1). (7.6)
Примеры
П-7.1
Определить изменение энтропии 10 кг двуокиси углерода в процессе сжатия. Начальные параметры углекислоты: t1=40 ºС, р1=0,2 МПа, конечные: t2 = 253 ºС, р2 = 4,5 МПа. При расчете теплоемкости углекислого газа использовать молекулярно-кинетическую теорию.
Решение.
Принимая теплоемкость двуокиси углерода по молекулярно-кинетической теории и учитывая, что молекула имеет линейную структуру СО2, имеем (таблица 4):
![]()
![]() кДж/(кг·К).
кДж/(кг·К).
П-7.2
1 кг кислорода при температуре t1 = 127 ºС расширяется до пятикратного объема, температура его при этом падает до t2 = 27 ºС.
Определить изменение энтропии. Теплоемкость считать постоянной.
Решение.
По уравнению (таблица 4):
![]()
![]() кДж/(кг·К).
кДж/(кг·К).
П-7.3
Определить максимальную полезную работу, которая может быть произведена 1 кг кислорода, если его начальное состояние характеризуется параметрами t1 = 400 ºС и р1 = 0,1 МПа, а состояние среды – параметрами t0 = 20 ºС и р0 = 0,1 МПа.
Представить процесс в диаграммах p-v и T-s.
Решение.
Максимальная работа, которую произведет при данных условиях кислород, может быть получена лишь при условии перехода его от начального состояния к состоянию среды обратимым путем. Так как температура кислорода в начальном состоянии выше температуры среды, то прежде всего необходимо обратимым процессом снизить температуру кислорода до температуры среды. Таким процессом может явиться только адиабатное расширение кислорода (рис. 5 и 6). При этом конечный объем и конечное давление получают из следующих соотношений:
![]() м3/кг;
м3/кг;
![]() м3/кг;
м3/кг;
![]() МПа.
МПа.
После адиабатного расширения необходимо обратимым путем при t=const сжать кислород от давления 0,00542 МПа до давления окружающей среды, т.е. осуществить изотермическое сжатие кислорода до 0,1 МПа. При этом конечный объем кислорода (2.6)
![]() м3/кг.
м3/кг.
Максимальную полезную работу находят по формуле (7.6):
![]()
![]()
=124800 кДж/кг=124,8 кДж/кг.
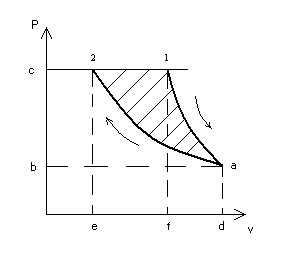
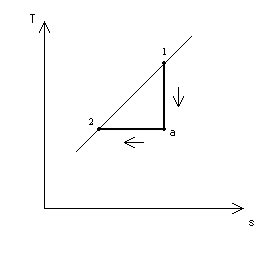
Рис. 5 Рис. 6
Задача может быть решена также и другим способом. Как видно из рис., величина максимальной полезной работы изображается заштрихованной площадью 1-а-2. эта площадь может быть определена как разность площадей 1-а-b-c и 2-а-b-c.
Пл.
1-а-b-c=пл.
1-a-d-f+пл.
с-1-f-0-пл.
а-b-0-d
=
![]()
![]()
![]() кДж/кг.
кДж/кг.
Пл. 2-а-b-c=пл. 2-a-d-e+пл.2- с-0-e-пл.a-b-0-d=аиз=221,8 кДж/кг.
Следовательно,
lmax(полезн)=345,8-221,8=124 кДж/кг.
Задачи
З-7.1
Средняя теплоемкость алюминия ср в интервале температур от 0 до 300 ºС равна 0,955 кДж/(кг·К).
Определить энтропию 100 кг алюминия при 300 ºС, считая, что его энтропия при 0 ºС равна 0.
Ответ: S = 70,9 кДж/К.
З-7.2
Определить изменение энтропии в процессе испарения 1 кг воды при температуре, равной 100 ºС, если известно, что теплота парообразования r = 2257 кДж/кг.
Ответ: s = 6,05 кДж/(кг·К).
З-7.3
Торпеда приводится в действие и управляется автоматически, двигаясь на заданной глубине. Для двигателя торпеды используется имеющийся в ней запас сжатого воздуха. Найти максимальную полезную работу, которую может произвести воздушный двигатель торпеды, если объем сжатого воздуха в ней V1=170 л, давление р1=18 МПа, а температура воздуха и морской воды t0=10 ºС. Торпеда отрегулирована на движение под уровнем моря на глубине 4 м.
Определить так же силу, с которой торпеда устремляется вперед, если радиус ее действия должен быть равен 4 км, а потерями привода можно пренебречь.
Ответ: Lmax(полезн) =11810 кДж; F=295 Н.
З-7.4
1 кг воздуха сжимается по политропе от 0,1 МПа и 20 ºС до 0,8 МПа при n=1,2.
Определить конечную температуру, изменение энтропии, количество отведенной теплоты и затраченную работу.
Ответ: t2=141 ºС, s= -0,2445 кДж/(кг·К), q= -87,1 кДж/кг, l= -173,0 кДж/кг.
З-7.5
1 кг воздуха сжимается от р1=0,1 МПа и t1=15 ºС до р2=0,5 МПа и t2=100 ºС.
Определить изменение энтропии. Теплоемкость считать постоянной.
Ответ: s= -0,196 кДж/(кг·К).
