
- •1 Параметры состояния рабочего тела
- •Примеры
- •2 Законы и уравнения состояния идеальных газов
- •Примеры
- •3 Газовые смеси
- •Примеры
- •4 Теплоемкость газов
- •Примеры
- •5 Первый закон термодинамики
- •Примеры
- •6 Процессы изменения состояния идеальных газов
- •Примеры
- •7 Второй закон термодинамики
- •Примеры
- •8 Водяной пар
- •Примеры
- •9 Истечение и дросселирование газов и паров
- •Примеры
- •10 Циклы двигателей внутреннего сгорания
- •Примеры
- •11 Циклы паросиловых установок
- •Примеры
- •12 Циклы холодильных установок
- •Примеры
- •13 Компрессоры
- •Примеры
- •14 Влажный воздух
- •Примеры
Примеры
П-4.1
Вычислить
среднюю массовую и среднюю объемную
теплоемкости окиси углерода при
постоянном объеме для интервала
температур 0-1200 ºС, если известно, что
для окиси углерода
(![]() срm)01200=32,192
кДж/(кмоль·К).
срm)01200=32,192
кДж/(кмоль·К).
Сопоставить полученные результаты с табличными данными.
Решение.
![]() кДж/(м3·К);
кДж/(м3·К);
![]() кДж/(м3·К);
кДж/(м3·К);
![]() кДж/(м3·К).
кДж/(м3·К).
Из приложения Д
![]() кДж/(м3·К);
кДж/(м3·К);
![]() кДж/(м3·К).
кДж/(м3·К).
П-4.2
Воздух в количестве 6 м3 при давлении р1 = 0,3 МПа и температуре t1 = 25 ºС нагревается при постоянном давлении до t2 = 130 ºС.
Определить количество подведенной к воздуху теплоты, считая с = const.
Решение.
Для данного случая формула (4.5) примет вид:
![]() .
.
Массу газа найдем из уравнения
![]() кг,
кг,
а объем газа при нормальных условиях – из уравнения
![]() нм3.
нм3.
На основании формул (4.1) имеем
![]() кДж/(кг·К);
кДж/(кг·К);
![]() кДж/(нм3·К).
кДж/(нм3·К).
Следовательно,
![]() кДж,
кДж,
или
![]() кДж.
кДж.
Задачи
З-4.1
Баллон с водородом выносится из помещения с температурой 5 ºС в машинный зал, где температура достигает 25 ºС.
Определить количество теплоты, полученной газом после выравнивания температуры, если начальное давление в баллоне составляло 12 МПа. Объем баллона 40 дм3.
Ответ: Qv = 84 кДж.
З-4.2
Воздух выходит из компрессора при p1 = 0,7 МПа и t2 = 160 ºС и поступает в холодильник. На выходе из холодильника температура воздуха равна 25 ºС.
Определить количество теплоты, отданной охлаждающей воде в течение часа, если производительность компрессора V = 6 м3/мин.
Ответ:Q = 275435 кДж/ч.
З-4.3
В регенеративном подогревателе газовой турбины воздух нагревается при постоянном давлении от t1=130 ºС до t2=500 ºС.
Определить количество теплоты, сообщенной воздуху в единицу времени, если расход его составляет 250 кг/ч. Ответ дать в килоджоулях в секунду и в киловаттах. Для решения воспользоваться таблицами.
Ответ:Q=27 кДж/с=27 кВт.
З-4.4
Используя таблицу 3, найти объемную теплоемкость кислорода при постоянном объеме и постоянном давлении, считая с = const.
Ответ:![]() кДж/(м3·К);
кДж/(м3·К);
![]() кДж/(м3·К).
кДж/(м3·К).
З-4.5
Определить значение массовой теплоемкости кислорода при постоянном объеме и постоянном давлении, считая с = const.
Ответ: сp = 0,916 кДж/(кг·К); сv = 0,654 кДж/(кг·К).
5 Первый закон термодинамики
Первый закон термодинамики является частным случаем закона сохранения и превращения энергии. Он устанавливает эквивалентность при взаимных превращениях механической и тепловой энергии и математически может быть выражен следующим образом:
Q = L , (5.1)
где Q – количество теплоты, превращенной в энергии, Дж;
L – работа, полученная за счет теплоты Q, Дж.
Аналитическое выражение первого закона термодинамики или основное уравнение теплоты в дифференциальной форме для любого тела
dQ = dU + dL , (5.2)
где dQ – количество теплоты, сообщенное извне рабочему телу массой М кг;
dU – изменение внутренней энергии рабочего тела;
dL – работа, совершенная рабочим телом по преодолению внешнего давления.
Каждый из трех членов этого уравнения может быть в зависимости от характера изменения состояния положительным, отрицательным или равным нулю. Для бесконечно малого изменения состояния 1 кг любого газа уравнение (5.2) примет вид:
dq = du + dl. (5.3)
Так как
dа = pdv,
то
dq = du + pdv. (5.4)
Для конечного изменения состояния уравнения (5.2) и (5.3) примут вид
Q = ΔU + L, (5.5)
q = Δu + l. (5.6)
Работа расширения 1 кг газа
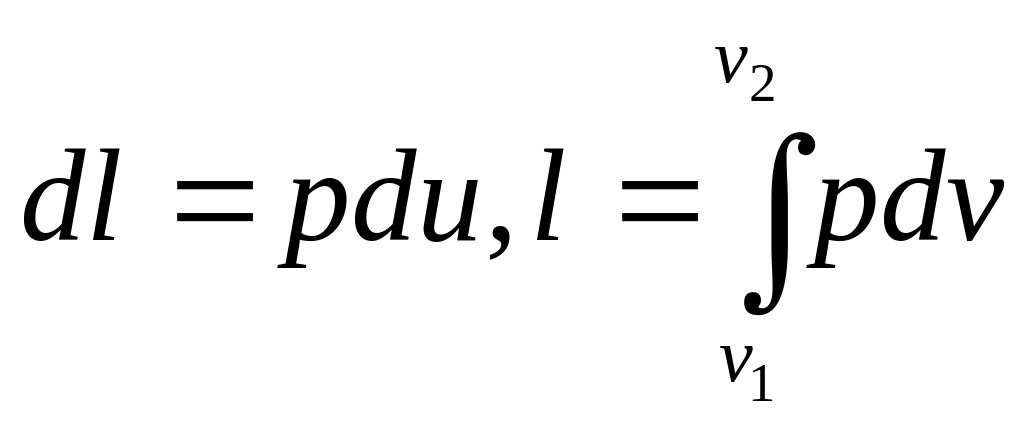 , (5.7)
, (5.7)
Изменение внутренней энергии идеального газа для любого процесса при бесконечно малом изменении состояния (для 1кг)
du = cvdt. (5.8)
В теплотехнических расчетах обычно требуется знать изменение внутренней энергии Δu, а не ее абсолютное значение. Интегрируя уравнение (5.8) в пределах от t1 до t2, получаем
Δu = cvm(t2 - t1), (5.9)
где cvm – средняя массовая теплоемкость при постоянном объеме в пределах от t1 до t2.
Заменяя в уравнении (5.4) величину pdv через (d(pv) – vdp) получаем
dq = du + d(pv) – vdp = d(u + pv) – vdp.
Выражение u + pv является параметром состояния. В технической термодинамике этот параметр называется энтальпия и обозначается буквой i. Таким образом
i = u + pv, (5.10)
следовательно, основное уравнение первого закона термодинамики, выраженное через энтальпию, имеет вид
dq = di – vdp. (5.11)
Так как для идеальных газов di = cd ·dT, то
![]() , (5.12)
, (5.12)
где cрm – средняя массовая теплоемкость при постоянном давлении в пределах от 0º до Т.
В теплотехнических расчетах обычно требуется знать изменение энтальпии, а не ее абсолютное значение. Интегрируя уравнение (5.11) при p = const, получаем
qp = i2 – i1. (5.13)
