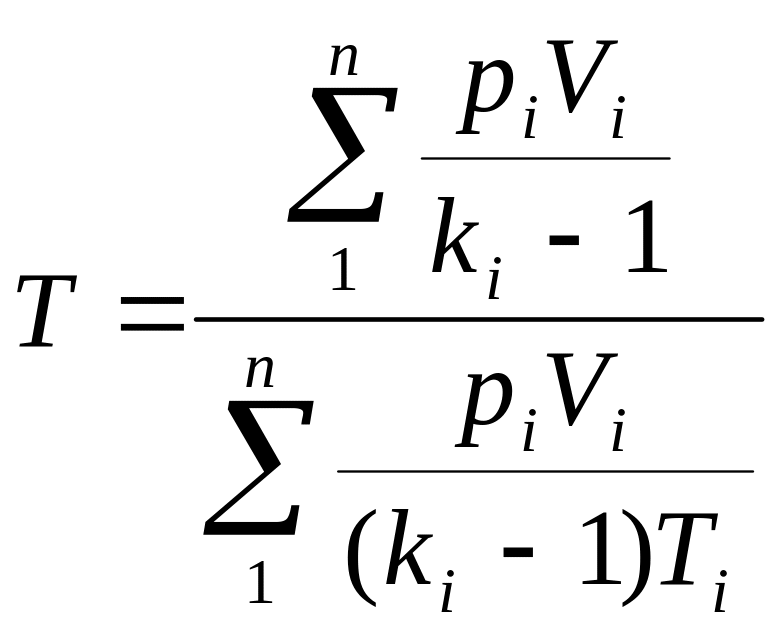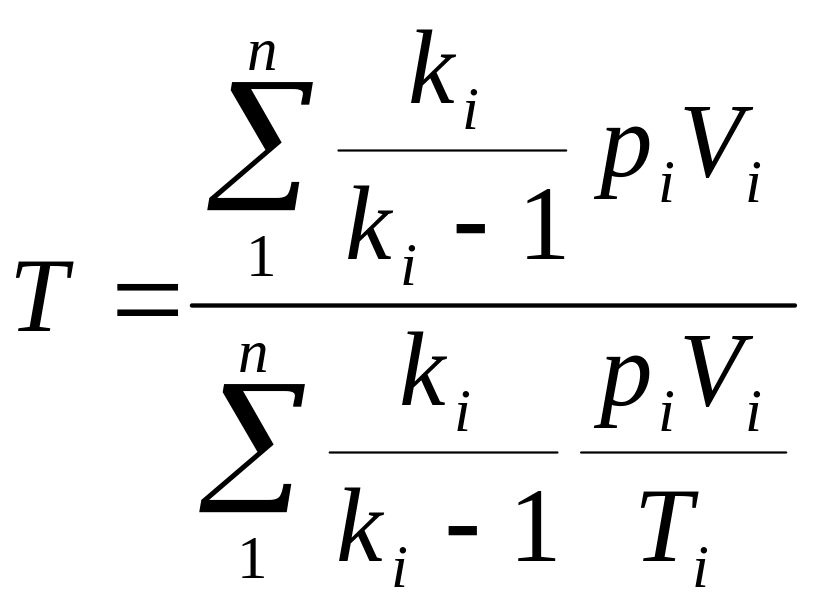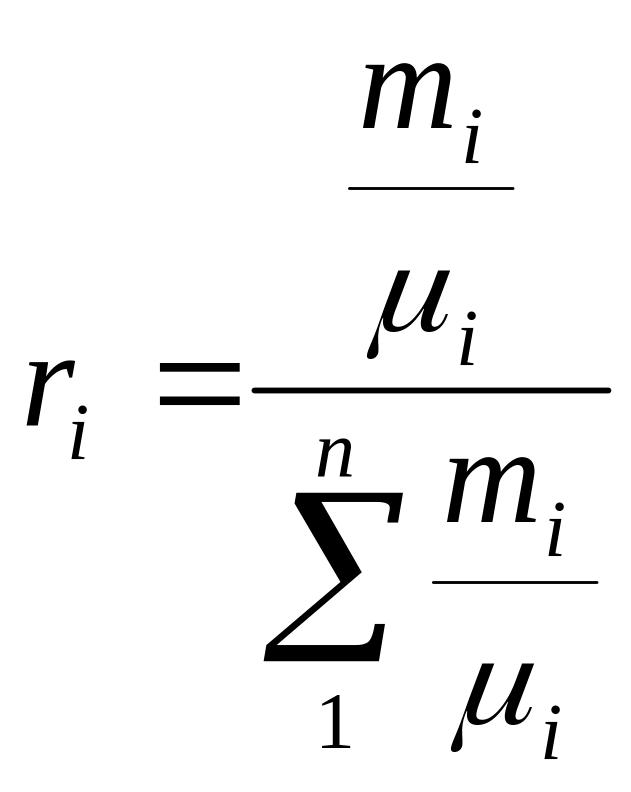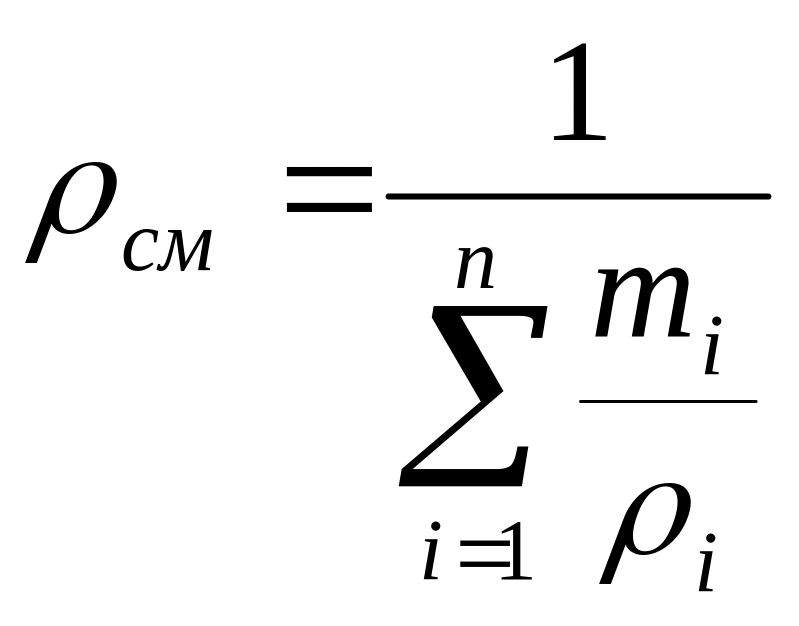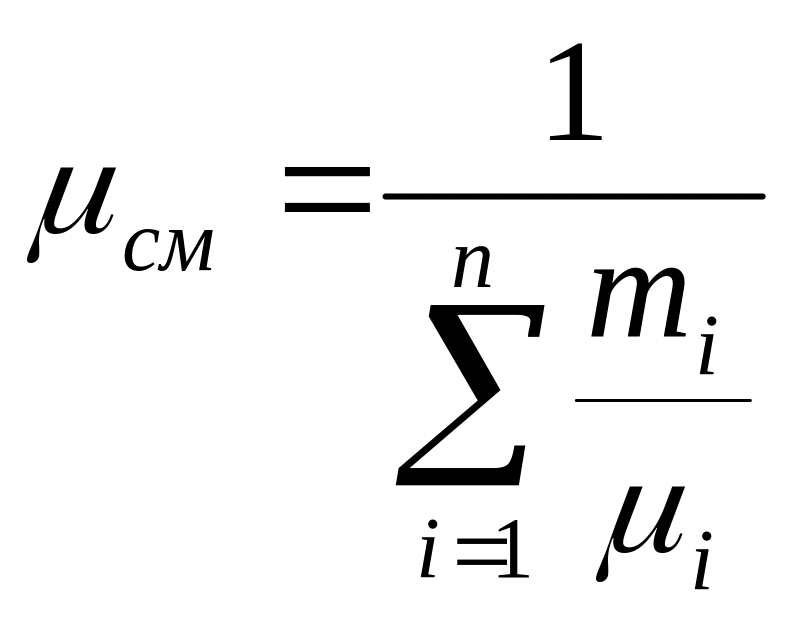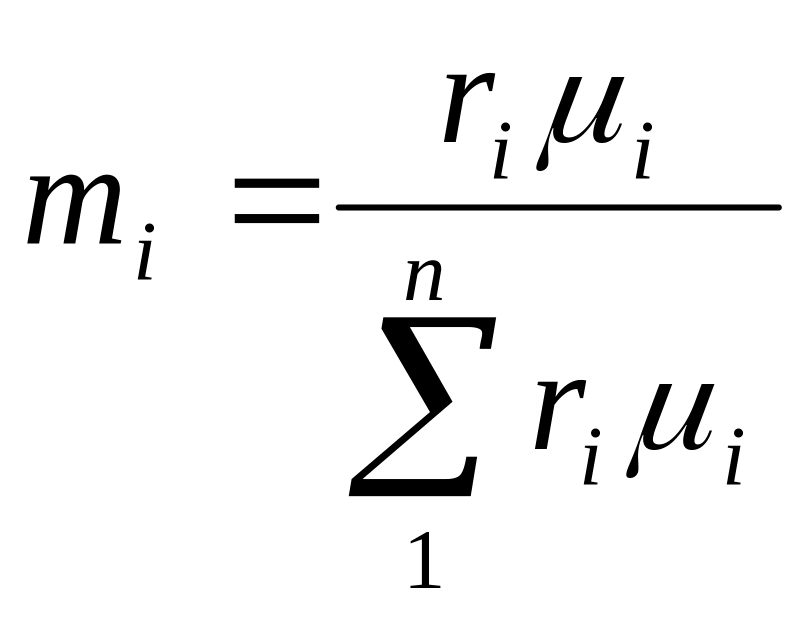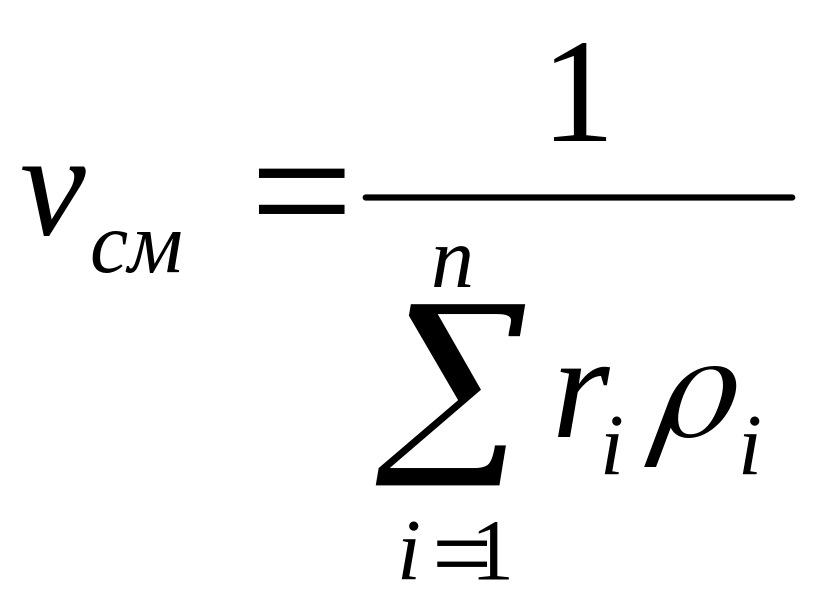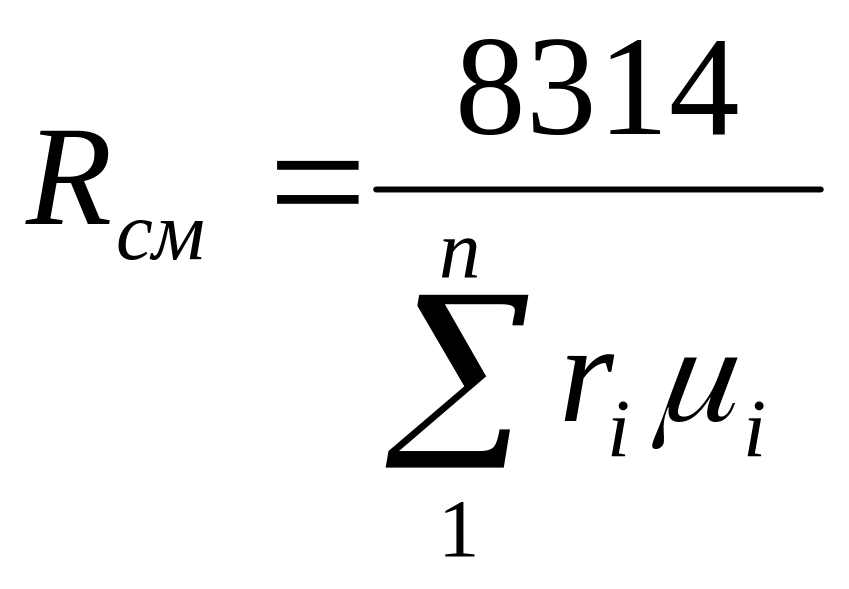- •1 Параметры состояния рабочего тела
- •Примеры
- •2 Законы и уравнения состояния идеальных газов
- •Примеры
- •3 Газовые смеси
- •Примеры
- •4 Теплоемкость газов
- •Примеры
- •5 Первый закон термодинамики
- •Примеры
- •6 Процессы изменения состояния идеальных газов
- •Примеры
- •7 Второй закон термодинамики
- •Примеры
- •8 Водяной пар
- •Примеры
- •9 Истечение и дросселирование газов и паров
- •Примеры
- •10 Циклы двигателей внутреннего сгорания
- •Примеры
- •11 Циклы паросиловых установок
- •Примеры
- •12 Циклы холодильных установок
- •Примеры
- •13 Компрессоры
- •Примеры
- •14 Влажный воздух
- •Примеры
Примеры
П-2.1
Баллон с кислородом емкостью 20 л находится под давлением 10 МПа при 15 ºС. После израсходования части кислорода давление понизилось до 7,6 МПа, а температура упала до 10 ºС.
Определить массу израсходованного кислорода.
Решение.
Из характеристического уравнения (2.5)
![]()
Следовательно, до расходования кислорода масса его состояла
![]() кг,
кг,
а после израсходования
![]() кг.
кг.
Таким образом, расход кислорода
ΔМ = М1 –М2 = 2,673 - 2,067 = 0,606 кг.
П-2.2
Определить плотность и удельный объем окиси углерода СО при давлении 0,1 МПа при температуре 27 ºС.
Решение.
Удельный объем определяется из характеристического уравнения (2.6)
![]()
![]() м3/кг.
м3/кг.
Плотность окиси углерода (1.2)
![]() кг/м3.
кг/м3.
Задачи
З-2.1
В цилиндре с подвижным поршнем находится кислород при t = 80 ºС и разряжении (вакууме), равном 427 гПа. При постоянной температуре кислород сжимается до избыточного давления pизб = 1,2 МПа. Барометрическое давление В = 933 гПа.
Во сколько раз уменьшится объем кислорода?
Ответ: V1/V2 = 22,96.
З-2.2
В комнате площадью 35 м2 и высотой 3,1 м воздух находится при t = 23 ºС и барометрическом давлении В = 973 гПа.
Какое количество воздуха проникнет с улицы в комнату, если барометрическое давление увеличится до В = 1013 гПа. Температура воздуха остается постоянной.
Ответ:
![]() М
= 5,1 кг.
М
= 5,1 кг.
З-2.3
В сосуде объемом 5 м3 находится воздух при барометрическом давлении В = 0,1 МПа и температуре 300 ºС. Затем воздух выкачивается до тех пор, пока в сосуде не образуется вакуумметрическое давление, равное 80 кПа. Температура воздуха после выкачивания остается той же.
Сколько воздуха выкачано? Чему будет равно давление в сосуде после выкачивания, если оставшийся воздух охладить до температуры t = 20 ºС?
Ответ: выкачано 2,43 кг воздуха. После охлаждения воздуха давление будет равным 10,3 кПа.
З-2.4
В воздухоподогреватель парового котла подается вентилятором 130000 м3/ч воздуха при температуре 30 ºС.
Определить объемный расход воздуха на выходе из воздухоподогревателя, если он нагревается до 400 ºС при постоянном давлении.
Ответ: V = 288700 м3/ч.
З-2.5
Во сколько раз изменится плотность газа в сосуде, если при постоянной температуре показание манометра уменьшится от р1 = 1,8 МПа до р2 = 0,3 МПа?
Барометрическое давление принять равным 0,1 МПа.
Ответ:
![]()
З 2.6
В сосуде объемом 0,5 м3 находится воздух при давлении 0,2 МПа и температуру 20 ºС.
Сколько воздуха надо выкачать из сосуда, чтобы разрежение в нем составило 56 кПа при условии, что температура в сосуде не изменится? Атмосферное давление по ртутному барометру равно 102,4 кПа при температуре ртути в нем, равной 18 ºС. Разрежение в сосуде измерено ртутным вакуумметром при температуре ртути 20 ºС.
Ответ: М = 1,527 кг.
3 Газовые смеси
Часто приходится решать задачи, в которых рассматриваются не отдельные газы, а их смеси. При смешении химически невзаимодействующих газов, имеющих различные давления и температуры, обычно приходится определять конечное состояние смеси. При этом различают два случая (таблица 1).
Таблица 1
Смешение газов*
|
Температура, К |
Давление, Па |
Объем, м3 (объемный расход, м3/ч) |
Смешение газов при V=const |
|
|
|
Смешение газовых потоков** |
|
|
|
* - все уравнения, относящиеся к смешению газов, выведены при условии отсутствия теплообмена с окружающей средой; ** - если массовые расходы (М1, М2, …Мn, кг/ч) смешивающихся потоков равны. |
|||
Здесь ki – отношение теплоемкостей газов (см.формулу (4.2)).
Под газовыми смесями понимают механическую смесь нескольких газов, химически между собой не взаимодействующих. Состав газовой смеси определяется количеством каждого из газов, входящих в смесь, и может быть задан массовыми mi или объемными ri долями:
mi = Mi / M; ri = Vi / V, (3.1)
где Mi – масса i-го компонента,
Vi – парциальный или приведенный объем i-го компонента;
M, V – масса и объем всей смеси соответственно.
Очевидно, что
М1 + М2 +…+Мn = M; m1 + m2 +…+mn = 1, (3.2)
а также
V1 + V2 +…+ Vn = V ;r1 + r2 +…+rn = 1, (3.3)
Связь между давлением газовой смеси р и парциальным давлением отдельных компонентов рi, входящих в смесь, устанавливается законом Дальтона
р = рi , (3.4)
Если заданы состав газовой смеси, а также характеристики составляющих смесь газов, то можно рассчитать необходимые характеристики смеси по приводимым в таблице 2 формулам.
Таблица 2
Формулы для расчета газовых смесей
Задание состава смеси |
Перевод из одного состава в другой |
Плотность и удельный объем смеси |
Кажущаяся молекулярная масса смеси |
Газовая постоянная смеси, Дж/(кгК) |
Парциальное давление |
Массовыми долями |
|
|
|
|
|
Объемными долями |
|
|
|
|
|
В таблице 2 i – молекулярная масса i-го компонента;
8314 Дж/(кмольК) – значение универсальной газовой постоянной;
Ri – газовая постоянная i-го компонента.