
- •1 Параметры состояния рабочего тела
- •Примеры
- •2 Законы и уравнения состояния идеальных газов
- •Примеры
- •3 Газовые смеси
- •Примеры
- •4 Теплоемкость газов
- •Примеры
- •5 Первый закон термодинамики
- •Примеры
- •6 Процессы изменения состояния идеальных газов
- •Примеры
- •7 Второй закон термодинамики
- •Примеры
- •8 Водяной пар
- •Примеры
- •9 Истечение и дросселирование газов и паров
- •Примеры
- •10 Циклы двигателей внутреннего сгорания
- •Примеры
- •11 Циклы паросиловых установок
- •Примеры
- •12 Циклы холодильных установок
- •Примеры
- •13 Компрессоры
- •Примеры
- •14 Влажный воздух
- •Примеры
Примеры
П-3.1
Атмосферный воздух имеет примерно следующий массовый состав:
![]() %;
%;
![]() %.
%.
Определить объемный состав воздуха, его газовую постоянную, кажущуюся молекулярную массу и парциальные давления кислорода и азота, если давление воздуха по барометру В = 101325 Па.
Решение.
Находим объёмную долю каждого компонента (таблица 2)
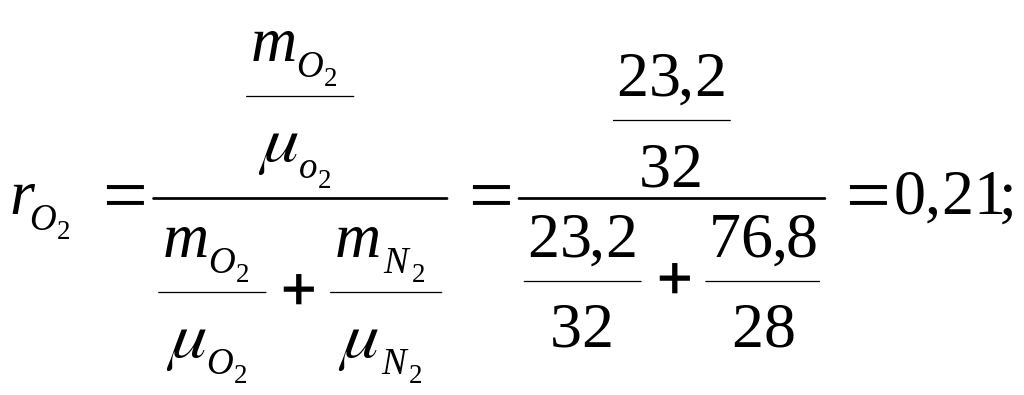
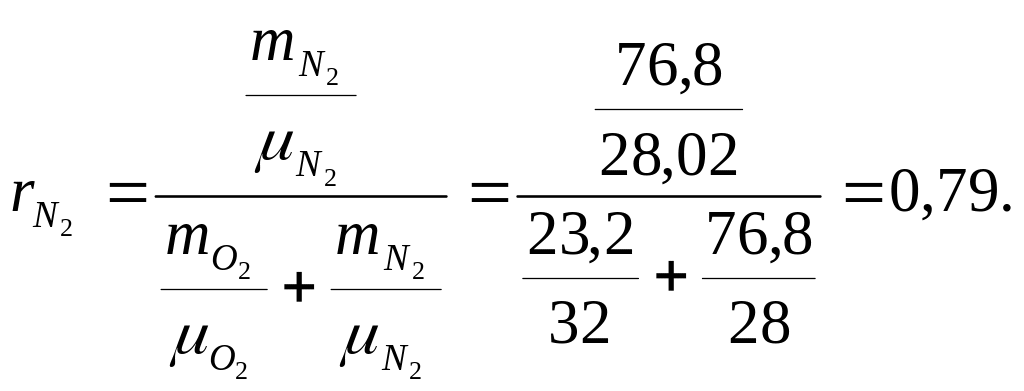
Находим газовую постоянную воздуха (таблица 2)
![]() .
.
Определяем кажущуюся молекулярную массу смеси (таблица 2)
![]() кг,
кг,
или из уравнения (2.9)
![]() ,
Дж/(кгК).
,
Дж/(кгК).
Отсюда
![]() кг.
кг.
Получим парциальные давления (таблица 2)
![]()
следовательно,
![]() Па;
Па;
![]() Па.
Па.
П-3.2
Смесь
газов состоит из водорода и окиси
углерода. Массовая доля водорода
![]() =0,67
%.
=0,67
%.
Найти газовую постоянную смеси и ее удельный объем при нормальных условиях.
Решение.
Из уравнения (таблица 2)
![]() Дж/(кг·К).
Дж/(кг·К).
Удельный объем газовой смеси получим из характеристического уравнения (2.6)
![]() нм3/кг.
нм3/кг.
Задачи
З-3.1
В сосуде находится смесь, состоящая из одного киломоля кислорода и двух киломолей азота, при p1 = 0,1 МПа и t1 = 30 ºС. Эта смесь охлаждается при постоянном объеме до температуры t2 = 10 ºС.
Определить изменение внутренней энергии смеси.
Ответ:
![]() кДж/кг.
кДж/кг.
З-3.2
Объемный
состав горючего газа: rCO
=10 %,
![]() =45
%,
=45
%,
![]() =35
%,
=35
%,
![]() =4
%,
=4
%,
![]() =3
%,
=3
%,
![]() =3
%.
=3
%.
Определить кажущуюся мольную массу, плотность, удельный объем при нормальных условиях, массовую газовую постоянную R, парциальное давление метана в процентах и массовые доли содержания компонентов.
Ответ:
![]() =12,63;
=12,63;
![]() =0,563
кг/м3;
vсм
=1,776
м3/кг;
Rсм
=0,658
кДж/(кг·К);
=0,563
кг/м3;
vсм
=1,776
м3/кг;
Rсм
=0,658
кДж/(кг·К);
![]() =35
%; mCO=0,222;
=35
%; mCO=0,222;
![]() =0,072;
=0,072;
![]() =0,089;
=0,089;
![]() =0,445;
=0,445;
![]() =0,067;
=0,067;
![]() =0,105.
=0,105.
З-3.3
Объемный состав сухих продуктов сгорания топлива (не содержащих водяных паров) следующий: СО2=12,3 %; О2=7,2 %; N2=80,5 %.
Найти кажущуюся молекулярную массу и газовую постоянную, а также плотность и удельный объем продуктов сгорания при В=100 кПа и t=800 ºС.
Ответ:
=30,3;
Rсм=274
кДж/(кг·К);
v=2,94
м3/кг;
![]() =0,34
кг/м3.
=0,34
кг/м3.
З-3.4
Найти газовую постоянную, удельный объем газовой смеси и парциальные давления ее составляющих, если объемный состав смеси следующий: СО2=12 %; СО=1 %; Н2O=6 %; О2=7 %; N2=74 %; а общее давление ее р=100 кПа.
Ответ:
Rсм=281
Дж/(кг·К); v=0,76
м3/кг;
![]() =12000
Па;
=12000
Па;
![]() =1000
Па;
=1000
Па;
![]() =6000
Па;
=6000
Па;
![]() =7000
Па;
=7000
Па;
![]() =74000
Па.
=74000
Па.
З-3.5
Газовая смесь имеет следующий массовый состав: СО2=12 %; О2=8 % и N2=80 %.
До какого давления нужно сжать эту смесь, находящуюся при нормальных условиях, чтобы плотность ее составляла 1,6 кг/м3.
Ответ: до р=0,213 МПа.
4 Теплоемкость газов
В теплотехнических расчетах пользуются понятием «удельная теплоемкость», хотя называют ее просто «теплоемкость». Под удельной теплоемкостью понимают количество теплоты, которое необходимо сообщить телу, чтобы повысить температуру какой-либо его количественной единицы на 1 ºС. В зависимости от выбранной количественной единицы различают теплоемкости:
мольную с, кДж/(кмольК);
массовую с, кДж/(кгК);
объемную с/, кДж/(нм3К).
Эти теплоемкости связаны между собой следующими соотношениями:
с = с/ ; с/ = с/22,4 ; с/ = сн, (4.1)
где н – плотность газа при нормальных условиях.
1 м3 газа имеет различную массу в зависимости от давления и температуры. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1 м3 при нормальных условиях. В зависимости от способа подвода тепла к газу (р = const или V = const) различают изобарную ср и изохорную сv теплоемкости. Отношение этих величин носит название показателя адиабаты
k = cp/cv = cp/cv. (4.2)
Теплоемкости ср и сv связаны также соотношением Майера
сp - cv = R = 8,314, кДж/(кмольК). (4.3)
Для приближенных расчетов при невысоких температурах можно принимать следующие значения мольных теплоемкостей (таблица 3).
Таблица 3
Мольные теплоемкости газов, кДж/(кмольК)
Газы |
cv |
cp |
k |
Одноатомные |
12,56 |
20,93 |
1,67 |
Двухатомные |
20,93 |
29,31 |
1,40 |
Многоатомные |
29,31 |
37,68 |
1,30 |
Теплоемкость газов меняется с изменением температуры, причем эта зависимость имеет криволинейный характер. Значения истинных и средних теплоемкостей в интервале от 0º до t берутся непосредственно из таблиц, причем в необходимых случаях производится интерполяция. Количество теплоты, которое необходимо затратить в процессе нагревания 1 кг газа в интервале температур от t1 до t2:
![]() ,
кДж/кг. (4.4)
,
кДж/кг. (4.4)
где cm1 и cm2 – соответственно средние теплоемкости в пределах 0º – t1 и 0º – t2 .
Если в процессе участвуют М (кг) или Vн (м3) газа, то
QV = M(cvm2 t2 – cvm1t1) = Vн(c/vm2 t2 – c/vm1 t1) , кДж;
QP = M(cpm2 t2 – cpm1 t1) = Vн(c/pm2 t2 – c/pm1 t1) , кДж. (4.5)
Теплоемкость газовой смеси следует определять по формулам:
массовая
-
![]() ;
;
объемная
-
![]() ;
;
мольная
-
![]() . (4.6)
. (4.6)
