
- •Содержание
- •1. Тепловые эффекты
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •2. Тепловые свойства. Зависимость теплового
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •3. Энергия Гиббса – критерий термодинамической
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •4. Константа равновесия
- •Примеры решения задач
- •Задачи и упражнения
- •5. Основы химической кинетики и катализа
- •Задачи и упражнения для самостоятельной работы
- •6. Прочность связей в молекулах углеводородов
- •Задачи и упражнения для самостоятельной работы
- •7. Реакции радикалов при термическом
- •Задачи и упражнения для самостоятельной работы
- •8. Химизм и механизм термических превращений
- •Задачи и упражнения для самостоятельной работы
- •9. Соотношение скоростей реакций радикалов
- •Задачи и упражнения для самостоятельной работы
- •10. Процессы переработки нефтяного сырья, протекающие
- •Задачи и упражнения для самостоятельной работы
Примеры решения задач
Задача 1. Выведите уравнение для расчета константы равновесия реакции превращения молекулярного водорода в атомарный через степень превращения исходного реагента: Н2 = 2Н
Решение: Поскольку эта реакция эндотермическая, поэтому нагревание вызовет увеличение в равновесной смеси концентрации атомарного водорода, а охлаждение – молекулярного водорода.
Рассмотрим различные состояния системы этой реакции с момента ее начала до достижения химического равновесия, обозначив при этом степень полноты реакции буквой α.
Реакция |
Н2 = 2Н |
|
Исходное состояние системы |
1 моль |
0 моль |
Равновесное состояние системы |
(1 – α) моль |
2α моль |
Общее количество реагентов |
(1 + α) моль |
|
Парциальные давления реагентов в момент равновесия |
|
|
В соответствии с уравнением: ,
получаем:
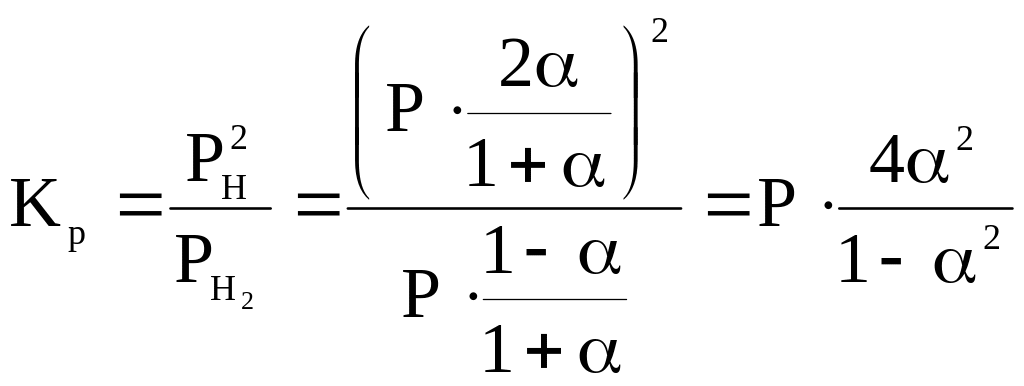
Задача 2. Найдите теоретически возможный выход изобутана по реакции: н-С4Н10 ↔ изо- С4Н10 при температуре 327оС и атмосферном давлении.
Решение:
Из справочных данных (см.приложение, табл.2) находим свободные энергии паров углеводородов при заданной температуре (327оС):
для н-С4Н10 - ∆G600 = 101,7 кДж/моль
для изо- С4Н10 - ∆G600 = 102,6 кДж/моль
Тогда ∆G600 = 101,7 – 102,6 = - 0,9 кДж/моль
Используя уравнение (4,11): ,
н
аходим
![]() Кр
= 1,197
Кр
= 1,197
Выразим выход продукта реакции через α и вычислим парциальные давления веществ в состоянии равновесия, используя закон Дальтона и уравнение (4.8) Pi = Робщ.∙Ni:
н-С4Н10 ↔ изо- С4Н10, тогда сумма молей: 1 – α + α = 1
1 - α α
![]() ,
,
![]()
Затем, зная значение константы равновесия, вычислим по уравнению (4.5) теоретический возможный выход изобутана:
![]() α ≈ 0,55,
т.е. 55% мольн.
α ≈ 0,55,
т.е. 55% мольн.
Задача 3. Найдите значение энергии Гиббса и константу равновесия реакции: ц-С6Н12 ↔ С6Н6 + 3Н2 при температуре 427оC атмосферном давлении, если в этих условиях образовалось 20% бензола.
Решение:
ц-С6Н12 ↔ С6Н6 + 3Н2 , сумма молей: 1 – α + α + 3α = 1 + 3α
1 – α α 3α
Выразим парциальные давления исходных реагентов и продуктов реакции в состоянии равновесия:
![]() ,
,
![]() ,
,
![]()
Затем вычислим константу равновесия:
![]()
lnKp =
∆G = - RTlnKp = - 8,31∙700∙ =
Задачи и упражнения
для самостоятельной работы
№ п/п Задачи |
Условие задачи |
1. |
Найдите значение энергии Гиббса и константу равновесия для реакции алкилирования изобутана бутеном-1:
при температуре 7оС, если образовалось 20% изооктана. Мольное соотношение изо-С4Н10:С4Н8 = 5:1. Побочными реакциями пренебречь. |
2. |
Найдите величину изменения энергии Гиббса, константу равновесия и теоретически возможный выход циклогексана по реакции изомеризации метилциклопентана:
при температуре 327оС и атмосферном давлении. |
3. |
Найдите состав реакционной массы, константу равновесия и значение величины энергии Гиббса для реакции дегидроциклизации гептана:
протекающей при температуре 527оС и давлении 20 атмосфер, если известно, что в этих условиях 30% гептана превратилось в толуол. |
4. |
Найдите зависимость константы равновесия от температуры для реакции: СН4 → С + 2Н2, если lnKp = 1,43 при температуре Т=1110оС lnKp = 2,09 при температуре Т=1500оС. Рассчитайте значение константы равновесия при температуре 1700оС и давлении 5 атмосфер. |
5. |
Для реакции С4Н10 ↔ С4Н6 + 2Н2 найдите значение константы равновесия, если при температуре 527оС и давлении 2 атмосферы выход дивинила составил 60% мольн. Определите, при каких температурах эта реакция будет термодинамичес-ки вероятной. |
№ п/п Задачи |
Условие задачи |
6. |
Для реакции: ц-С6Н12 ↔ С2Н4 + СН2=СН−СН2−СН3 найдите величину энергии Гиббса и соответствующее значение константы равновесия при температуре 527оС и давлении 4 атмосферы. Какое влияние оказывает на эту реакцию давление? |
7. |
Найдите константу равновесия реакции дегидрирования метилциклогексана:
если выход толуола составляет 70%. Как изменится константа равновесия, если давление в системе повысится до 3 атмосфер? |
8. |
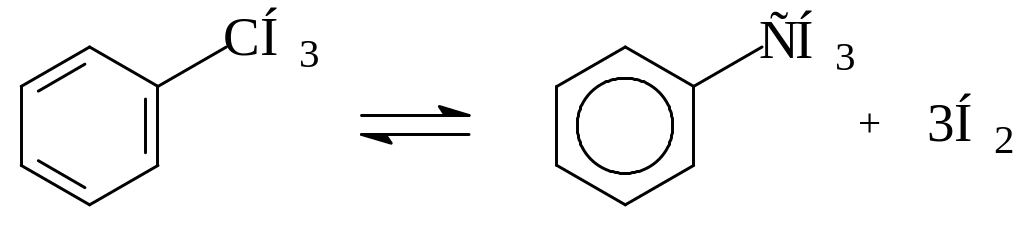
Найдите температуру, соответствующую 80%-ному превращению циклогексана в бензол:
При каких температурах эта реакция термодинамически вероятна? |
9. |
Рассчитайте константу равновесия, соответствующую 40%-ному превращению изооктана в м-ксилол по реакции:
б) если давление в системе равно 5 ат; |
10. |
Для реакции алкилирования бензола пропиленом константа равновесия при температуре 227оС и давлении 1 атмосфера равна Кр=847. Найдите величину изменения свободной энергии для этой реакции, общее давление в системе повысится до 5 ат. |
11. |
Определите температуру, соответствующую 99%-ному прев-ращению этилена в этан по реакции: С2Н4 + Н2 ↔ С2Н6, если известно, что константы равновесия этой реакции при давлении в системе 1 атмосфера соответственно равны: при t = 500оС lnКр = 2,5 при t = 600оС lnКр = 1,5 |
№ п/п Задачи |
Условие задачи |
12. |
Чему равна величина энергии Гиббса для реакции дегидрирования этана до этилена: С2Н6 ↔ С2Н4 + Н2 при температуре 827оС и давлении 1 атмосфера? Рассчитайте выход этилена в этих условиях и значение константы равновесия. Как изменится энергия Гиббса, если давление увеличить в 2 раза? |
13. |
Для изомеризации циклогексана в метилциклопентан известна температурная зависимость энергии Гиббса: ∆G = - 3930 + 9,15Т Найдите температурный предел термодинамической вероятности протекания этой реакции, константу равновесия и выход метилциклопентана при температуре 20оС. |

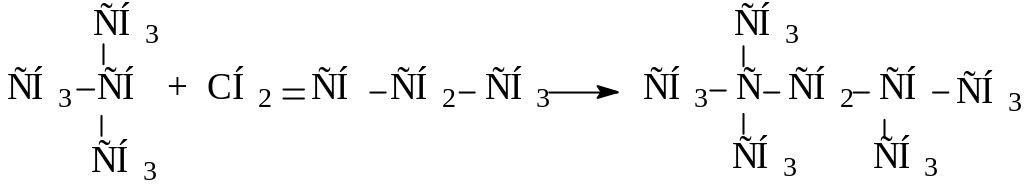


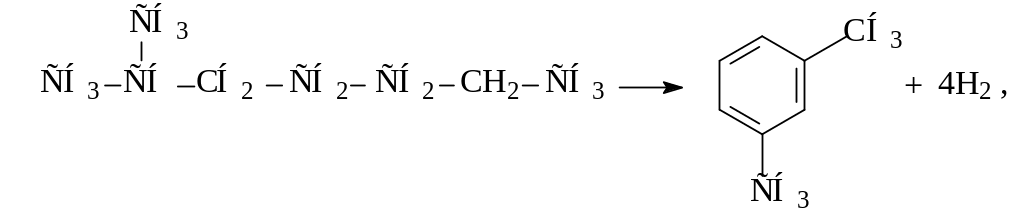 а)
если давление в системе равно 1 ат;
а)
если давление в системе равно 1 ат;