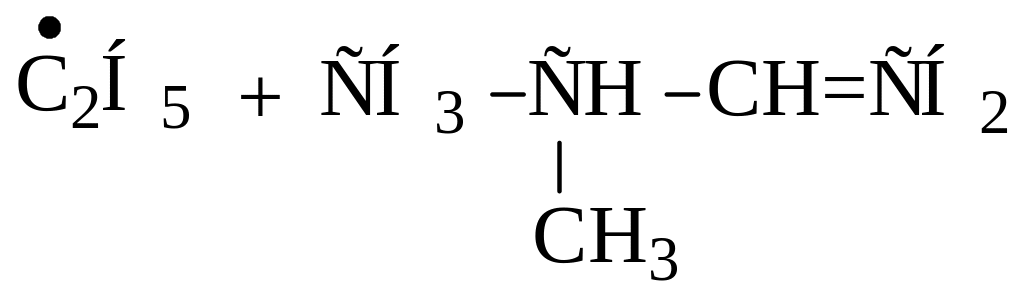- •Содержание
- •1. Тепловые эффекты
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •2. Тепловые свойства. Зависимость теплового
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •3. Энергия Гиббса – критерий термодинамической
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •4. Константа равновесия
- •Примеры решения задач
- •Задачи и упражнения
- •5. Основы химической кинетики и катализа
- •Задачи и упражнения для самостоятельной работы
- •6. Прочность связей в молекулах углеводородов
- •Задачи и упражнения для самостоятельной работы
- •7. Реакции радикалов при термическом
- •Задачи и упражнения для самостоятельной работы
- •8. Химизм и механизм термических превращений
- •Задачи и упражнения для самостоятельной работы
- •9. Соотношение скоростей реакций радикалов
- •Задачи и упражнения для самостоятельной работы
- •10. Процессы переработки нефтяного сырья, протекающие
- •Задачи и упражнения для самостоятельной работы
Задачи и упражнения для самостоятельной работы
№ п/п Задачи |
Условие задачи |
1. |
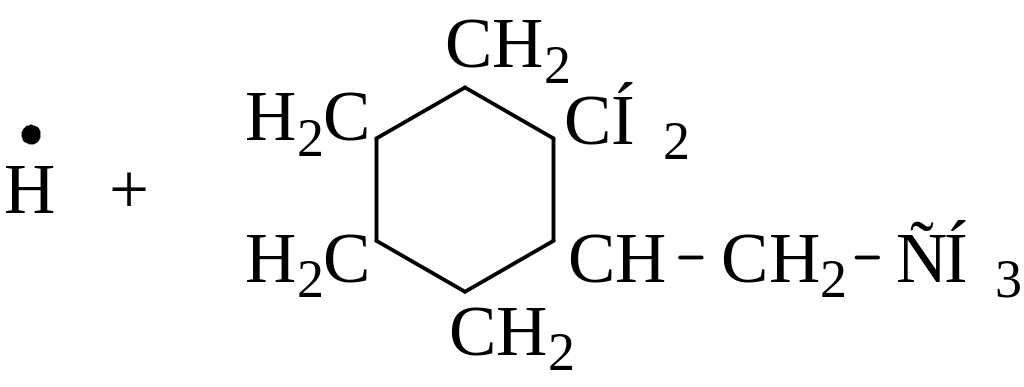
Напишите возможные реакции замещения и укажите наиболее вероятную из них:
|
2. |
Напишите все мономолекулярные реакции, в которые могут вступить радикалы:
|
3. |
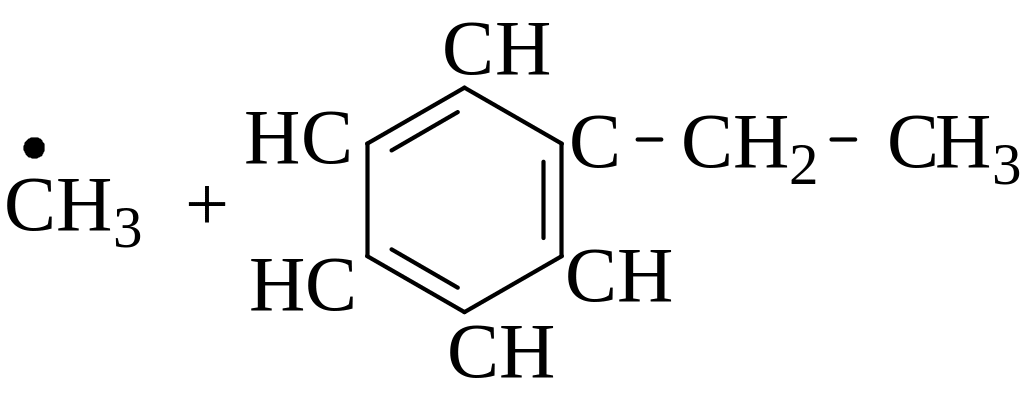
Напишите возможные реакции замещения и укажите наименее вероятную из них:
|
4. |
Напишите возможные реакции присоединения и замещения, а также расположите в порядке возрастания трудности их осуществления:
|
5. |
Напишите возможные реакции замещения и укажите наиболее вероятную из них:
|
6. |
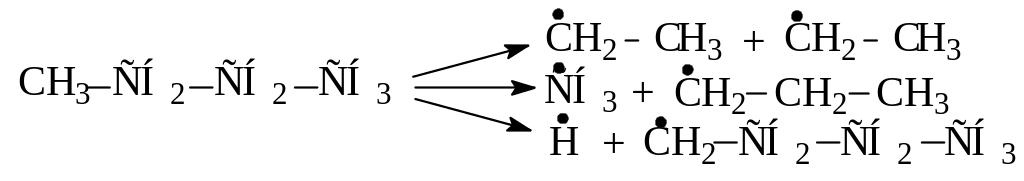
Напишите возможные реакции замещения атома водорода с углеводородами:
Какая из этих реакций пойдет наиболее легко? Какая наиболее трудно? |
8. Химизм и механизм термических превращений
углеводородов в процессах пиролиза и крекинга
При термических превращениях углеводородов всех типов в соответствии с принципом Ле-Шателье свободные радикалы наиболее легко возникают при низких давлениях и высоких температурах, т.к. реакции распада являются эндотермическими. Их стабильность уменьшается с увеличением длины радикала, а концентрация уменьшается с повышением давления. Следовательно, легкие нефтепродукты в термических процессах будут подвергаться распаду при наиболее жестком режиме, а для распада тяжелых нефтепродуктов потребуется нагрев сырья при меньших температурах.
Рассмотрим термические превращения углеводородов различных классов.
1. Парафиновые углеводороды.
Наиболее легко подвергаются крекингу парафиновые углеводороды. Первоначальным направлением распада является образование двух углеводородов, один из которых – предельного, а другой - непредельного характера. Согласно прочности связей в парафиновых углеводородах распад в основном происходит по середине цепи молекулы. Например, при термическом распаде н-декана образуются молекулы пентана и пентена:
С10Н22 → С5Н12 + С5Н10
Параллельно могут протекать реакции расщепления и по другим связям молекулы н-декана с образованием углеводородов в порядке убывания термодинамической вероятности с: шестью > семью > восемью > девятью атомами углерода, и, наоборот, в порядке возрастания термодинамической вероятности с: одним < двумя < тремя < четырьмя атомами углерода.
Большинство ученых рассматривает термическое разложение парафиновых углеводородов как свободно-радикальный процесс. Согласно цепному механизму распада парафиновых углеводородов, первичный распад молекулы происходит по связи С-С с большей вероятностью, чем по связи С-Н и дает радикалы, обладающие неспаренным электроном:
С увеличением молекулярной массы углеводорода возрастает число элементарных актов, разнообразие образующихся радикалов. На примере первичного распада бутана можно представить следующую схему термолиза (пиролиза или термического крекинга).
1. Инициирование цепи:
2. Развитие цепи может идти по двум направлениям:
а) образующиеся из исходного сырья относительно крупные радикалы (неустойчивые – С3 и выше) самопроизвольно распадаются по β-правилу с образованием более мелких, следовательно более устойчивых радикалов или атома водорода и соответствующих олефиновых углеводородов
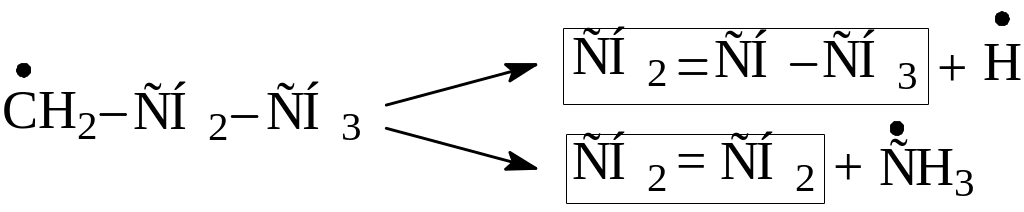
б) более мелкие, следовательно более устойчивые радикалы вступают в реакцию с молекулами исходного углеводорода, отрывая от них атом водорода
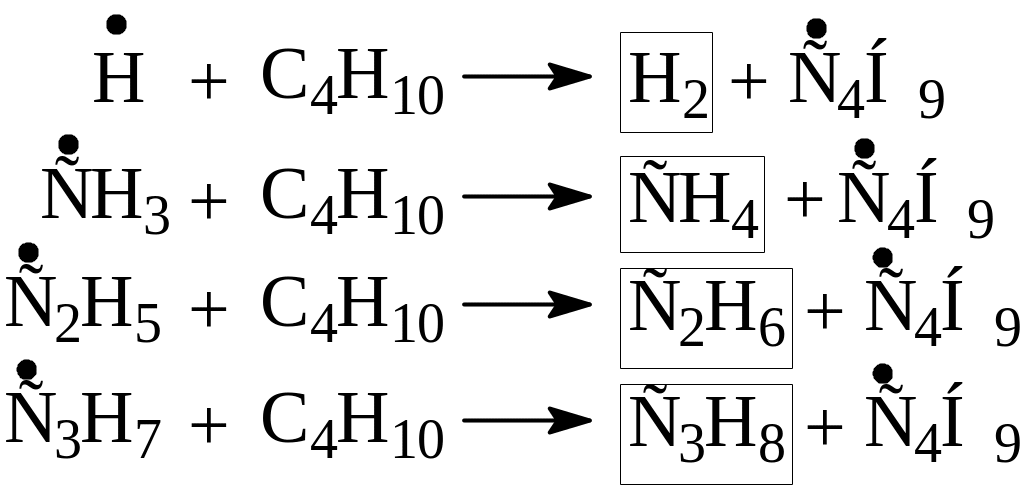
Таким образом, в качестве конечных продуктов образуются водород, метан, этан, пропан, пропилен. Кроме того, в зависимости от режимных условий проведения процесса (температура, давление, скорость реакции) в небольшом количестве могут образоваться более ненасыщенные углеводороды (ацетилен и диены), а также продукты вторичных реакций полимеризации.
Поскольку энергия связи С–Н значительно выше, чем энергия связи С–С, поэтому образование первичных бутильных радикалов менее вероятно. Кроме того, энергия связи С–Н зависит от места расположения атома водорода в молекуле. В термических процессах вероятности отрыва от молекулы углеводорода первичного, вторичного и третичного атомов водорода соотносятся как 1:2:10.
Установлено, что при термическом крекинге парафиновых углеводородов практически не происходит изомеризации, что сказывается отрицательно на качестве бензинов термического крекинга из-за отсутствия необходимого количества изоалканов, являющиеся высокооктановыми компонентами и обеспечивающие антидетонационные свойства моторных топлив.
2. Нафтеновые углеводороды.
Нафтены часто присутствуют в нефти и нефтепродуктах в виде пяти- и шестичленных колец, в том числе с боковыми алкильными цепями.
Нафтеновые углеводороды в условиях термического крекинга могут превращаться по трем направлениям:
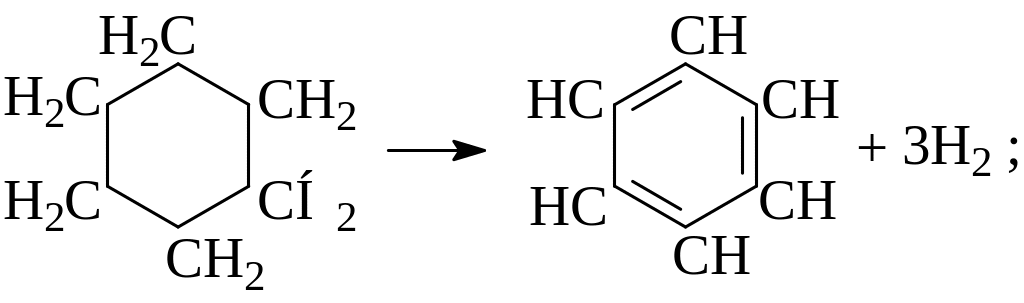
а) дегидрогенизация колец (циклогексан) с образованием ароматических углеводородов (бензол):
б) отрыв боковой цепи от кольца;
в) разрыв кольца с образованием углеводорода с прямой цепью.
Незамещенные пятичленные нафтеновые кольца термически стабильны, занимают промежуточное положение между парафинами и ароматическими углеводородами, и не подвергаются дегидрированию при обычных температурах крекинга. При более жестких условиях распад пятичленных нафтенов происходит по С–С связи с разрывом кольца.
Незамещенные шестичленные нафтеновые кольца разлагаются при температуре около 500оС, образуя большое количество водорода, углеводородов ненасыщенного характера (этилен и бутадиен) и бензола. Первичный распад шестичленных нафтенов по связи С – С в кольце приводит к его разрыву с образованием бирадикала:


Затем бирадикал распадается на стабильные молекулы:
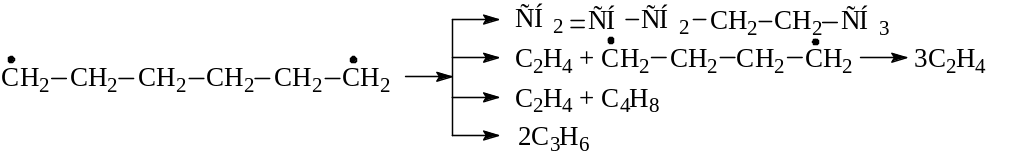 Таким
образом, распад нафтенов протекает по
нецепному механизму. Однако, как видно
по этой схеме, распад нафтенов приводит
к накоплению в реакционной смеси олефинов
и процесс уже при небольшой глубине
крекинга начинает развиваться по
радикально-цепному механизму за счет
расщепления ненасыщенных углеводородов:
Таким
образом, распад нафтенов протекает по
нецепному механизму. Однако, как видно
по этой схеме, распад нафтенов приводит
к накоплению в реакционной смеси олефинов
и процесс уже при небольшой глубине
крекинга начинает развиваться по
радикально-цепному механизму за счет
расщепления ненасыщенных углеводородов:
![]()
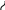
Образующиеся при этом радикалы (например, метильный радикал) взаимодействуют с исходной молекулой нафтенового углеводорода, отрывая от него атом водорода и превращаясь в стабильную молекулу:
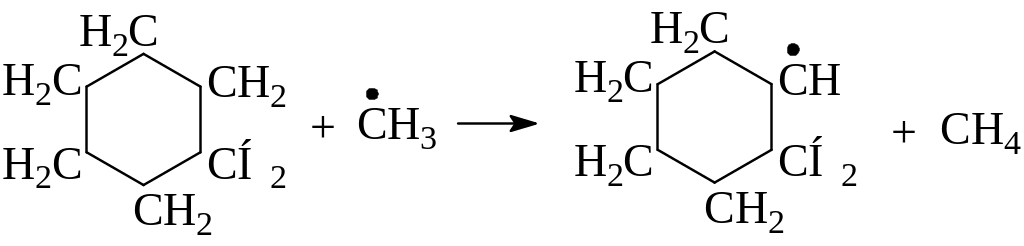
Затем, вновь образованные нафтеновые радикалы превращаются по следующей схеме:
(1)
(2)
(3)


По реакции (1) при высоких температурах дегидрирование циклоолефинового радикала протекает не по цепному механизму и приводит к накоплению в продуктах крекинга циклоолефиновых и ароматических углеводородов:
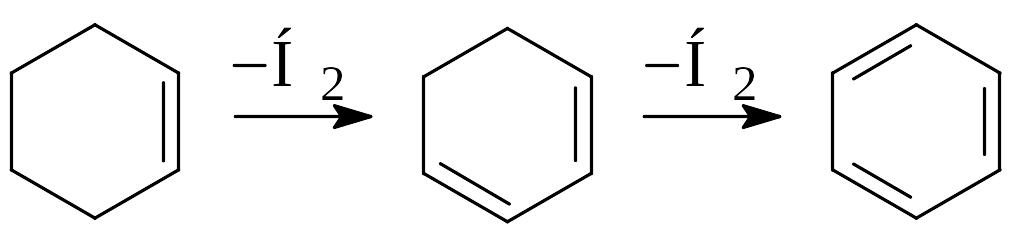
Реакции благоприятствует пониженное давление, но при этом в реакционной смеси циклодиеновые углеводороды отсутствуют, а циклогексен в продуктах распада образуется, по-видимому, не из циклогексана, а в результате вторичной реакции бутадиена и этилена:
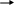
 СН2=СН–СН=СН2
+ СН2=СН2
СН2=СН–СН=СН2
+ СН2=СН2
По реакции (2) образующийся крупный олефиновый радикал, являясь неустойчивым, расщепляется с образованием олефинов и более мелких радикалов:
![]()
По реакции (3) идет взаимодействие олефинового радикала с исходной молекулой нафтена с образованием циклоолефинового радикала, который после дегидрирования также как и по реакции (1) может дать ароматические углеводороды:
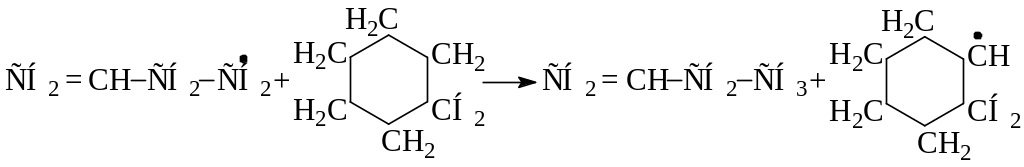
Бициклические нафтены при температуре 600оС и выше подвергаются дециклизации, деалкилированию и дегидрированию:
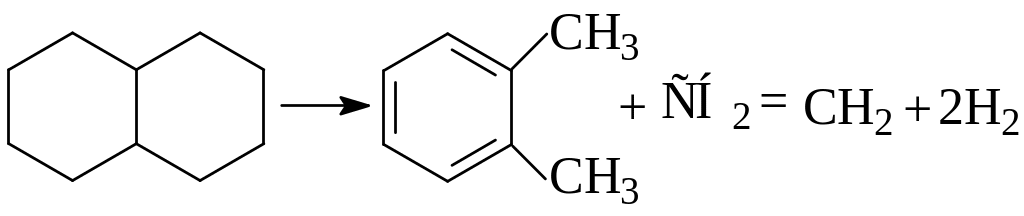


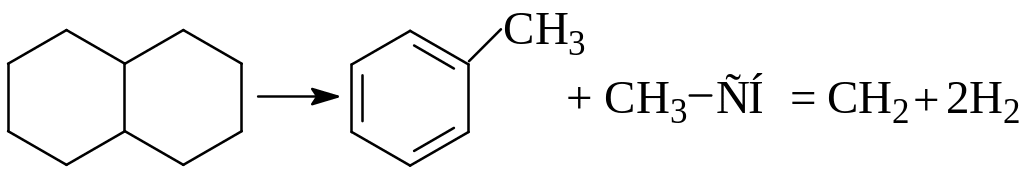
Полинафтеновые углеводороды при температурах 500-600оС распадаются с выделением водорода, а при более высоких температурах образуют много газообразных непредельных углеводородов.
3. Олефиновые углеводороды.
Непредельные углеводороды (олефины) в исходных (нативных) нефтях не содержатся, но они могут содержаться в нефтяном сырье вторичного происхождения (термические и термокаталитические процессы переработки нефти и нефтепродуктов, а также процессы глубокой переработки нефти). Олефины являются продуктами первичного распада парафиновых и нафтеновых углеводородов.
Олефины характеризуются наличием двойной связи, что определяет высокую их реакционную способность. Им свойственны весьма разнообразные термические превращения, направление которых зависит от температуры и давления. Термическая устойчивость олефинов в отношении реакций распада выше по сравнению с парафинами. В условиях крекинга при умеренных температурах и повышенных давлениях они склонны к реакции полимеризации, а при повышенных температурах и низком давлении способны распадаться на более простые молекулы. При очень жестких режимах пиролиза и крекинга из непредельных могут образоваться ароматические углеводороды. Также, весьма важной является способность олефинов к конденсации с ароматическими углеводородами с образованием высокомолекулярных продуктов уплотнения (смолы пиролиза).
Механизм первичных реакций термического разложения олефинов, как и для парафинов, является радикально-цепным. При этом первичный распад олефина происходит по β-связи, т.е. по наиболее слабой связи С-С, находящейся в сопряжении с двойной (кратной). Например, β-гексен будет распадаться на дивинильный и этильный радикалы:
![]()
Затем, образовавшиеся радикалы будут взаимодействовать с исходной молекулой гексена, отрывая при этом от него атом водорода по β-связи С-Н, находящейся в сопряжении с двойной:
![]()
![]()
Радикал
![]() является термически неустойчивым, и
его распада с наибольшей вероятностью
происходит по β-связи
относительно неспаренного атома углерода
с отрывом метильного радикала:
является термически неустойчивым, и
его распада с наибольшей вероятностью
происходит по β-связи
относительно неспаренного атома углерода
с отрывом метильного радикала:
![]()
Из алкенов наиболее устойчивым является этилен. Он всегда содержится в продуктах пиролиза и крекинга нефтяного сырья как первичный и вторичный продукт их превращения.
Этилен при высокой температуре (выше 660оС) и низком давлении заметно начинает распадаться и подвергаться дегидрированию по схеме:
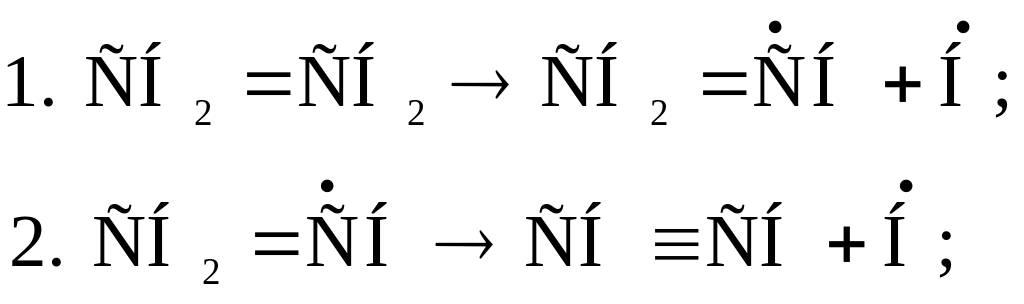
![]()
Суммарную реакцию можно записать:
![]()
При температурах ниже 600оС винильный радикал может вступать только в реакцию присоединения с исходной молекулой этилена и цепной процесс развивается по схеме:
![]()
![]() (I)
(I)
![]() (II)
(II)
Чем ниже температура и выше давление, тем больше роль реакции (I) с накоплением бутилена, и наоборот, чем выше (>600оС) и ниже давление, тем больше роль реакции (II), и в продуктах термолиза этилена появляются бутадиен и водород в результате дегидрирования бутена-1.
При температурах 400-600оС в основном протекает полимеризация этилена:
2С2Н4 → С4Н8
Пропилен при высокой температуре и низком давлении расщепляется с образованием водорода, метана, этилена и аллена:
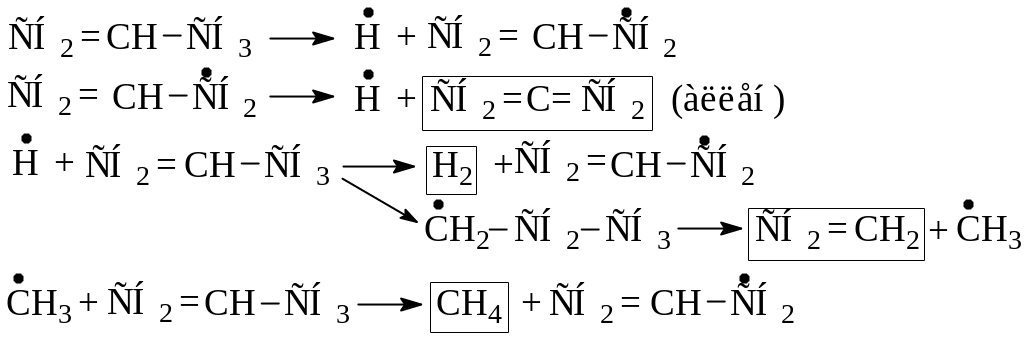
При относительно невысокой температуре и атмосферном давлении основной реакцией аллильного радикала становится присоединение по двойной связи к исходной молекуле. Таким образом происходит димеризация пропилена с образованием радикала :
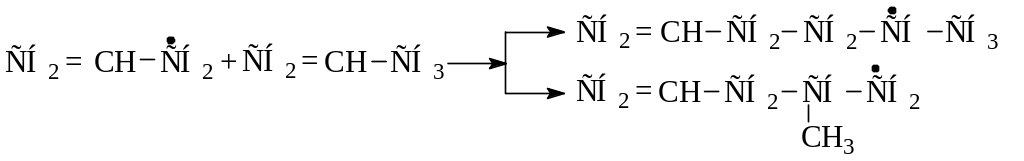 Реакции
радикалов
дают сложную смесь продуктов. Основными
продуктами их реакций являются водород,
метан, этилен, пропилен, бутилен, бутадиен
и жидкие продукты.
Реакции
радикалов
дают сложную смесь продуктов. Основными
продуктами их реакций являются водород,
метан, этилен, пропилен, бутилен, бутадиен
и жидкие продукты.
Циклические олефины более устойчивы, чем соответствующие олефины с открытой цепью и распадаются по нецепному механизму через образование бирадикалов:
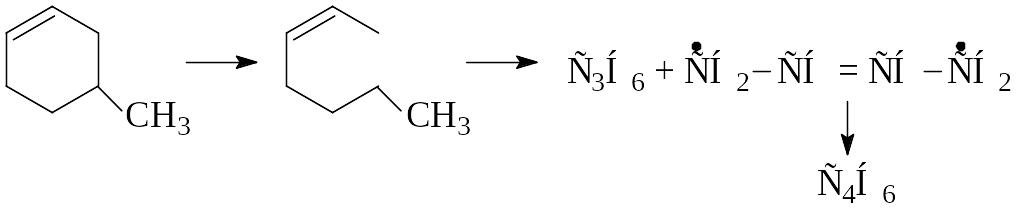
Наряду с полимеризацией и разложением происходит циклизация и дегидрогенизация олефинов. При наличии насыщенных углеводородов в продуктах крекинга олефинов и в результате их разложения, а также реакции перераспределения водорода может образоваться реакционная смесь, состоящая из меньшей молекулярной массы парафина и диолефина.
4. Диеновые и ацетиленовые углеводороды.
Диеновые и ацетиленовые углеводороды при термолизе являются продуктами глубоких превращений нефтяного сырья. Эти углеводороды склонны к реакциям уплотнения путем полимеризации и конденсации с алкенами с образованием циклических углеводородов.
При относительно невысоких температурах (ниже 400оС) и низком давлении диолефины претерпевают превращение не по цепному механизму, а по молекулярному через образование шестичленного активированного комплекса:
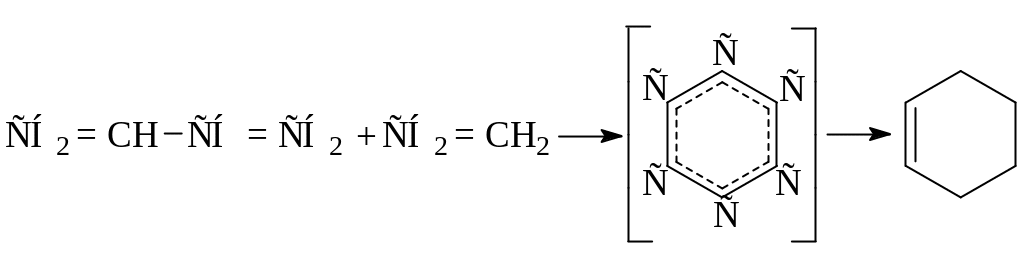
Образующиеся циклоолефины легко дегидрируются до ароматических углеводородов:
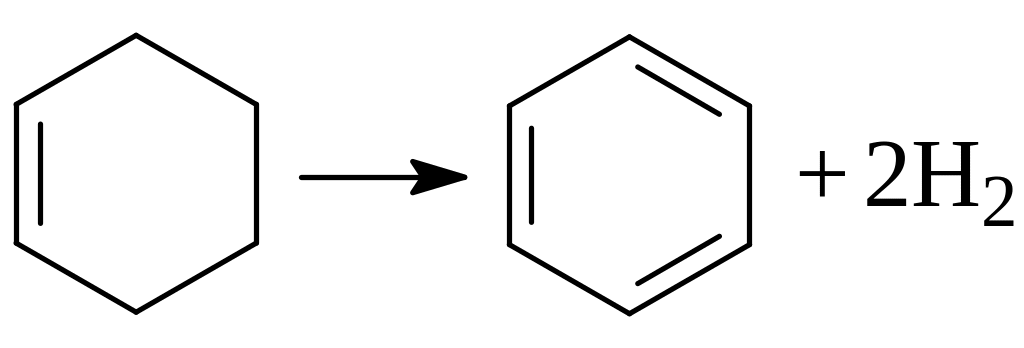
Подобным образом протекает реакция между двумя молекулами дивинила:

В сложной реакционной смеси при крекинге и пиролизе олефины и диолефины способны реагировать с углеводородами других классов. Например, при температурах крекинга термодинамически вероятна реакция алкилирования ароматических углеводородов алкенами (1) и их конденсация с алкадиенами (2):
(1)
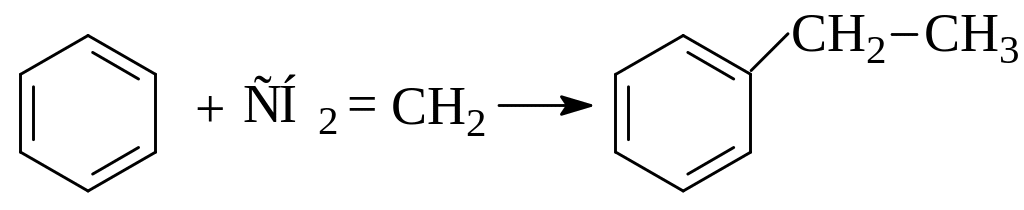
(2)

При температуре 700оС основное значение приобретает радикально-цепное разложение. Например, цепной распад ацетилена можно представить в виде схемы:
![]()
![]()
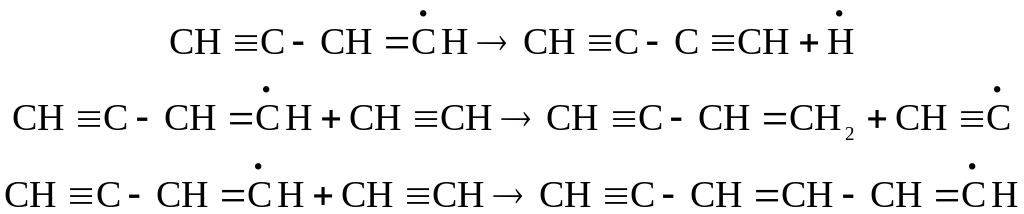
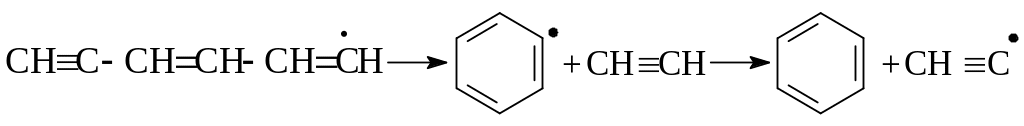
В результате этих реакций образуются сильно ненасыщенные соединения большей молекулярной массы и ароматические углеводороды.
5. Ароматические углеводороды.
Незамещенные или метилзамещенные бензол и нафталин термически более устойчивы, чем парафины. Ароматические углеводороды с длинной боковой цепью разлагаются быстрее парафинов. Это связано с распределением энергии между связями в молекуле. Термодинамически наиболее вероятной реакцией незамещенных ароматических углеводородов является распад на элементы. Однако эта реакция является достаточно энергоемкой и имеет место только при очень высоких температурах.
Для алкилзамещенной ароматики характерна реакция деалкилирования по наиболее слабой связи С-С, находящейся в сопряжении с углеродным атомом в кольце, т.е. распад по β-правилу:
Основными продуктами их превращения являются толуол, стирол, непредельные и парафиновые углеводороды.
Особенностью ароматических углеводородов является склонность их к реакциям уплотнения с образованием конденсированных структур. В условиях термических процессов ( пиролиз, крекинг, коксование) эти углеводороды подвергаются дегидроконденсации и полимеризации по цепному механизму:
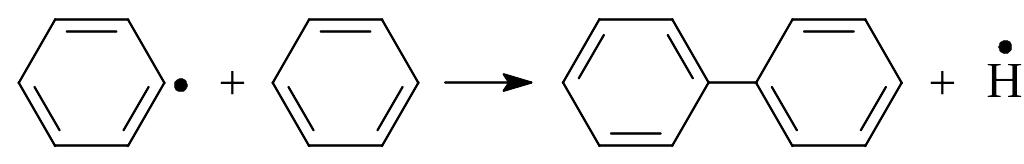
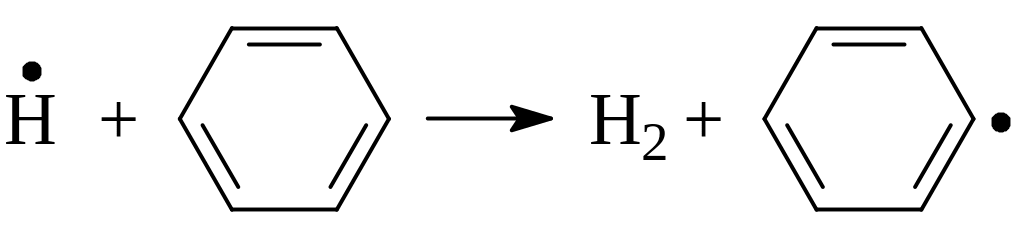
В результате этих реакций образуются дифенил и водород.
В случае толуола в результате подобных реакций образуются дибензил и водород. Но при дальнейшем повышении температуры образующийся дибензил также подвергается разложению с образованием бензильного радикала и процесс развивается по цепному механизму.
Ароматические радикалы вступают в реакции рекомбинации, приводящие к усложнению структуры образующихся молекул и к обеднению их водородом.
Продукты уплотнения ароматических углеводородов являются исходным материалом для образования смолисто-асфальтеновых и коксовых веществ. Каждый последующий продукт уплотнения обладает все более высокими молекулярной массой и степенью ароматичности, а также уменьшающейся растворимостью в органических растворителях (бензол, толуол, СНCl3-хлороформ, CCl4-четыреххлористый углерод, СS4-сероуглерод, хинолин).
6. Сложные углеводородные смеси.
В отличие от индивидуальных углеводородных соединений нефть, нефтяные фракции и нефтепродукты состоят из большого числа углеводородов различных классов, структуры и строения, каждый из которых влияет на химизм термического превращения исходных веществ в реакционной смеси и определяет состав конечных продуктов протекающих при этом реакций.
Если молекулярные реакции протекают независимо друг от друга, то цепные же реакции, протекающие в данной системе, всегда взаимосвязаны и, как правило, имеют общие стадии инициирования и обрыва цепей.
Соотношение скоростей разложения различных углеводородов в смеси равно соотношению констант скоростей реакций радикалов, ведущих цепь, с данными углеводородами. Соотношение констант скоростей реакций данного радикала с различными углеводородами определяется, главным образом, значениями энергии активации, т.к. значения предэкспоненциальных множителей близки.
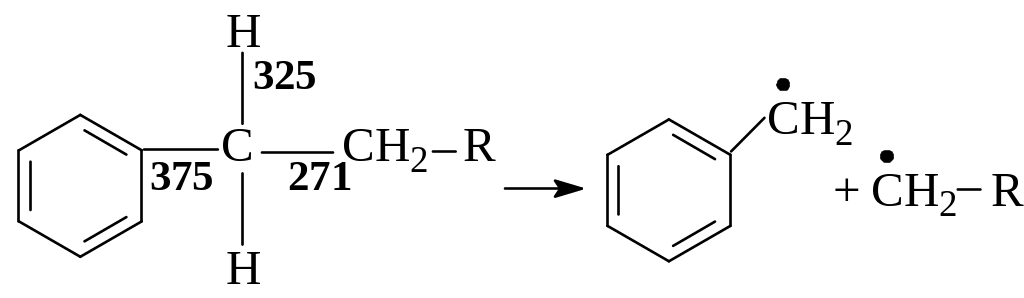
Из углеводородов
нефтяных фракций слабейшие связи,
по-видимому, содержат ароматические
углеводороды с боковыми алкильными
цепями. Так, прочность связи типа
С6Н5СН2–R
зависит от вида
![]() и энергия связи уменьшается при увеличении
числа атомов углерода в
.
При наличии в углеводородной смеси
метилзамещенных ароматических
углеводородов наиболее вероятным
является обрыв цепей в результате
образования бензилподобного радикала
при реакциях типа:
и энергия связи уменьшается при увеличении
числа атомов углерода в
.
При наличии в углеводородной смеси
метилзамещенных ароматических
углеводородов наиболее вероятным
является обрыв цепей в результате
образования бензилподобного радикала
при реакциях типа:
![]() (8.1)
(8.1)
Экспериментально найдено, что термическое разложение углеводородных смесей проходит по реакции первого порядка.
Если исходная смесь углеводородов не содержит алкилароматических соединений, имеющих связи С–С, сопряженные с ароматическим кольцом, то инициирование цепей при образовании небольших количеств олефинов С4 и выше происходит с такой же скоростью. Связано это с тем, что прочность связей С–С, сопряженных с π-связью, в олефинах такая же, как в алкилароматических углеводородах.
Углеводород, разлагающийся термически в чистом виде по нецепному механизму (это происходит вследствие того, что развивающие цепь радикалы образуются с очень малой скоростью) в смеси с другими углеводородами может распадаться по цепному механизму, т.к. стадия инициирования протекает в этом случае со значительно большей скоростью. Таким образом, при термическом разложении смесей углеводородов радикально-цепные реакции играют основную роль.
Следовательно, термический распад углеводорода в смеси с другими углеводородами должен проходить во многих случаях с большей скоростью, чем в чистом виде.
Не менее важно, что крекинг ряда углеводородов в смеси должен сильно тормозиться относительно разложения углеводорода в чистом виде. Это явление характерно для тех случаев, когда радикал, например,
, образующийся при отрыве атома водорода от данного углеводорода R, стабилен относительно распада и с достаточно большой скоростью вступает в реакцию замещения с другими углеводородами, имеющимися в смеси.
Например, при разложении бензола цепь развивается в результате присоединения фенильного радикала к молекуле бензола:
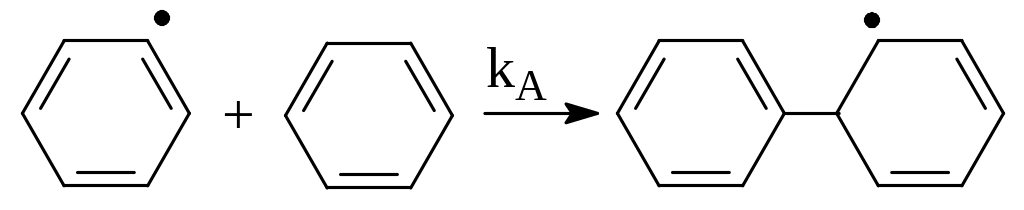 (8.2)
(8.2)
Если же бензол находится в смеси с другими углеводородами, то фенильный радикал может также вступить в реакцию:
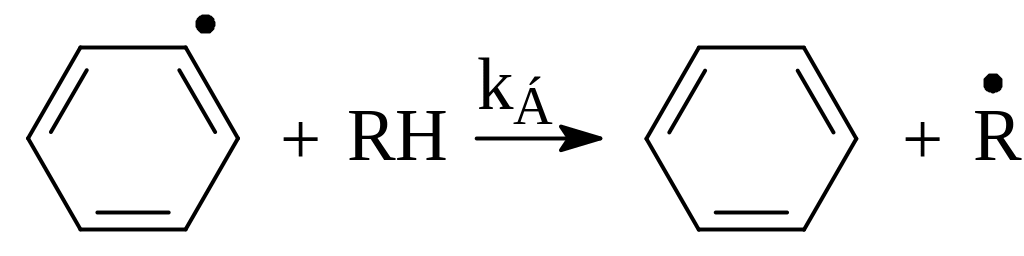 (8.3)
(8.3)
При константе скорости второй реакции во много раз большей, чем первой:
kБ[RH] >> kА[С6Н6] (8.4)
очевидно, что бензол не расходуется.
Действительно, при пиролизе смесей парафино-нафтеновых углеводородов с бензолом последний практически не разлагается при почти полном разложении парафинов и нафтенов.
При термическом разложении этилена при температурах, когда распад винильного радикала по реакции:
![]() (8.5)
(8.5)
несущественен, этилен расходуется в результате реакции:
![]() (8.6)
(8.6)
При крекинге этилена в смеси с другими углеводородами винильный радикал может стабилизироваться в этилен по реакции:
![]() (8.7)
(8.7)
При kБ[RH] >> kА[С2Н4] этилен не расходуется.
В сложных углеводородных смесях в некоторых случаях может существенно изменяться состав продуктов термического распада какого-либо индивидуального углеводорода.
Например, толуол в чистом виде дает при термическом распаде в основном продукты конденсации. А при термическом разложении в смеси с другими углеводородами бензильный радикал легко превращается в толуол:
![]() (8.8)
(8.8)
и конденсация подавляется.
Также может происходить деметилирование толуола по реакции:
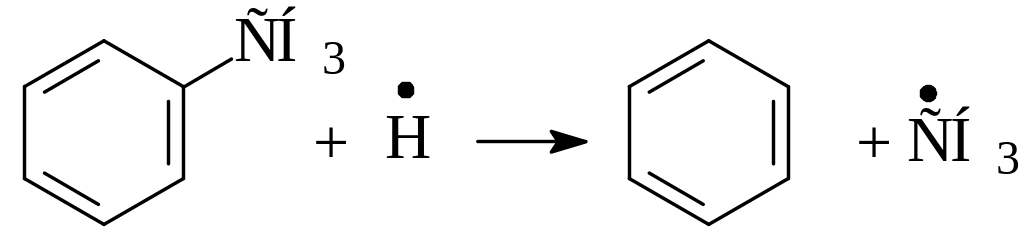
Особенности термических реакций в жидкой фазе
Химизм парофазного и жидкофазного крекинга существенно не отличаются. Имеющиеся отличия в химизме связаны с различием концентрации молекул в единице объема в жидкости и газе.
При атмосферном давлении в 1 см3 газа содержится приблизительно 1019 молекул, а в 1 см3 жидкости – приблизительно 1021 молекул. Концентрация молекул в жидкости такая же, как в газе под давлением 10 МПа. Поэтому проведение крекинга в жидкой фазе с точки зрения соотношения скоростей моно- и бимолекулярных реакций равносильно проведению их в газовой фазе под высоким давлением. В результате при равных температурах жидкофазные термические реакции углеводородов и нефтепродуктов дают значительно больший выход продуктов конденсации и меньше продуктов распада.
Одним из факторов, вносящим различие между жидкофазным и газофазным крекингом, является сольватация молекул в жидкой фазе. В жидкой фазе осуществляется межмолекулярное взаимодействие между близрасположенными частицами, которое в общем случае называется сольватацией. Различают неспецифическую и специфическую сольватацию. Неспецифическая сольватация под действием сил Ван-дер-Ваальса (ориентационные, индукционные и дисперсионные). Специфическая сольватация связана со специфическими насыщаемыми силами, вызывающими образование водородных связей, π-комплексов и других донорно-акцепторных комплексов. Неспецифическая сольватация осуществляется всегда независимо от полярности молекул веществ, находящихся в жидкой фазе. но для полярных молекул она очень слаба и существенно влиять на скорость реакции не может, особенно при высоких температурах. Для полярных и поляризуемых частиц межмолекулярное взаимодействие имеет электростатическую природу и значительно сильнее.
В современной нефтеперерабатывающей и нефтехимической промышленности имеют место как парофазное (пиролиз), так и жидкофазное (коксование) термическое превращение углеводородного сырья.
Суммарные реакции, протекающие при пиролизе и коксовании можно разделить на три основные группы:
● первичные реакции распада и дегидрирования;
● вторичные реакции превращения с участием олефинов;
● реакции прямого молекулярного распада, вследствие которого образуются пироуглерод, водород и частично ацетилен.
В процессах пиролиза при высоких температурах молекулы имеют высокую энергонасыщенность, в результате чего возрастает концентрация радикалов. Это приводит к уменьшению длины цепи углеводородов и увеличению роли радикально-нецепного разложения, когда отдельные углеводороды разлагаются независимо друг от друга.
Повышение температуры в большей степени ускоряет реакции, протекающие с более высокими энергиями активации. С повышением температуры возрастает значение более энергоемких реакций распада радикалов по сравнению с менее энергоемкими реакциями присоединения.
Температурный режим пиролиза необходимо выбирать так, чтобы скорость первичных реакций была выше скорости вторичных реакций, но температура должна быть не настолько высокой, чтобы не начали преобладать реакции молекулярного распада.
В процессе коксования одним из целевых продуктов является нефтяной кокс. Он образуется преимущественно при термическом разложении ароматических углеводородов. Сырье, содержащее парафиновые, нафтеновые и алкилароматические углеводороды, претерпевает сначала разложение, подготавливающее материал для последующих реакций уплотнения. Таким материалом в основном являются голоядерные ароматические и непредельные углеводороды. Термические превращения протекают по следующей схеме:
Алкилароматические Нафтены Парафины
 углеводороды
углеводороды
Голоядерные ароматические Непредельные
углеводороды углеводороды
Полициклические Алкенил-
ароматические ароматические
углеводороды углеводороды

 Смолы
Смолы
Асфальтены
Карбены
Карбоиды
Кокс
Скорость разложения исходного сырья, в т.ч. ароматики зависит от ее строения и режима крекинга.
Кокс – твердое вещество с высоким содержанием углерода, нерастворимого в бензоле. Кокс состоит из карбенов – веществ нерастворимых в бензоле, но растворимых в сероуглероде, и карбоидов, нерастворимых во всех растворителях. Атомное соотношение С:Н в коксе составляет 2÷4, а для образцов, полученных при низких температурах, оно значительно ниже – 1,1÷1,25.
Содержание карбенов в коксе очень невелико – обычно не более 2% масс., и тем ниже, чем выше температура образования кокса. Карбены являются высокомолекулярными веществами и представляют собой несшитые полимеры с молекулярной массой 100-135 тыс.
Карбоиды являются сшитыми трехмерными полимерами, значительная часть атомов углерода которого занята в конденсированных ароматических структурах.
При термическом разложении в жидкой фазе парафиновых, олефиновых и циклопарафиновых углеводородов кокс образуется в результате вторичных реакций продуктов их глубокого разложения. Непосредственно из этих углеводородов кокс не образуется.
Образование кокса происходит в результате ряда последовательных реакций конденсации, дающих продукты с увеличивающимися молекулярной массой и ароматизированностью.
Процесс коксообразования протекает по радикально-цепному механизму. Асфальтены, образовавшиеся при уплотнении ароматических углеводородов, вступают в дальнейшие реакции поликонденсации.
Основные реакции термического
превращения углеводородов
Распад.
Дегидрирование.
Полимеризация.
Циклизация непредельных углеводородов.
Деалкилирование.
Дециклизация.
Деструктивная конденсация олефинов.
Конденсация диолефинов с моноолефинами с образованием циклических структур.
Конденсация ароматических углеводородов.
Реакции глубокого уплотнения до кокса.