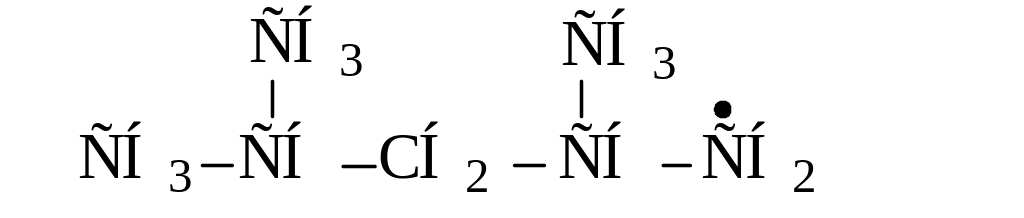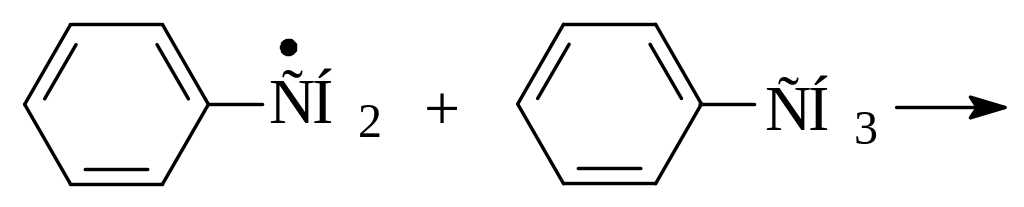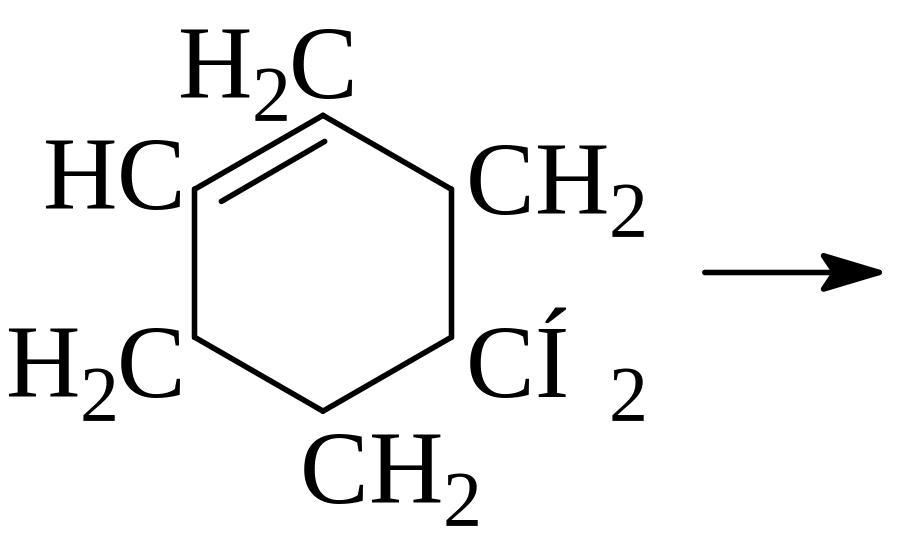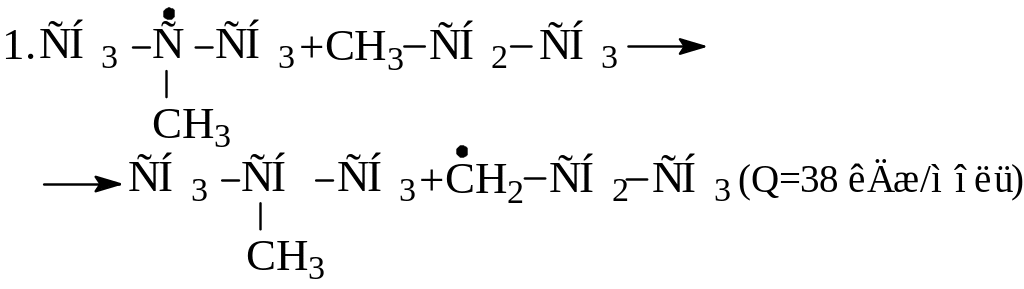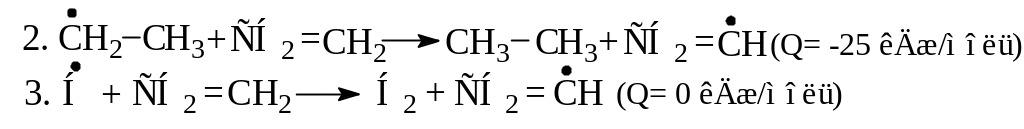- •Содержание
- •1. Тепловые эффекты
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •2. Тепловые свойства. Зависимость теплового
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •3. Энергия Гиббса – критерий термодинамической
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •4. Константа равновесия
- •Примеры решения задач
- •Задачи и упражнения
- •5. Основы химической кинетики и катализа
- •Задачи и упражнения для самостоятельной работы
- •6. Прочность связей в молекулах углеводородов
- •Задачи и упражнения для самостоятельной работы
- •7. Реакции радикалов при термическом
- •Задачи и упражнения для самостоятельной работы
- •8. Химизм и механизм термических превращений
- •Задачи и упражнения для самостоятельной работы
- •9. Соотношение скоростей реакций радикалов
- •Задачи и упражнения для самостоятельной работы
- •10. Процессы переработки нефтяного сырья, протекающие
- •Задачи и упражнения для самостоятельной работы
Задачи и упражнения для самостоятельной работы
№ п/п Задачи |
Условие задачи |
1. |
Напишите реакции, в которые может вступить радикал:
|
2. |
Напишите механизм пиролиза (термического распада) 2-метилпентана:
|
3. |
Напишите возможные направления распада радикалов, которые могут образоваться при взаимодействии:
Укажите, какие из этих направлений наиболее вероятны. |
4. |
Напишите механизм реакции конденсации ароматических углеводородов в процессе термического крекинга:
Назовите название конечного продукта реакции. |
5. |
Напишите механизм реакции перераспределения водорода на примере:
|
6. |
Напишите механизм термической полимеризации пропилена. |
7. |
Напишите реакции замещения, которые могут пройти при взаимодействии:
и укажите наиболее вероятную из них. |
8. |
Напишите реакции замещения, которые могут пройти при взаимодействии:
и укажите наиболее вероятную из них. |
№ п/п Задачи |
Условие задачи |
9. |
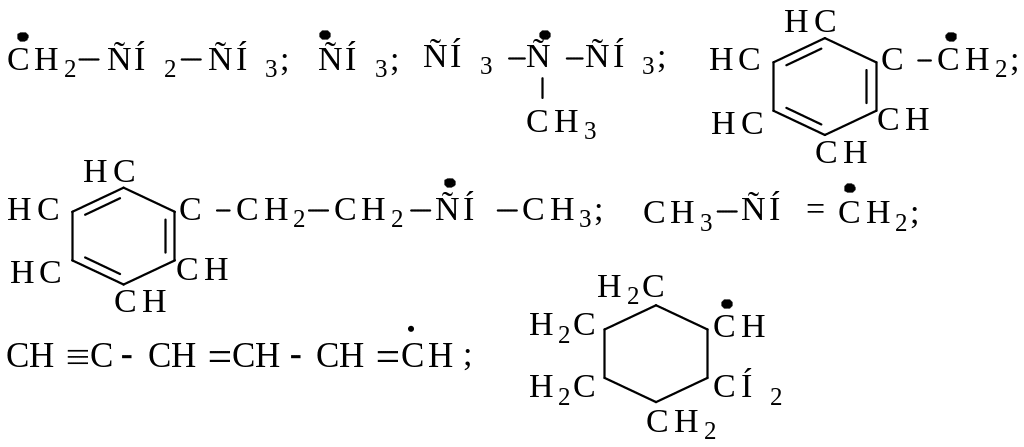
Расположите в ряд в порядке возрастания устойчивости следующие радикалы:
|
10. |
Напишите все возможные продукты β-распада радикалов, приведенных ниже. Какие продукты можно ожидать в наибольшем количестве?
|
11. |
Какая реакция пойдет наиболее легко? Докажите это, рассчитав энергии активации этих реакций. Протекание какой из них будет наиболее трудным?
|
9. Соотношение скоростей реакций радикалов
Поскольку
радикал может вступать в несколько
различных реакций, направление
преимущественного его превращения
определяется соотношением скоростей
всех возможных реакций. Скорости же
реакций определяются видом, как радикала,
так и молекул, с которыми он может
прореагировать, а также условиями
процесса, т.е. температурой и давлением
в системе. Например, в системе
![]() возможны следующие реакции:
возможны следующие реакции:
мономолекулярная
реакция распада:
![]() ;
;
бимолекулярные реакции замещения:
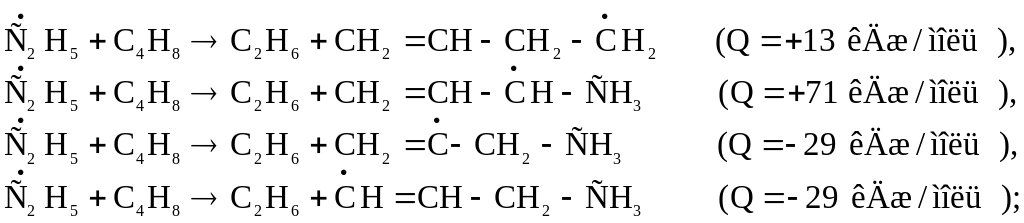
бимолекулярные реакции присоединения:
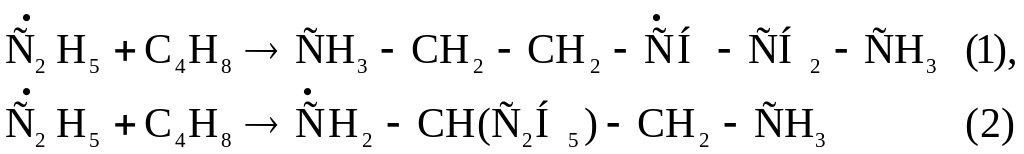
Q(1)=Q(2)=+29,3 кДж/моль,
а также реакции рекомбинации и диспропорционирования:
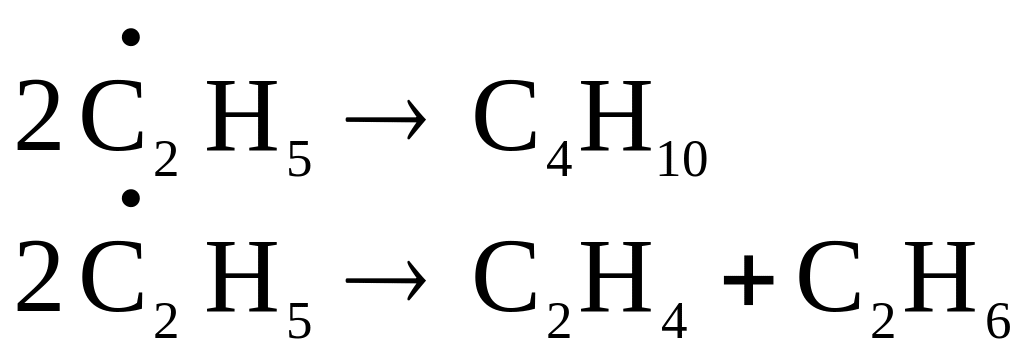
Тогда, константы скорости образования радикалов и стабильных молекул будут равны:
![]()
При одинаковых предэкспоненциальных множителях (А1=А2) соотношение скоростей реакций будет равно:
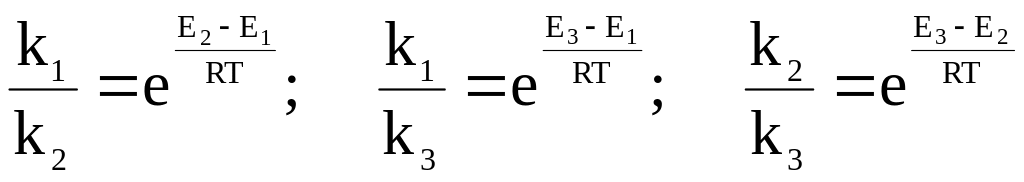 …
…
Например, распад между атомами может идти с разобщением электронной пары, осуществляющей данную связь, или без него. В первом случае образуются радикалы, во втором – ионы:
1.
![]() − гомолитический (радикальный) разрыв
связи;
− гомолитический (радикальный) разрыв
связи;
2.
![]() − гетеролитический (ионный) разрыв
связи.
− гетеролитический (ионный) разрыв
связи.
Энергии активации этих реакций равны Е1=360 кДж/моль и Е1=1206 кДж/моль, соответственно, и при температуре 600оС соотношение скоростей реакций k1:k2 составляет примерно 1050. Следовательно, распад на ионы практически ничтожен относительно распада на радикалы.
Увеличение температуры и уменьшение давления интенсифицирует мономолекулярные реакции распада, а уменьшение температуры и увеличение давления повышают роль бимолекулярных реакций замещения присоединения.
Для алкильных радикалов со значительным числом атомов углерода при температурах выше 600оС преобладает распад, а реакции замещения имеют скорости одного порядка со скоростью распада только под давлением около 5 МПа.
В случае реакций алкильного радикала с молекулой олефина при температурах ≈ 700оС и атмосферном давлении распад идет быстрее, чем бимолекулярные реакции (примерно в 7 раз), а при давлении примерно 1 МПа и выше с большей скоростью идут бимолекулярные реакции. При повышении же температуры до 1000оС распад радикалов при атмосферном давлении становится в 1000 раз быстрее бимолекулярных реакций и при давлениях, обычно применяемых в промышленности, бимолекулярные реакции становятся несущественными.
Обычно при газофазных реакциях углеводородов отношение концентрации радикалов к концентрации молекул составляет примерно 10-5 и менее, поэтому реакции рекомбинации и диспропорционирования протекают со скоростью на порядок (и более) меньше, чем другие реакции радикалов.
Когда радикал может распадаться по разным связям, вероятность распада определяется в первую очередь соотношением тепловых эффектов возможных реакций. Например, для реакций распада гексильного радикала:

Тепловые эффекты этих реакций соответственно равны:
Q1 = − 126 кДж/моль; Q2 = − 138 кДж/моль; Q3 = − 188 кДж/моль;
Эти реакции обратны реакциям присоединения по кратным связям и энергии активации также связаны с тепловыми эффектами согласно правилу Поляни-Семенова.
Тогда энергии активации по правилу Поляни-Семенова равны:
Е1 = 142,7 кДж/моль; Е2 = 150,8 кДж/моль; Е3 = 188,1 кДж/моль,
и соотношение
скоростей образования радикалов при
температуре 1000оС
составит примерно 1 : 0,4 : 0,004. Следовательно,
наиболее вероятным, энергетически
выгодным и будет протекать с наибольшей
скоростью распад, при котором образуется
больший радикал (![]() .
.