
- •Содержание
- •1. Тепловые эффекты
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •2. Тепловые свойства. Зависимость теплового
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •3. Энергия Гиббса – критерий термодинамической
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •4. Константа равновесия
- •Примеры решения задач
- •Задачи и упражнения
- •5. Основы химической кинетики и катализа
- •Задачи и упражнения для самостоятельной работы
- •6. Прочность связей в молекулах углеводородов
- •Задачи и упражнения для самостоятельной работы
- •7. Реакции радикалов при термическом
- •Задачи и упражнения для самостоятельной работы
- •8. Химизм и механизм термических превращений
- •Задачи и упражнения для самостоятельной работы
- •9. Соотношение скоростей реакций радикалов
- •Задачи и упражнения для самостоятельной работы
- •10. Процессы переработки нефтяного сырья, протекающие
- •Задачи и упражнения для самостоятельной работы
3. Энергия Гиббса – критерий термодинамической
осуществимости химической реакции
Условием принципиальной осуществимости химического процесса, т.е. возможности протекания его в прямом направлении, является неравенство ∆G < О, где: ∆G - изобарно-изотермический потенциал, или иначе свободная энергия Гиббса.
Энергия Гиббса вещества связана с его энтальпией и энтропией уравнением:
G = Н – TS (3.1)
Изменение стандартной энергии Гиббса при химической реакции может быть определено по уравнению:
∆GТ = ∆НТ - T∆SТ, (3.2)
где: ∆НТ и ∆SТ - разности соответственно стандартных энтальпий и энтропии образования из элементов продуктов реакции и реагентов.
Для реакции, протекающей при T=const и P=const, величина ∆Н равна ее тепловому эффекту. Пусть протекает химическая реакция:
аА + bВ + ... ↔ сС + dD + ... (3.3)
Если известны свободные энергии образования веществ, участвующих в химической реакции, величина ∆G может быть рассчитана, как сумма свободных энергий образования продуктов реакции за вычетом суммы свободных энергий образования исходных веществ.
∆G = [c(∆Скон.)С + d(∆Скон.)D + …] - [а(∆Снач.)А + b(∆Снач.)В + …], (3.4)
где: ∆G - стандартные значения энергии Гиббса образования вещества из элементов.
Таким же образом могут быть рассчитаны ∆Н и ∆S.
Значения стандартных и свободных энергий образования приводятся в справочной литературе /1,2/ или см.приложение (табл.1, 2).
Величина ∆G изменяется с температурой, поэтому в таблицах иногда приводятся значения свободных энергий образования для различных температур. В общем виде можно принять, что зависимость ∆G от температуры имеет вид:
∆GT = А + ВТ, (3.5)
где: А и В - коэффициенты, постоянные для каждой конкретной реакции.
Е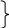 сли
известны величины ∆G
для двух любых температур, эти коэффициенты
могут быть легко вычислены путем решения
системы уравнений:
сли
известны величины ∆G
для двух любых температур, эти коэффициенты
могут быть легко вычислены путем решения
системы уравнений:
∆GT1 = А + ВТ1
∆GТ2 = А + ВТ2 (3.6)
Температура, при которой ∆G = 0, носит название "температурный предел термодинамической осуществимости" (Тпр) данной реакции. Экзотермические реакции становятся термодинамически осуществимыми при температурах, ниже температурного предела (Т < Тпр), а эндотермические – выше температурного предела (Т > Тпр).
Чем больше отрицательные значения -∆G, тем термодинамически более вероятна данная реакция в данных условиях.
Примеры решения задач
Задача 1. При температуре 527оС распад циклогексана возможен по трем направлениям:
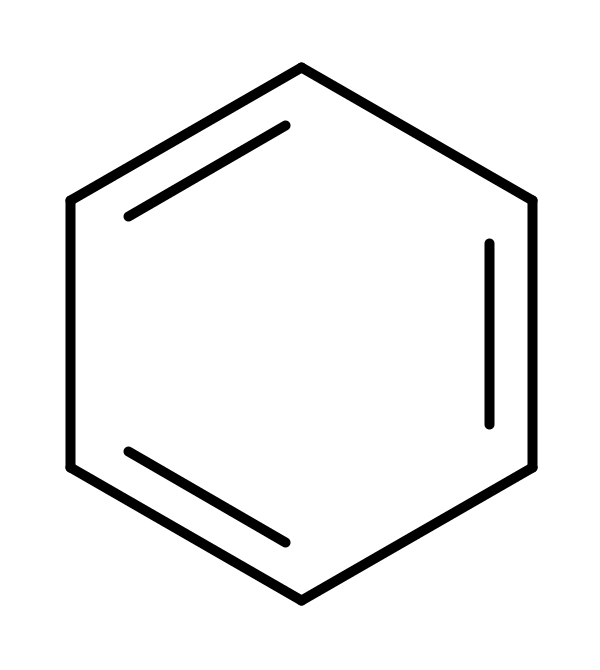



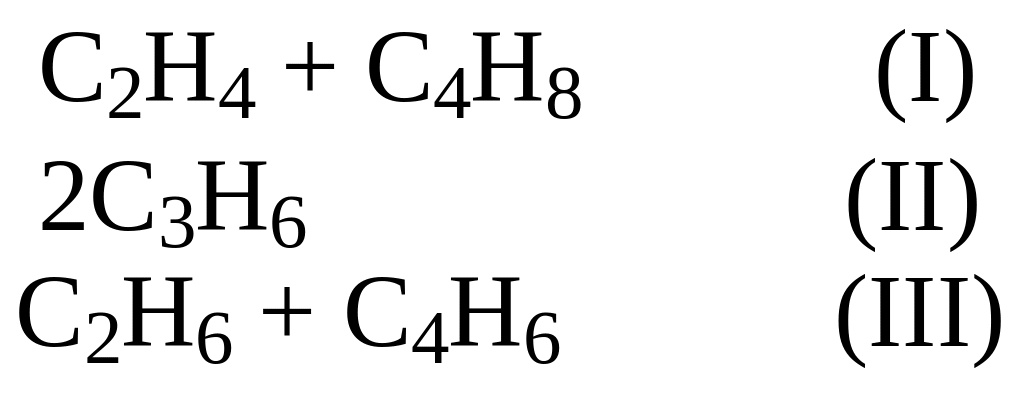
Какое из направлений распада наиболее термодинамически вероятно при этой температуре?
Решение:
Для ответа на этот вопрос необходимо рассчитать значения ∆G800 для каждой из реакций.
Из справочных таблиц (см.приложение, табл.2) находим значения свободных энергий образования веществ, участвующих в реакции:
Углеводород |
∆G800, кДж/моль |
С6Н12 С2Н4 С2Н6 С3Н6 С4Н6 (ДИВИНИЛ) С4Н8 (1-БУТЕН) |
+318,272 +102,613 +66,705 +145,854 +228,271 +207,195 |
Тогда:
∆G800(I) = 102,613 + 207,195 - 318,272 = - 8,464 кДж/моль
∆G800(II) = 145,854 + 145,854 - 318,272 = - 26,564 кДж/моль
∆G800(III) = 66,705 + 228,271- 318,272 = - 23,296 кДж/моль
На основании полученных результатов расчетов можно сделать вывод о том, что вторая реакция имеет большее отрицательное значение ∆G800, а, следовательно, ее протекание наиболее термодинамически вероятно при этой температуре по сравнению с реакциями (I) и (II).
Задача 2. Определить величину ∆G для реакции гидрирования этилена до этана С2Н4 + Н2 ↔ С2Н6 в стандартных условиях, используя 3-й закон термодинамики, если реакция протекает при T=const и P=const.
Решение:
Для решения задачи используем уравнение, которое выражает энтропийный и энтальпийный факторы процесса:
∆GТ = ∆НТ - T∆SТ.
Т.к. при T=const и P=const величина теплосодержания (энтальпии) равна ее тепловому эффекту, находим Q298=∆НТ через теплоты образования веществ, участвующих в реакции. Из справочных таблиц (см.приложение, табл.3, 4) находим значения теплоты образования и энтропии для реагентов.
Углеводород |
∆Но298, кДж/моль |
∆S298 Дж/моль∙оК |
Н2(г) С2Н4(г) С2Н6(г) |
- +52,359 -84,789 |
+130,77 +219,89 +229,82 |
Q298 = -84,789 - 52,359 – 0 = -137,148 кДж/моль
∆S298 = 229,82 - 219,89 - 130,77 = - 120,64 Дж/моль∙оК = 0,1206 кДж/моль∙оК
∆GТ = -137,148 – 298∙(-0,1206) = 101,2 кДж/моль
Задача 3. Найдите температурный предел термодинамической осуществимости реакции распада циклогексана на две молекулы пропилена С6Н12 → 2С3Н6.
Решение:
Чтобы найти температурный предел реакции, необходимо рассчитать ∆GТ при двух любых температурах. Например, при температурах 300 и 800оС. Следовательно, из справочных таблиц (см.приложение, табл.2) находим значения свободных энергий образования веществ, участвующих в реакции:
Углеводород |
∆G300, кДж/моль |
∆G800, кДж/моль |
С3Н6 С6Н12 |
+63,064 +32,724 |
+145,854 +318,272 |
Тогда: ∆G300 = 93,404 кДж/моль, а ∆G800 = -26,564 кДж/моль.
С оставляем систему из двух уравнений, исходя из зависимости величины энергии Гиббса от температуры - ∆GT = А + ВТ:
 ∆G300
= А + В∙300 А
= 165,4
∆G300
= А + В∙300 А
= 165,4
∆G800 = А + В∙800 В = -0,24
Имеем вид температурной зависимости: ∆GT = 165,4 – 0,24Т, и температурный предел будет равен Тпр. = 689оК.
