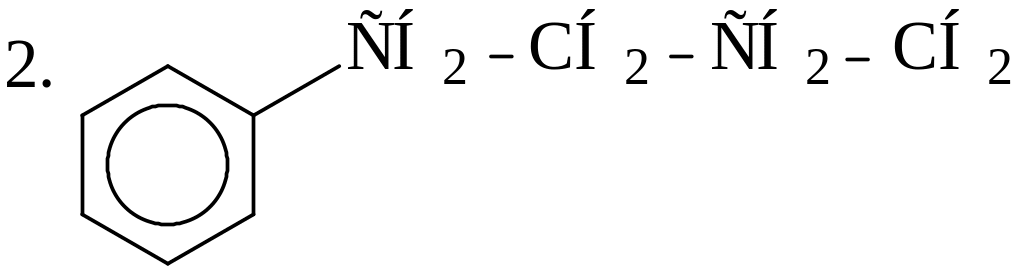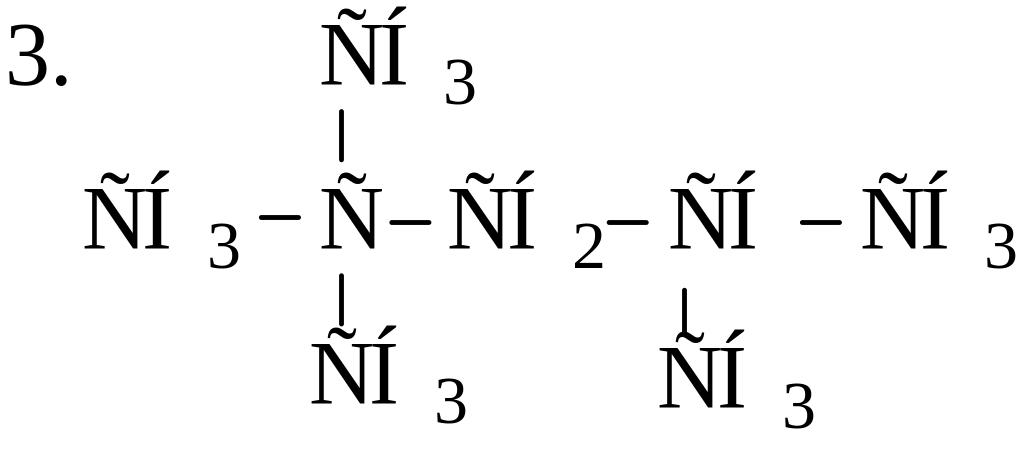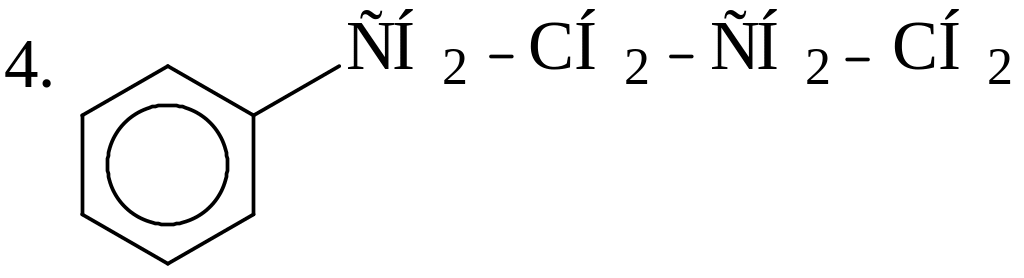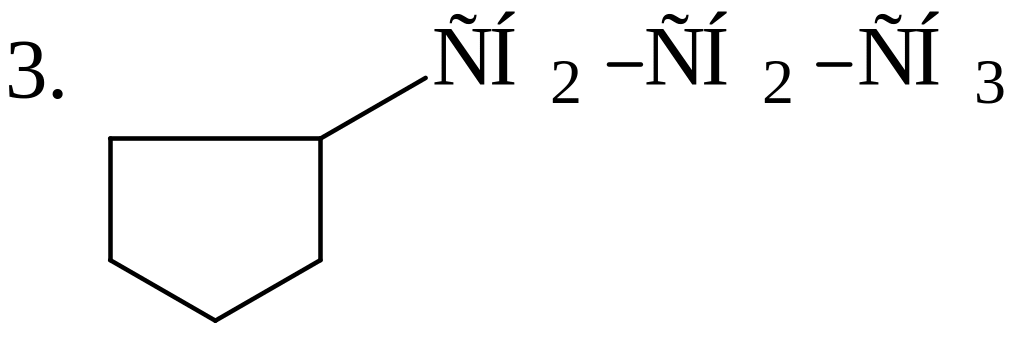- •Содержание
- •1. Тепловые эффекты
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •2. Тепловые свойства. Зависимость теплового
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •3. Энергия Гиббса – критерий термодинамической
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •4. Константа равновесия
- •Примеры решения задач
- •Задачи и упражнения
- •5. Основы химической кинетики и катализа
- •Задачи и упражнения для самостоятельной работы
- •6. Прочность связей в молекулах углеводородов
- •Задачи и упражнения для самостоятельной работы
- •7. Реакции радикалов при термическом
- •Задачи и упражнения для самостоятельной работы
- •8. Химизм и механизм термических превращений
- •Задачи и упражнения для самостоятельной работы
- •9. Соотношение скоростей реакций радикалов
- •Задачи и упражнения для самостоятельной работы
- •10. Процессы переработки нефтяного сырья, протекающие
- •Задачи и упражнения для самостоятельной работы
Задачи и упражнения для самостоятельной работы
№ п/п Задачи |
Условие задачи |
1. |
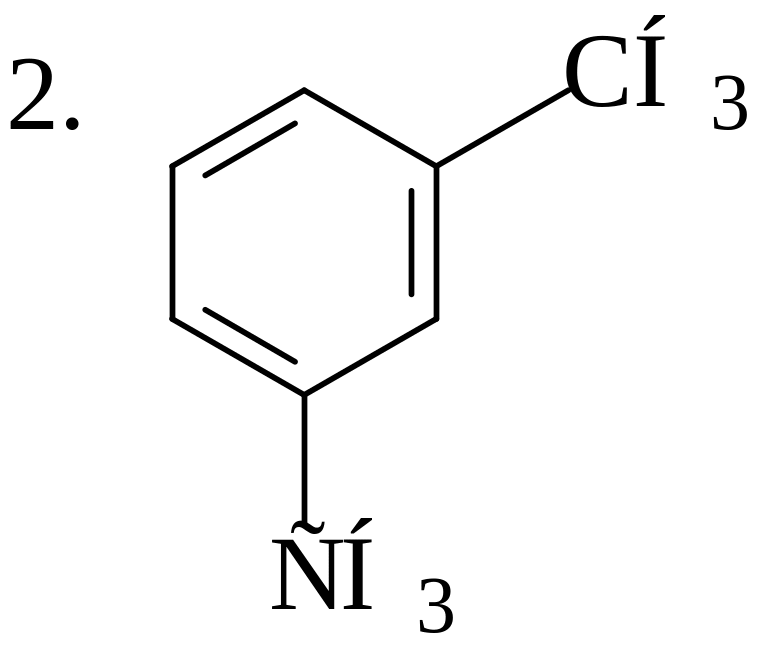
Укажите наиболее и наименее прочные связи С-С в молекулах следующих углеводородов:
3. СН3−СН=СН−СН2−СН2−СН3; 4. СН3−СН2−СН2−СН2−СН2−СН3 |
2. |
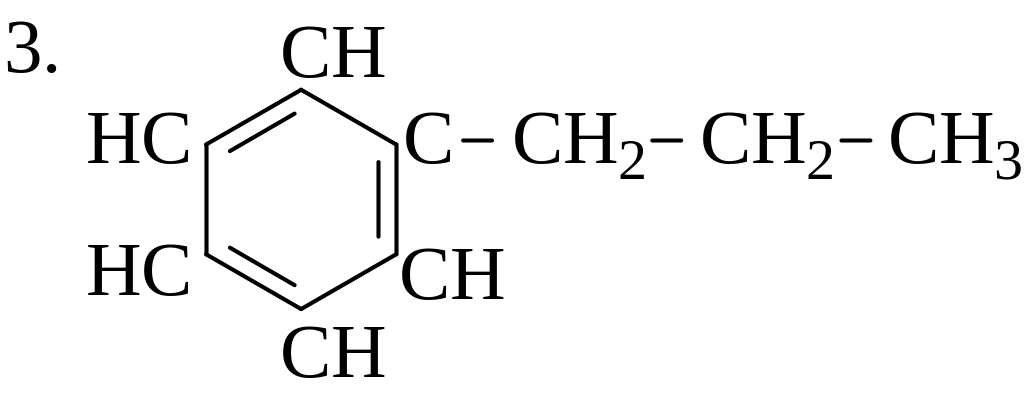
Расположите углеводороды в порядке возрастания их термической устойчивости: 1. СН3−СН2−СН2−СН2−СН2−СН3;
|
3. |
В каждой из молекул укажите наименее прочную связь С-Н: 1. СН3−СН2−СН2−СН2−СН3;
|
№ п/п Задачи |
Условие задачи |
4. |
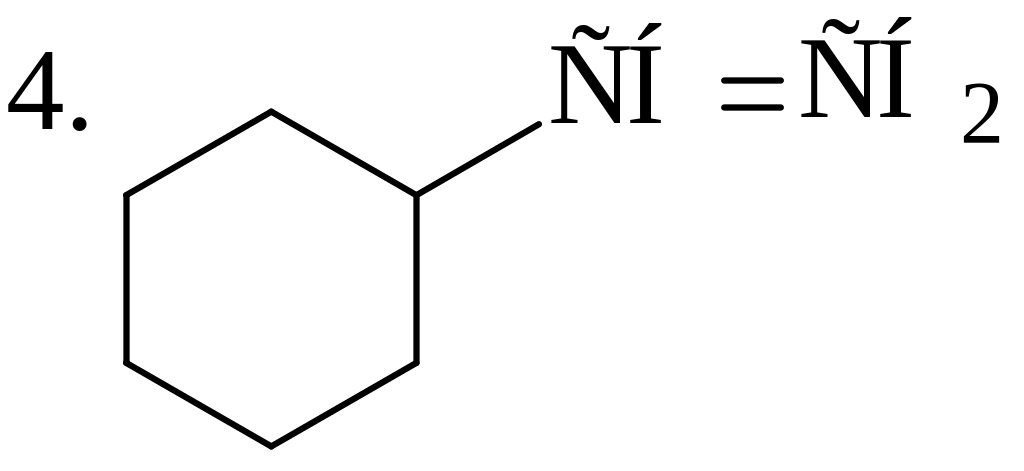
Расположите углеводороды в порядке снижения их термической устойчивости: 1. СН3−СН2−СН2−СН3; 2. СН3−СН2−СН2−СН2−СН2−СН2−СН2−СН3; 3. СН2=СН−СН2−СН3; 4. СН2=СН2; 5. СН3−СН=СН−СН3; 6. СН4; 7. СН2=СН−СН=СН2; 8. СН3−СН3 |
5. |
Расположите углеводороды в порядке возрастания их термической устойчивости: 1. СН≡СН; 2. СН≡С−СН2−СН3;
|
6. |
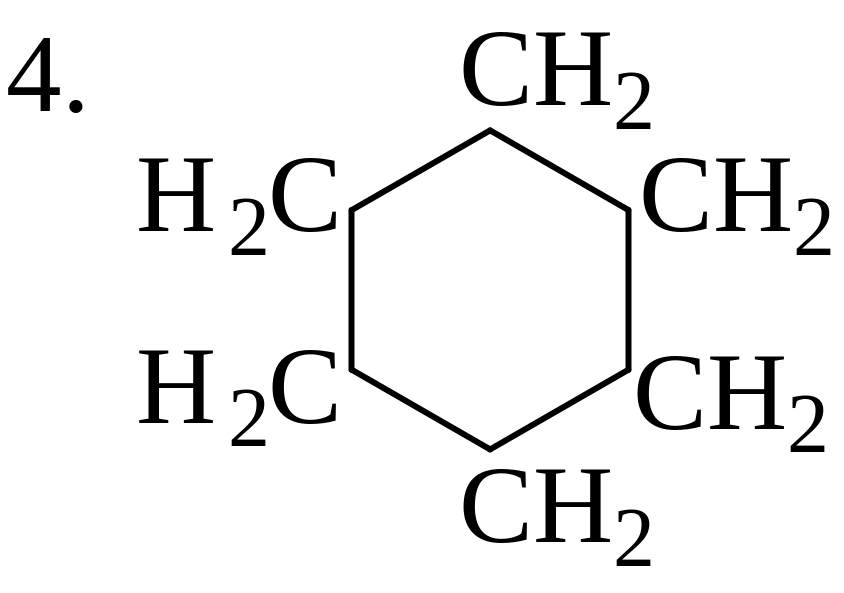
В каждой из молекул укажите наименее прочную связь С-С: 1. СН3−СН2−СН2−СН2−СН2−СН3; 2. СН2=СН−СН2−СН3;
5. СН2=СН−СН2−СН2−С≡СН |
7. Реакции радикалов при термическом
превращении углеводородов в газовой фазе
В нефти и нефтяных фракциях представлены практически все основные типы углеводородов в различных соотношениях. В остаточных нефтяных фракциях преобладают высокомолекулярные углеводородные и гетероорганические соединения. Следовательно, в первую очередь термическому распаду будут подвергаться высокомолекулярные углеводороды и их производные, в структуре которых имеются алифатические связи С-С. При этом реакции распада будут более вероятными, чем реакции дегидрирования. Чем больше межатомные расстояния и не симметричнее структура, тем меньше прочность молекулы и тем вероятнее ее распад по месту наиболее слабой связи, т.е. тем она реакционноспособнее.
Термическое превращение углеводородов происходит по радикально-цепному механизму. Большое значение в создании основ современной кинетики гомогенных газовых реакций имеет разработанная академиком Н.Н.Семеновым общая теория цепных реакций.
Радикально-цепной процесс термического разложения, как любой цепной процесс, складывается из четырех стадий: зарождение (инициирование) цепи; передача цепи; продолжение цепи; обрыв цепи.
Зарождение цепи – это распад исходной молекулы с образованием радикалов;
Реакция передачи цепи – это неповторяющаяся реакция первоначально образовавшегося радикала с исходной молекулой, в результате которой образуется новый радикал;
Реакция продолжения цепи – это повторяющаяся реакция превращения одних радикалов в другие, при которых расходуется исходное вещество;
Реакции обрыва цепи – это реакции, в результате которых происходит гибель радикалов путем превращения их в стабильные молекулы или образование малоактивных радикалов, не способных к реакциям продолжения цепи. Если скорость реакций обрыва цепей больше скорости их продолжения, то цепь не развивается и реакция идет по радикально-нецепному механизму.
Начало образования цепи, образование радикалов осуществляется преимущественно за счет разрыва связи С – С. Разрыв связи С – Н происходит несущественно, т.к. для этого требуется значительно больше энергии.
Реакции радикалов
Радикалы обладают высокой реакционной способностью и вступают в различные реакции с очень большой скоростью. Различают следующие реакции радикалов.
1. Моно- и бимолекулярная диссоциация молекул углеводородов.
На стадии инициирования цепи первоначально происходит моно- и бимолекулярная диссоциация молекул углеводородов исходного нефтяного сырья на два свободных радикала. В общем виде реакции описываются уравнениями:
![]() (7.1)
(7.1)
![]() (7.2)
(7.2)
Например:
![]()
2. Реакции замещения радикалов.
На стадии передачи
цепи протекают реакции замещения,
которые представляют собой по существу
обмен атомом водорода между первоначально
образовавшимся в результате моно- и
бимолекулярной диссоциации молекул
углеводородов исходного нефтяного
сырья радикалом (например:
![]() − присоединяют атом водорода) и исходной
молекулой углеводорода (отдают атом
водорода). В общем виде реакция замещения
описывается уравнением:
− присоединяют атом водорода) и исходной
молекулой углеводорода (отдают атом
водорода). В общем виде реакция замещения
описывается уравнением:
![]() (7.3)
(7.3)
Например:
![]()
![]()
3. Реакции распада радикалов.
На стадии продолжения цепи мономолекулярные реакции распада радикалов могут быть двух типов с образованием:
● Нового монорадикала и молекулы с двойной связью (7.4).
В общем виде эта реакция распада радикалов описывается уравнениями:
![]() ,
(7.4)
,
(7.4)
где:
![]() - олефиновый углеводород (с двойной
связью).
- олефиновый углеводород (с двойной
связью).
Радикалы могут распадаться по связи, находящейся в β-положении относительно углеродного атома, несущего неспаренный электрон с образованием π-связи, например:
![]()
![]()
![]()
![]()
![]()
Это направление распада радикалов является наиболее вероятным, которое требует наименьшей энергии активации.
● Бирадикала (7.5).
![]() ,
(7.5)
,
(7.5)
где:
![]() - бирадикал.
- бирадикал.
Из двух типов реакций энергетически более выгоден распад с образованием монорадикала. Бирадикалы при дальнейшем распаде образуют только молекулы с двойной связью (олефины) и далее не участвуют в цепных реакциях термических превращений углеводородов, например:
![]()
Распад радикалов с образованием водородного радикала (протона водорода) энергетически менее выгоден, чем образование алкильного радикала. Причем при распаде радикала на олефин и алкильный радикал энергетически выгодным становится распад с образованием большего радикала.
При распаде алкеновых радикалов энергетически значительно выгоднее образование алкадиенов и водородного радикала:
![]() ,
,
(аллен)
чем образование бирадикала:
![]()
4. Реакции присоединения радикалов.
Радикалы способны присоединяться к ненасыщенным углеводородам с образованием новых радикалов большей молекулярной массы.
Реакции присоединения протекают при взаимодействии радикала по кратной связи с молекулой углеводорода (олефин, диолефин), имеющей двойную - π-связь.
В общем виде реакция присоединения описывается уравнением:
![]() (7.6)
(7.6)
Например:
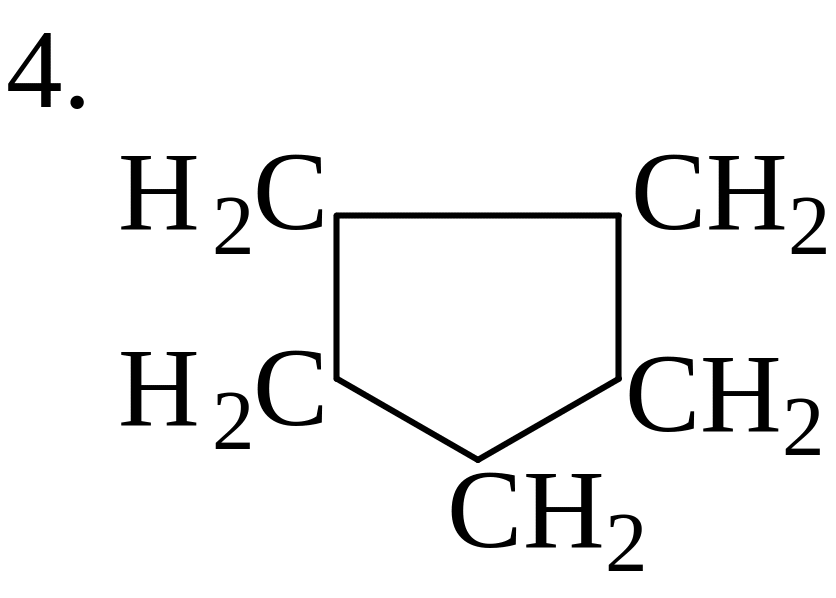
![]()
Эти реакции являются обратными реакциям распада радикалов.
5. Реакции изомеризации радикалов.
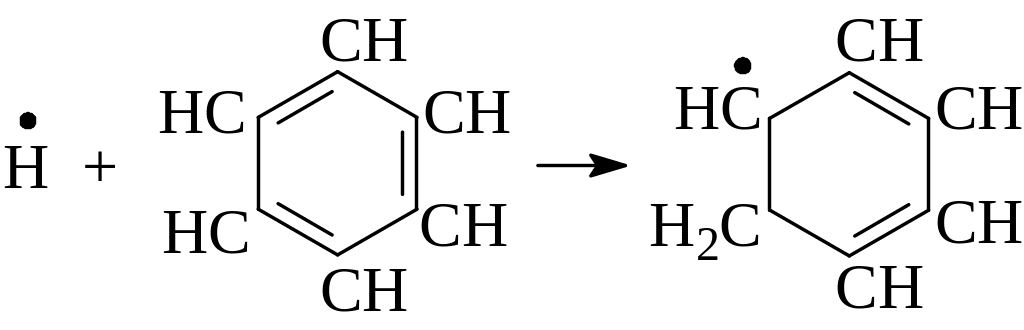
Реакции изомеризации мало характерны для радикалов. Предполагают, что изомеризация проходит через циклическое переходное состояние, т.е. через образование активированного комплекса. Существуют реакции структурной и скелетной изомеризации радикалов, например:
1
 .
.
![]()
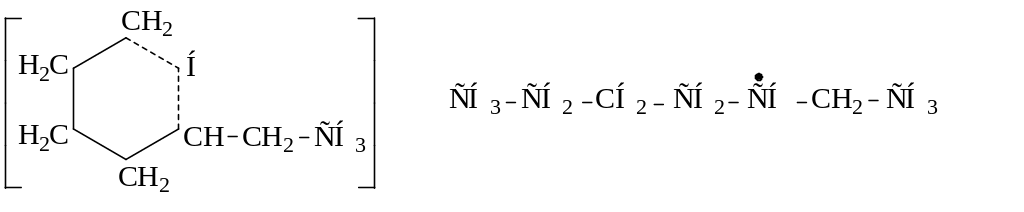
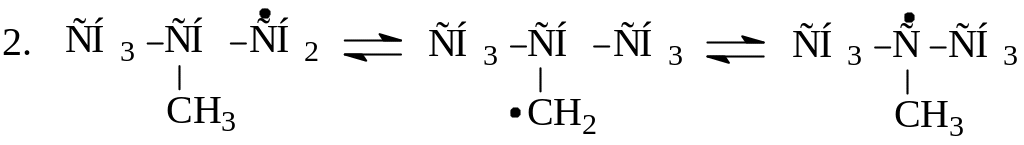
Поскольку наименее напряженными являются 5-ти, 6-ти и 7-членные циклы, для неразветвленных алкильных радикалов осуществим переход свободной валентности от n-го к n+3, n+4 и n+5 атому углерода, так как при этом в активированном комплексе образуется шестичленный цикл, характеризующийся минимальным напряжением.
6. Реакции рекомбинации.
Реакция рекомбинации – это реакция объединения двух радикалов в стабильную молекулу, и она является обратной реакции мономолекулярного распада молекулы на радикалы. В общем виде реакция рекомбинации описывается уравнением:
![]() (7.7)
(7.7)
Например:
![]()
![]()
![]()
7. Реакции диспропорционирования.
Реакция диспропорционирования – это реакция, обратная реакции бимолекулярного распада углеводородов с образованием свободных радикалов. При этом один из радикалов теряет атом водорода, превращаясь в алкен, а другой присоединяет этот атом водорода, превращаясь в алкан. В общем виде реакция диспропорционирования описывается уравнением:
![]() ,
(7.8)
,
(7.8)
где: R – алкан;
R' – алкен.
Например:
![]()
![]()
![]()
Энергии активации этих реакций равны нулю, а гибель радикалов (превращение их в молекулы углеводородов) происходит при каждом или одном из пяти – десяти их столкновений.
Для рекомбинации атомов водорода образование молекулы возможно лишь в том случае, если часть выделившейся энергии отводится третьей частицей, т.е. рекомбинация может произойти только при тройном соударении двух атомов водорода с какой-либо молекулой, а это мало вероятно.
Радикалы
![]() по реакционной способности превосходят
радикал
по реакционной способности превосходят
радикал
![]() и быстро вступают в реакции на стадии
продолжения цепи.
и быстро вступают в реакции на стадии
продолжения цепи.
В термических процессах свободные радикалы, являясь промежуточными частицами, содержат на один атом водорода меньше, чем соответствующие парафины, и на один атом водорода больше, чем олефины. Следовательно, промежуточная структура углеводорода всегда содержит нечетное число атомов водорода.
Реакции термического распада молекул обычно описываются уравнениями первого порядка. Однако четкое математическое описание всего комплекса термических реакций пока не представляется возможным, т.к. даже термический распад индивидуального углеводорода включает множество элементарных актов. При этом, чем больше межатомные расстояния и несимметричнее структура, тем меньше прочность молекулы и тем вероятнее ее распад по месту наиболее слабой связи, т.е. тем она реакционноспособнее. Кроме того, на кинетику цепной реакции термического превращения углеводородов оказывают влияние продукты реакции и промежуточные структуры, а также их количество.