
- •Содержание
- •1. Тепловые эффекты
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •2. Тепловые свойства. Зависимость теплового
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •3. Энергия Гиббса – критерий термодинамической
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •4. Константа равновесия
- •Примеры решения задач
- •Задачи и упражнения
- •5. Основы химической кинетики и катализа
- •Задачи и упражнения для самостоятельной работы
- •6. Прочность связей в молекулах углеводородов
- •Задачи и упражнения для самостоятельной работы
- •7. Реакции радикалов при термическом
- •Задачи и упражнения для самостоятельной работы
- •8. Химизм и механизм термических превращений
- •Задачи и упражнения для самостоятельной работы
- •9. Соотношение скоростей реакций радикалов
- •Задачи и упражнения для самостоятельной работы
- •10. Процессы переработки нефтяного сырья, протекающие
- •Задачи и упражнения для самостоятельной работы
2. Тепловые свойства. Зависимость теплового
эффекта реакции от температуры
Тепловые свойства
К тепловым свойствам относятся:
теплоемкость;
теплота парообразования;
теплота испарения и конденсации;
энтальпия (теплосодержание);
теплота плавления и сублимации (сумма теплот плавления и испарения);
теплота сгорания;
теплопроводность и др.
Для определения тепловых свойств используют эмпирические формулы или графики.
Удельная теплоемкость (массовая) вещества - количество тепла, которое требуется для нагрева 1 кг вещества на 1°С. Ед. изм. в СИ - [кДж/кг∙оК]:
![]() (2.1)
(2.1)
Объемная
теплоемкость
-
![]() ,
,
![]() (2.2)
(2.2)
Средняя теплоемкость - тепло (q), затрачиваемое на нагрев 1 кг вещества от t1 до t2:
![]() (2.3)
(2.3)
Средняя
теплоемкость жидких нефтепродуктов,
выкипающих до температуры 200°С и имеющих
относительную плотность
![]() ,
определяется по формуле Крэга:
,
определяется по формуле Крэга:
![]() (2.4)
(2.4)
где: Т - температура нефтепродукта, °К;
или по уравнению Фортча и Уитмена:
![]() (2.5)
(2.5)
где: Тср - среднеарифметическая температура температурного интервала кипения нефтяной фракции, °К.
Истинная теплоемкость нефтепродукта в паровой фазе при постоянном давлении (Р=1 ат) можно подсчитать по уравнению Бальке:
![]() (2.6)
(2.6)
где: t- температура нефтепродукта, оC.
Теплоемкость газообразных предельных углеводородов Ср, кДж/(кмоль∙оК) в зависимости от числа N углеродных атомов в молекуле можно определить по формуле:
![]() (2.7)
(2.7)
Для определения теплоемкости ряда жидкостей, широко применяющихся в нефтехимической и нефтеперерабатывающей промышленностях, можно воспользоваться номограммой, приведенной на рис.2.1, и табл. 2.1. Зависимости теплоемкости жидких нефтяных фракций и нефтяных паров от плотности и температуры представлены на рис.2.2 и 2.3.
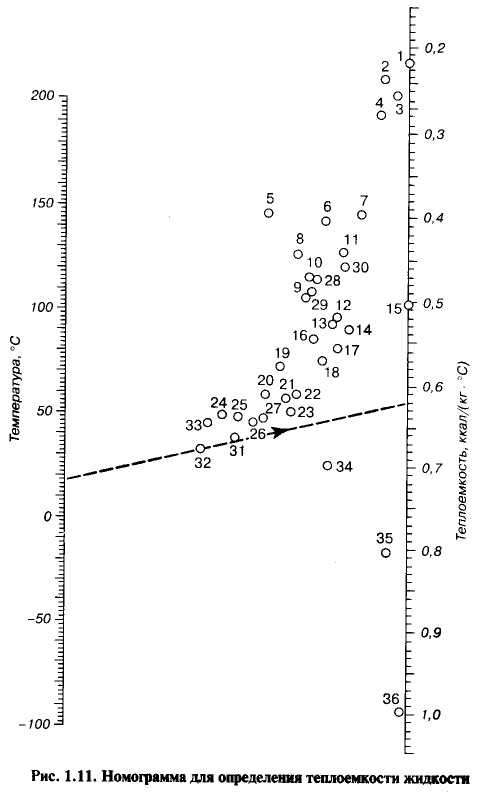

Рис.2.1. Номограмма для определения теплоемкости жидкости
Таблица 2.1 к рис.2.1.
Вещество |
Номер точки |
Вещество |
Номер точки |
Анилин |
14 |
п-Ксилол |
10 |
Ацетон |
18 |
о- и м-Ксилол |
9 |
Бензол |
29 |
Метиловый спирт |
23 |
Бутиловый спирт |
24 |
Октан |
15 |
Вода |
36 |
Толуол |
30 |
Гептан |
19 |
Хлорбензол |
6 |
Глицерин |
21 |
Хлороформ |
3 |
Дифенил |
8 |
Четыреххлористый углерод |
2 |
Диэтиловый эфир |
17 |
Этиленгликоль |
22 |
Изопентан |
20 |
Этиловый спирт |
31 |
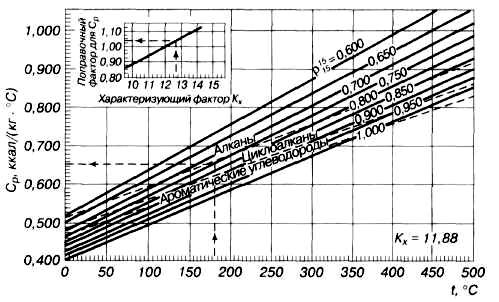
Рис.2.2. Зависимость теплоемкости жидких нефтяных
фракций от плотности и температуры
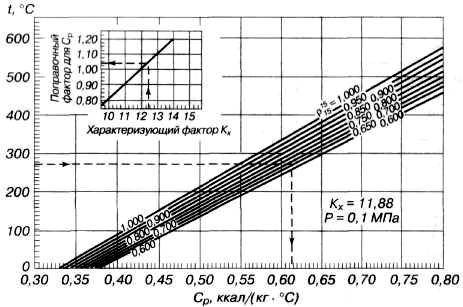
Рис.2.3. Взаимосвязь между теплоемкостью паров
нефтяных фракций, плотностью и температурой
Зависимость теплового эффекта реакций от температуры
Эта зависимость выражается с помощью уравнения Нернста:
![]() (2.8)
(2.8)
![]() (2.9)
(2.9)
![]() (2.10)
(2.10)
![]() (2.11)
(2.11)
где: Qо - условный тепловой эффект при нуле градусов 0К;
![]() - стехиометрические
коэффициенты при соответствующих членах
уравнения реакции.
- стехиометрические
коэффициенты при соответствующих членах
уравнения реакции.
Или же через стандартный тепловой эффект:
![]() (2.12)
(2.12)
где: Т – температура, оК.
Тепловой эффект также может быть вычислен через энтальпии веществ, участвующих в химической реакции:
![]() (2.13)
(2.13)
где: ∑Iнач. и ∑Iкон. – сумма энтальпий исходных веществ и продуктов реакции, соответственно, кДж/моль.
Зависимость теплоемкости от температуры может быть выражена следующими уравнениями:
с=а+bT (2.14)
c=a+bT+dT2 (2.15)
c=a+bT+d/Т2 (2.16)
∆с=снач.-скон. (2.17)
Теплота испарения (конденсации) – количество теплоты, поглощаемое жидкостью при переходе ее в насыщенный пар. Теплота испарения нефтепродуктов значительно меньше теплоты испарения воды, что имеет большое значение в технологии переработки нефти и газа. Теплота испарения при повышенном давлении меньше, а в вакууме больше, чем при атмосферном давлении, а при критических температуре и давлении она равна нулю.
Теплоту испарения
(конденсации) можно найти как разность
энтальпий пара
![]() и
и
![]() при одинаковых температуре и давлении.
при одинаковых температуре и давлении.
Для определения теплоты испарения нефтяных фракций Rисп. Используют формулы:
Rисп. = Тм(36,63 + 19,13lgТм), кДж/кг (2.18)
Rисп.
= 993,5 – 661,5![]() – Тм(1,733
– 1,813
)
– Тм2(0,00059
–
– Тм(1,733
– 1,813
)
– Тм2(0,00059
–
– 0,00015), кДж/кг (2.19)
Rисп. = 23,6 -7,1∙lg(1000Р/Тм), ккал/кг (2.20)
где: Тм – средняя молекулярная температура кипения нефтепродукта
при атмосферном давлении, оК;
Р – давление, кгс/см2.
С помощью рисунка 2.4 можно определить теплоту испарения нефтяных фракций в зависимости от молекулярной массы и характеризующего фактора фракции, а в таблице 2.2 приведены данные о теплоте испарения алканов.
Тм,
оК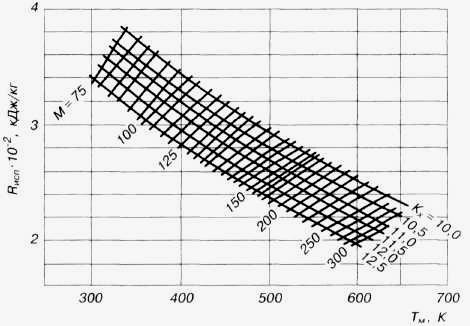
Рис.2.4. Зависимость теплоты испарения от средней
молекулярной температуры кипения, молекулярной
массы и характеризующего фактора
Энтальпия (теплосодержание) жидких нефтепродуктов – количество тепла (в Джоулях), необходимое для нагрева 1 кг вещества от ОоС до заданной температуры (энтальпию при ОоС условно принимают равной нулю). Энтальпия паров при заданной температуре – это количество тепла, необходимое для нагрева вещества от ОоС до заданной температуры с учетом тепла испарения при той же температуре и перегрева паров. Для определения энтальпии жидких нефтепродуктов и паров нефтепродуктов пользуются эмпирическими формулами, таблицами и графиками /4,5,6/.
Таблица 2.2
Теплота испарения алканов
Темпера- тура, оC |
Этан |
Пропан |
Изобутан |
Бутан |
Изопентан |
Пентан |
кДж/кг |
кДж/кг |
кДж/кг |
кДж/кг |
кДж/кг |
кДж/кг |
|
-50 -40 -30 -20 -10 0 10 20 30 40 50 60 70 80 90 100 |
424,5 404,9 384,3 362,2 335,8 303,6 264,6 206,0 104,3 0 - - - - - - |
435,0 424,1 412,8 400,7 388,1 375,1 360,9 345,8 328,7 309,0 286,0 258,3 226,1 187,1 129,8 0 |
396,5 389,8 381,0 372,6 364,2 355,5 345,8 335,8 325,9 313,2 300,6 286,0 270,0 252,0 231,1 206,8 |
424,1 416,6 409,1 401,5 393,6 385,6 376,8 376,6 357,1 346,7 334,9 321,5 306,9 291,8 275,1 256,7 |
394,0 388,1 381,8 376,0 369,7 362,6 355,9 348,3 340,8 332,0 322,0 312,8 303,5 293,5 283,9 272,1 |
414,9 409,9 404.0 397,3 391,0 384,8 377,6 370,1 362,6 355,0 347,1 338,3 332,9 318,2 306,9 296,0 |
Теплота плавления. Для расчета теплоты плавления Iпл. используется эмпирическая формула:
Iпл. = 4,95∙Тпл.∙100,00321М, кал/моль (2.21)
где: Тпл. – температура плавления, оК;
М – молекулярная масса.
Теплота сгорания (теплотворная способность). Различают высшую и низшую теплотворные способности.
Высшая теплотворная способность – количество теплоты, выделяемой при полном сгорании топлива, охлаждении продуктов сгорания до температуры топлива и конденсации водяного пара, образовавшегося при окислении водорода, входящего в состав топлива.
Низшая теплотворная способность – количество теплоты, выделяемое при полном сгорании топлива без конденсации водяного пара.
Для расчета высшей (Qв) и низшей (Qн) теплотворных способностей (теплот сгорания) используют формулы, предложенные Д.И.Менделеевым:
Qв = 339,1С + 1030Н – 108,9(О – S), кДж/кг (2.22)
Qв = 8100С + 30000Н + 2600(S – О), ккал/кг (2.23)
Qн = 339,1 + 1030Н – 108,9(О – S) – 16,75W, кДж/кг (2.24)
Qн = 8100С + 30000Н + 2600(S – О) – 600(9Н + W), ккал/кг (2.25)
где: С, Н, S, O, W – содержание в топливе углерода, водорода, серы, кислорода и влаги, соответственно, % масс.
Для нефтепродуктов используется также формула:
Qн = 46423 + 3169 - 8792( )2, кДж/кг (2.26)
Теплопроводность. Коэффициент теплопроводности газов λ, Вт/(м∙оК), при атмосферном давлении рассчитывают по эмпирической зависимости Эйкена:
λ = 102μ(Ср + 1,25R/М), (2.27)
где: μ – динамическая вязкость, Па∙с;
Ср – теплоемкость при постоянном давлении, кДж/(кг∙оК);
R – универсальная газовая постоянная, равная 8,314 кДж/(кмоль∙оК);
М – молекулярная масса.
Зная вязкость и теплоемкость газов, можно определить их теплопроводность по номограмме (рис.2.5)
Для расчета коэффициента теплопроводности жидких углеводородов плотностью от 0,78 до 0,95 в интервале от 0 до 200оС используется формула Крэга:
λ = (0,1175/ )∙(1,1472 – 0,00054Т), (2.28)
где: Т – температура,оК.
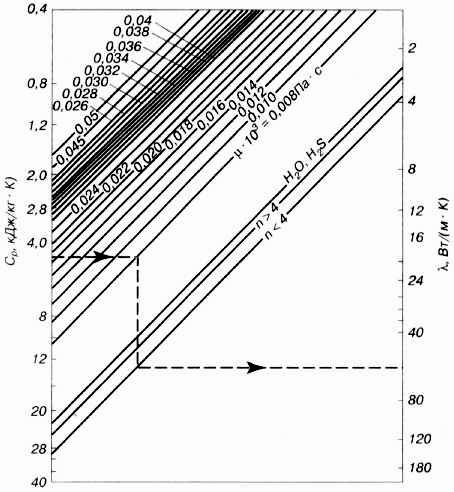

Рис.2.5. Номограмма для определения коэффициента
теплопроводности газов и паров (n – число атомов)
Коэффициент теплопроводности жидких нефтяных фракций в зависимости от температуры может быть найден по графику (рис.2.6):


t, оС
Рис.2.6. Зависимость теплопроводности жидких
нефтяных фракций от температуры и плотности
