
- •Содержание
- •1. Тепловые эффекты
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •2. Тепловые свойства. Зависимость теплового
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •3. Энергия Гиббса – критерий термодинамической
- •Примеры решения задач
- •Задачи и упражнения для самостоятельной работы
- •4. Константа равновесия
- •Примеры решения задач
- •Задачи и упражнения
- •5. Основы химической кинетики и катализа
- •Задачи и упражнения для самостоятельной работы
- •6. Прочность связей в молекулах углеводородов
- •Задачи и упражнения для самостоятельной работы
- •7. Реакции радикалов при термическом
- •Задачи и упражнения для самостоятельной работы
- •8. Химизм и механизм термических превращений
- •Задачи и упражнения для самостоятельной работы
- •9. Соотношение скоростей реакций радикалов
- •Задачи и упражнения для самостоятельной работы
- •10. Процессы переработки нефтяного сырья, протекающие
- •Задачи и упражнения для самостоятельной работы
4. Константа равновесия
химической реакции
Наряду с химическим взаимодействием между исходными веществами (прямой реакции) происходит химическое взаимодействие и между продуктами реакции, т.е. (обратная реакция).
По мере протекания процесса скорость прямой реакции уменьшается, в то время как скорость обратной реакции увеличивается. При равенстве этих скоростей наступает химическое равновесие.
Таким образом, химическим равновесием называется такое состояние обратимого процесса:
аА + bВ … ↔ dD + еЕ ... (4.1)
при котором скорость прямой реакции
аА + bВ … → dD + еЕ ... (4.2)
равна скорости обратной реакции
dD + еЕ … ← аА + bВ … (4.3)
При химическом равновесии отношение произведения молярных концентраций веществ, получающихся при реакции, к произведению молярных концентраций исходных веществ есть постоянная величина для данного химического процесса при заданных условиях протекания реакции.
С момента наступления равновесия в реагирующей системе концентрации и парциальные давления веществ не изменяются. Поэтому для процессов, протекающих при постоянном давлении (P=const) и температуре (T=const), будут неизменными и отношения, если предположим протекает реакция (4.1):
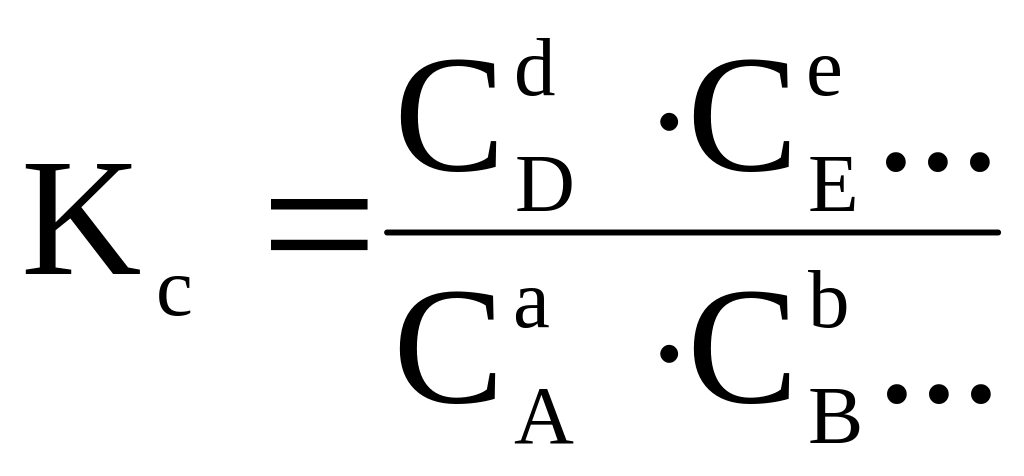 ,
(4.4)
,
(4.4)
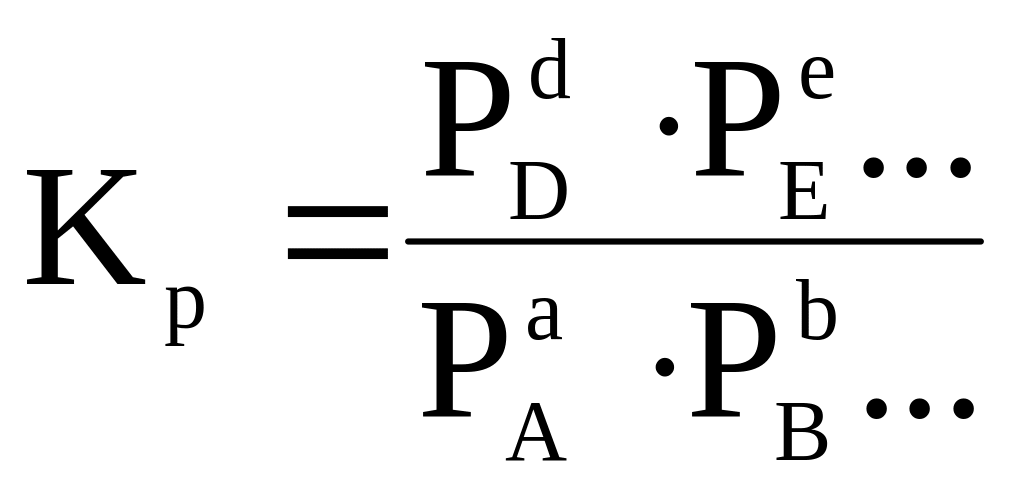 ,
(4.5)
,
(4.5)
где: Ci и Pi - соответственно равновесные концентрации и парциальные
давления веществ, участвующих в химической реакции.
КС и КР называются константами химического равновесия. Между КС и КР существует взаимосвязь, которая выражается следующим уравнением:
КС = КР∙[RT]-∆n, (4.6)
где: R – универсальная газовая постоянная, равная 8,314 Дж/(моль∙оК);
Т – температура, оК;
∆n – разность числа молей газообразных веществ:
∆n = d + t – a – b (4.7)
В данном случае справедлив закон Дальтона:
Pi = Робщ.∙Ni, (4.8)
где: Ni – мольная доля, равная отношению числа молей i-компонента к сумме числа молей всех компонентов системы.
![]() (4.9)
(4.9)
При очень большом значении константы равновесия реакция может идти практически до конца, при очень малом - не протекает вообще.
Константа химического равновесия зависит от природы реагентов и от температуры, и в меньшей степени зависит от давления (если давления не высокие), от концентраций, наличия или отсутствия примесей.
Если парциальные давления начальных и конечных продуктов реакции в исходной смеси равны ≈ 1 ат, т.е. они находятся в стандартном состоянии, то изменение стандартной энергии Гиббса выражается зависимостью:
∆G = - RTlnKp, (4.10)
откуда:
![]()
![]() (4.11)
(4.11)
Из этого уравнения следует, что большим отрицательным значениям -∆G отвечает большее значение КР, т.е. преобладание в равновесной смеси продуктов взаимодействия. Наоборот, если ∆G >> О, то в равновесной смеси будут преобладать исходные вещества.
Cледовательно, в первом случае можно пренебречь наличием исходных веществ, во втором - наличием продуктов реакции. Если же ∆G.= 0, то константа равновесия будет равна К = 1.
Объединение двух уравнений (4.10 и 4.11):
∆G = ∆Н - T∆S и ∆G = - RTlnKp
с последующим преобразованием их дает уравнение;
![]() ,
(4.12)
,
(4.12)
которое отражает противоположное влияние на равновесие энтальпий-ного и энтропийного факторов. Это соотношение позволяет определить возможную глубину реакции, допускаемую термодинамикой.
Влияние температуры
на химическое равновесие
Влияние изменения условий на положение равновесия определяется по принципу Ле-Шателье или принципу подвижного равновесия:
- если на равновесную систему оказывают какое-либо воздействие, то равновесие смещается в направлении того процесса, протекание которого ослабляет данное воздействие.
В соответствии с принципом Ле-Шателье, нагревание вызывает смещение равновесия в сторону того процесса, протекание которого сопровождается поглощением тепла. Или другими словами: повышение температуры вызывает возрастание константы равновесия эндотермического процесса.
Естественно, что понижение температуры приводит к противоположному результату.
Равновесие смещается в сторону того процесса, протекание которого сопровождается выделением тепла, т.е. охлаждение благоприятствует экзотермическому процессу и вызывает рост константы его равновесия.
Таким образом, для эндотермического процесса нагревание смешает равновесие в сторону продуктов реакции.
Для экзотермического процесса нагревание привело бы к противоположному результату.
Направление смещения равновесия в результате изменения температуры определяется знаком теплового эффекта. Чем больше величина теплового эффекта (∆Н), тем значительнее влияние температуры на степень смещения равновесия. Наоборот, если ∆Н близко к нулю, то температура практически не влияет на равновесие.
а)
б)
G
G
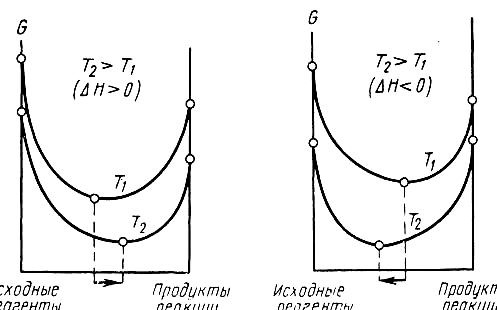



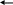
Исходные Продукты Исходные Продукты
реагенты реакции реагенты реакции
Рис.4.1 Влияние температуры на химическое равновесие:
а) – эндотермическая реакция; б) – экзотермическая реакция
С помощью уравнения (4.12):
можно количественно определить влияние температуры на равновесие.
Для реакций, идущих с изменением мольности, на состояние равновесия оказывает влияние не только температура, но и давление.
Влияние давления на константу
химического равновесия
Когда, законы идеальных газов не применимы (↑Р и ↓Т), в равновесии для такой реакции соблюдается соотношение:
 ,
(4.13)
,
(4.13)
где; fi - летучесть исходных веществ и продуктов реакции;
Kf - величина, зависящая только.от температуры.
Отношение летучести газа к его давлению называется коэффициентом активности:
γ = f/P (4.14)
Коэффициент активности является функцией приведенных температур и давления:
![]() ,
(4.15)
,
(4.15)
Так как f = Р∙γ, то Kf = Кр∙Кγ, отсюда следует:
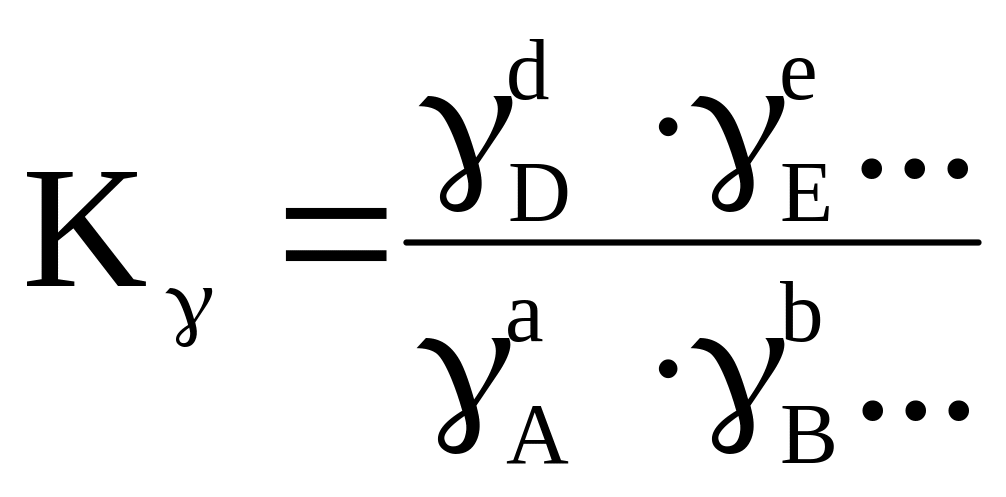 ,
(4.16)
,
(4.16)
Для вычисления константы равновесия при высоком давлении определяют величину ∆G, по которой находят Kf при данной температуре. Затем вычисляют значения коэффициента активности γ и величину Kf, и из уравнения Кр = Kf/Kγ определяют константу равновесия КР при давлении Р.
Исследованиями установлено, что для процессов, осуществляемых при высоких давлениях, константа равновесия уменьшается с ↑Р.
При низких давлениях летучесть можно приравнять к давлению, т.е. летучесть характеризует отклонение газа от идеального состояния.
а)
б)
G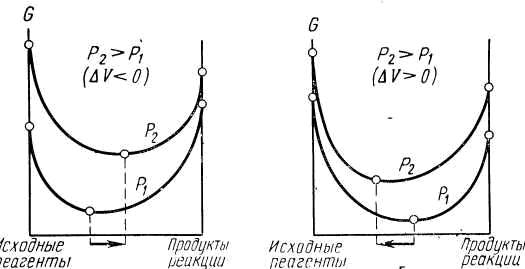



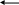
G
Исходные Продукты Исходные Продукты
реагенты реакции реагенты реакции
Рис.4.1 Влияние давления на химическое равновесие:
а) – эндотермическая реакция; б) – экзотермическая реакция
Исходя из принципа Ле-Шателье следует, что повышение давления способствует реакциям синтеза, которые сопровождаются уменьшением объема. Наоборот, для реакций распада, идущих с увеличением объема, благоприятны низкие давления.
Для реакций, протекающих без изменения объема, таких, как изомеризация или замещение, давление не оказывает влияния на их равновесие.
Влияние концентрации
на химическое равновесие
В соответствии с принципом Ле-Шателье введение в равновесную систему дополнительных количеств какого-либо реагента (имеется ввиду исходное вещество или продукты реакции) вызывает сдвиг равновесия в том направлении, при котором концентрация этого вещества уменьшается.
Поэтому избыток исходного вещества вызывает смещение равновесия вправо, увеличивая степень превращения других реагентов, и наоборот, добавление продукта реакции вызывает смещение равновесия влево, т.е. уменьшение степени полноты ее протекания.
Если направление смещения равновесия в химическом процессе определяется избытком какого-либо из реагентов (исходного вещества или продуктов реакции), то степень смещения равновесия при данном количестве реагента определяется величиной стехиометрических коэффициентов.
Например. Рассмотрим реакцию, протекающую в водном растворе (качественная реакция на ионы Fe+3, которая используется при определении FeS в нефтях и нефтепродуктах):
FeCl3 + 3KSCN ↔ Fe(SCN)3 + 3KCl (4.17)
Константа, равновесия этой реакции будет равна:
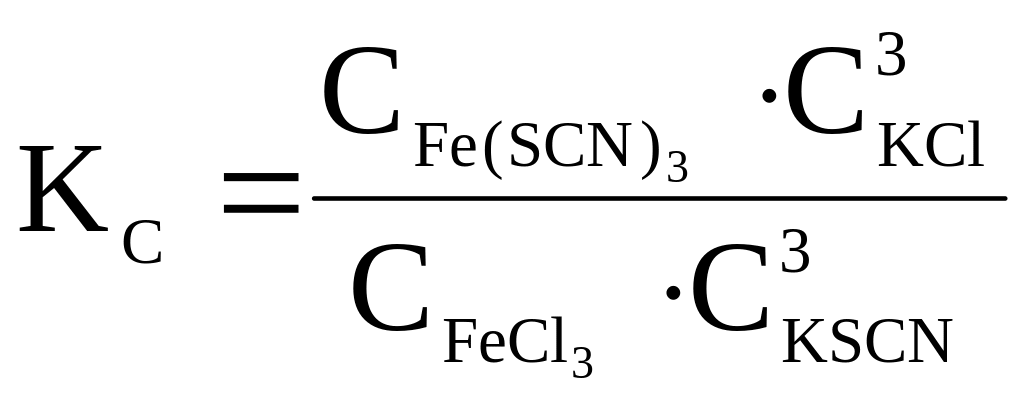 (4.18)
(4.18)
Вид этого выражения показывает не только направление, но и степень смещения равновесия. Изменение концентрации KSСN или КС1 вызовет более значительный сдвиг положения равновесия, чем изменение концентрации FeCl3 или Fe(SCN)3, т.к. стехиометрические коэффициенты в уравнении реакции для KSCN и КС1 втрое больше, чем для FeCl3 и Fe(SСN)3.
Во многих случаях смещение равновесия вправо можно осуществить и удалением продуктов процесса из реакционной зоны, связывая их в малодиссоциирующие, труднорастворимые или нелетучие вещества.
Влияние теплового эффекта
на химическое равновесие
Чем больше величина Q, тем значительнее влияние температуры на степень смещения равновесия. Наоборот, если Q близко к нулю, то температура практически не влияет на равновесие.
Оптимальные условия осуществления
технологического процесса
Выбор наилучшего режима любого процесса зависит от влияния температуры, давления, соотношения между реагентами.
Так, если реакция является эндотермической и протекает с уменьшением объема, то для получения максимального выхода продукта реакции необходимо сочетание высоких температур и высоких давлений.
Говоря об оптимальном соотношении между реагентами, необходимо обратить внимание на следующее:
- если расход одного из реагентов лимитирован, то увеличение концентрации сореагентов позволит увеличить степень его использования;
- степень превращения лимитированного реагента будет тем больше, чем больше будет введено другого реагента.
Степенью превращения вещества в химической реакции называется отношение числа молей вещества, вступившего в реакцию, к исходному числу молей этого вещества.
Так, если в реакции:
аА + bВ ↔ сС (4.19)
было взято (а) молей вещества А и образовалось (с) молей вещества С, то степень превращения (αА) вещества А выразится следующим образом:
![]() (4.20)
(4.20)
Различают теоретическую и практическую степени полноты реакции.
Теоретическая степень полноты реакции отвечает установлению в системе равновесия, т.е. соответствует максимально возможной степени превращения, которую легко определить на основании выражения для константы равновесия данного процесса. Однако, далеко не всегда реакция доходит до равновесия, и в этом случае используют катализаторы.
