
- •Основные стехиометрические законы.
- •Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
- •Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского Энергетические ячейки. Правило Хунда.
- •Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Образование химической связи. Энергия и длина связи.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •Направленность ковалентной связи. Π – связи. Гибридизация атомных орбиталей.
- •Ионная (электронная) связь.
- •Представление о методе электронных орбиталей.
- •Полярность связи. Полярность молекул и дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Система. Фаза. Компонент. Параметры. Функция состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •Стандартная энтальпия образования. Следствие из закона Гесса.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •Постулат Планка. Стандартная энтропия веществ.
- •Объединенная формула первого и второго начал термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •Условия самопроизвольного протекания химических реакций.
- •Изотерма химической реакции. Стандартное изменение свободной энергии.
- •Константа химического равновесия. Различные способы выражения констант равновесия . Соотношения между константами.
- •Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •Принцип Ле-Шателье.
- •Скорость химической реакции. Закон действующих масс. Константа скорости.
- •Молекулярность и порядок реакции.
- •Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Энергия активации химической реакции. Аналитический и графический метод расчета.
- •Скорость гетерогенной химической реакции. Особенности ее протекания.
- •Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
- •Дисперсные системы. Коллоидные растворы.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Закон Рауля. Криоскопия и эбуллиоскопия.
- •Электролитическая диссоциация. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Произведение растворимости. Условие выпадения осадка.
- •Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений. Расчет эдс гальванического элемента.
- •Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролизе. Перенапряжение.
- •Классификация химических источников тока.
- •Коррозия металлов. Химическая и электрохимическая коррозия.
- •Основные методы борьбы с коррозией.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды). ???? диаграмма
- •Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Поверхностные явления. Понятие поверхностного натяжения.
- •Адсорбция и абсорбция. Изотермы адсорбции.
Скорость химической реакции. Закон действующих масс. Константа скорости.
Скорость гомогенной (однофазной)
реакции зависит от природы реагирующих
веществ, их концентрации и температуры.Скорость
гетерогенных (многофазных) процессов
зависят от размеров и состояния
поверхности раздела фаз.Примечание.
Гетерогенные – процессы, происходящие
на поверхности раздела соприкасающихся
фаз. (горение топлива, окисление металлом
кислородом воздуха).Закон действующих
масс.Справедлив для гомогенных
реакций.Формулировка: при постоянной
температуре скорость химической реакции
пропорциональна произведению концентраций
реагирующих веществ.Константа скорости
обозначается как
![]() Пример.
Пример.
![]()
![]() в
квадратных скобках концентрации
веществ.
в
квадратных скобках концентрации
веществ.![]()
![]()
![]() «к»
не зависит от концентрации в каждый
момент времени.
«к»
не зависит от концентрации в каждый
момент времени.
Молекулярность и порядок реакции.
Реакции с точки зрения частиц
классифицируются по признаку молекулярности
или по признаку порядка
последних.Молекулярность определяется
по числу молекул, одновременное соударение
которых приводит к химическому
воздействию.Одномолекулярная реакция.
![]()
![]() с – концентрация исходного вещества.
Двухмолекулярная реакция.
с – концентрация исходного вещества.
Двухмолекулярная реакция.
![]()
![]()
Трехмолекулярная реакция.
![]()
![]()
Порядок реакции =сумме показателей
степеней у концентраций в уравнении,
выражающем зависимость скорости реакции
от концентраций реагирующих веществ.Реакция
![]() формально 3хмолекулярна, но фактически
яв-ся 2хмолекулярной, так как реакция
протекает в 2 стадии:
формально 3хмолекулярна, но фактически
яв-ся 2хмолекулярной, так как реакция
протекает в 2 стадии:![]()
![]()
Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
По степени сложности реакции подразделяются
на изолированные, параллельные,
сопряженные, последовательные
(многоступенчатые), обратимые и
необратимые.Изолированные – при
их протекании образуются продукты
только одного типа.Параллельные –
в ходе них взятые вещества одновременно
реагируют в двух или более направлениях
(образуются разные продукты).Пример.
Разложение бертолетовой соли![]() Скорость
реакции:
Скорость
реакции:
![]() Сопряженные
– совместные реакции типа:
Сопряженные
– совместные реакции типа:
![]() Вторая
реакция протекает лишь совместно с
первой.А – актор реакции, B
– индуктор реакции, С –
акцептор.Последовательные.
Вторая
реакция протекает лишь совместно с
первой.А – актор реакции, B
– индуктор реакции, С –
акцептор.Последовательные.
![]() В
– промежуточный продукт.Обратимые и
необратимые. Подавляющее большинство
химических реакций являются обратимыми,
т.е. могут протекать в двух направлениях.
Скорость реакции:
В
– промежуточный продукт.Обратимые и
необратимые. Подавляющее большинство
химических реакций являются обратимыми,
т.е. могут протекать в двух направлениях.
Скорость реакции:
![]() Различают
практически необратимые и совершенно
необратимые реакции.Практически
необратимые – реакции, в результате
которых образуется осадок.Совершенно
необратимые – протекают только в одном
направлении. Пример.
Различают
практически необратимые и совершенно
необратимые реакции.Практически
необратимые – реакции, в результате
которых образуется осадок.Совершенно
необратимые – протекают только в одном
направлении. Пример.
![]() Более
подробно рассмотрим обратимую реакцию:
Более
подробно рассмотрим обратимую реакцию:
![]()
![]()
![]()
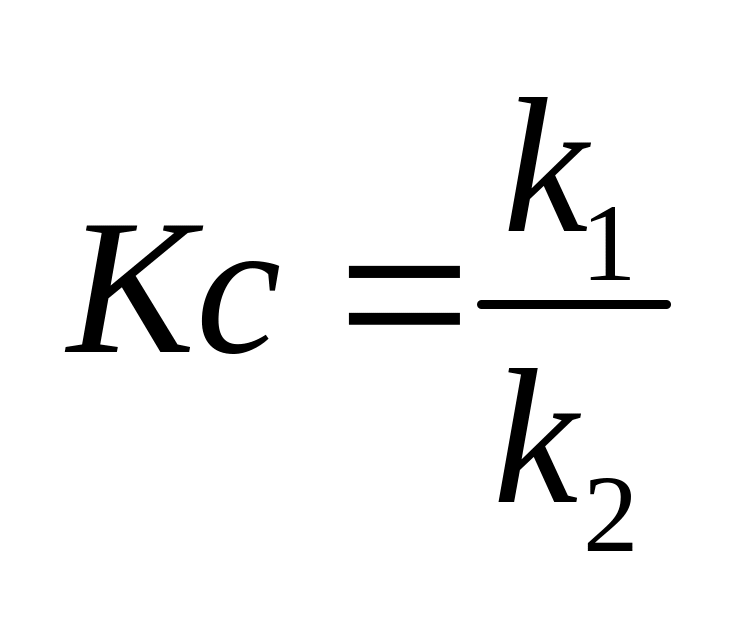
Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
 Согласно
правилу Вант-Гоффа, повышение темп-ры
на каждые 100 увеличивает ск-ть
реакции в 2-4 раза.
Согласно
правилу Вант-Гоффа, повышение темп-ры
на каждые 100 увеличивает ск-ть
реакции в 2-4 раза.![]() темп-ный коэфф-т ск-ти р-и.
темп-ный коэфф-т ск-ти р-и.![]() Пример.
Пример.![]() и
и
![]() тогда
тогда
![]()
С ростом темп-ры происходит перераспределение
эн.м/у мол-лами так, что резко возрастает
число акт-х молекул, обладающих некоторым
избытком эн-и (эн. активации). Большая
часть поступающей в систему энергии
тратится на ослабление внутримолекулярных
связей, что и делает молекулы активными.С.
Аррениус установил опытным путем
зависимость:
![]() к – константа скорости, А и В –
индивидуальные постоянные, характерные
для данной реакции.
к – константа скорости, А и В –
индивидуальные постоянные, характерные
для данной реакции.![]() .Физич.смысл
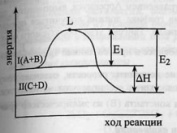
эн.активации. Рассмотрим график изменения
эн. в процессе протекания экзотермической
реакции. Уровень L отвечает
наименьшему запасу энергии у молекул,
которые необходим для их результативного
столковения.Разность L и
I – энергия активации
прямой реакции, L и II
– обратной.По пути из исходного состояния
в конечное система должна пройти через
некоторый энергетический барьер. И
только акт-е
.Физич.смысл
эн.активации. Рассмотрим график изменения
эн. в процессе протекания экзотермической
реакции. Уровень L отвечает
наименьшему запасу энергии у молекул,
которые необходим для их результативного
столковения.Разность L и
I – энергия активации
прямой реакции, L и II
– обратной.По пути из исходного состояния
в конечное система должна пройти через
некоторый энергетический барьер. И
только акт-е 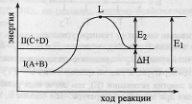 молекулы
могут его преодолеть. Рассмотрим график
изменения эн-и в процессе протекания
эндотерм-й реакции..Проведем небольшие
преобразования:
молекулы
могут его преодолеть. Рассмотрим график
изменения эн-и в процессе протекания
эндотерм-й реакции..Проведем небольшие
преобразования: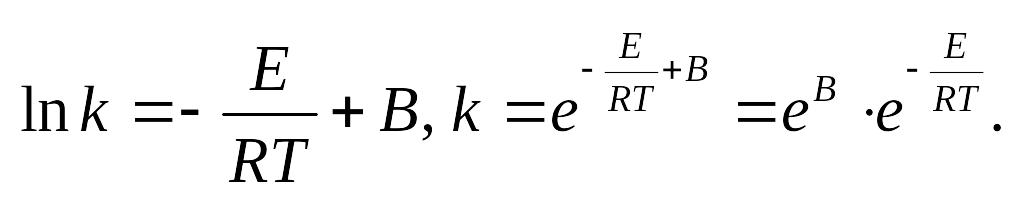
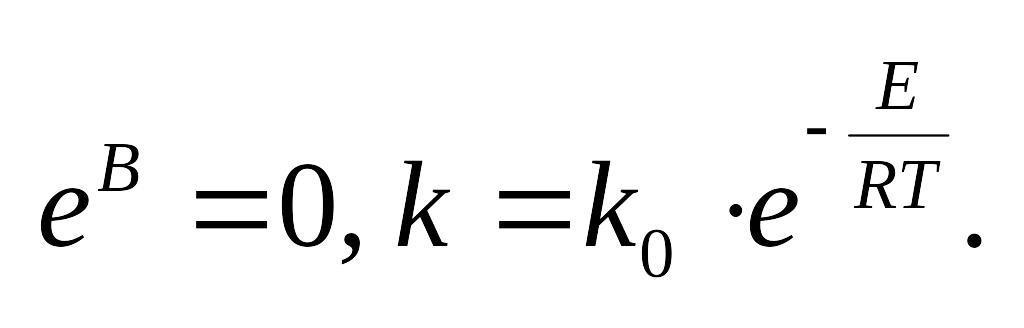
![]() - эмпирическое ур-е Аррениуса
- эмпирическое ур-е Аррениуса
