
- •Основные стехиометрические законы.
- •Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
- •Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского Энергетические ячейки. Правило Хунда.
- •Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Образование химической связи. Энергия и длина связи.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •Направленность ковалентной связи. Π – связи. Гибридизация атомных орбиталей.
- •Ионная (электронная) связь.
- •Представление о методе электронных орбиталей.
- •Полярность связи. Полярность молекул и дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Система. Фаза. Компонент. Параметры. Функция состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •Стандартная энтальпия образования. Следствие из закона Гесса.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •Постулат Планка. Стандартная энтропия веществ.
- •Объединенная формула первого и второго начал термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •Условия самопроизвольного протекания химических реакций.
- •Изотерма химической реакции. Стандартное изменение свободной энергии.
- •Константа химического равновесия. Различные способы выражения констант равновесия . Соотношения между константами.
- •Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •Принцип Ле-Шателье.
- •Скорость химической реакции. Закон действующих масс. Константа скорости.
- •Молекулярность и порядок реакции.
- •Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Энергия активации химической реакции. Аналитический и графический метод расчета.
- •Скорость гетерогенной химической реакции. Особенности ее протекания.
- •Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
- •Дисперсные системы. Коллоидные растворы.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Закон Рауля. Криоскопия и эбуллиоскопия.
- •Электролитическая диссоциация. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Произведение растворимости. Условие выпадения осадка.
- •Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений. Расчет эдс гальванического элемента.
- •Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролизе. Перенапряжение.
- •Классификация химических источников тока.
- •Коррозия металлов. Химическая и электрохимическая коррозия.
- •Основные методы борьбы с коррозией.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды). ???? диаграмма
- •Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Поверхностные явления. Понятие поверхностного натяжения.
- •Адсорбция и абсорбция. Изотермы адсорбции.
Стандартная энтальпия образования. Следствие из закона Гесса.
Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции.Следствия из закона Гесса:1. тепловой эффект реакции равен разности между суммой теплот горения исходных веществ и суммой теплот горения продуктов реакции.Теплота горения – тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов.Теплота образования – тепловой эффект реакции образования данного соединения из простых веществ.ю отвечающих наиболее устойчивому состоянию элементов при данных температуре и давлении.
2. тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования веществ в левой части уравнения, взятых с коэффициентами перед формулами этих веществ в уравнении самой реакции.В настоящее время известны теплоты образования свыше 6000 веществ.Стандартные теплоты образования – величины теплот образования к температуре 298К и давлению 1атм.
Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
.Температурный коэффициент теплового
эффекта процесса равен изменению
теплоемкости системы, происходящему в
результате процесса (закон Кирхгоффа).![]()
![]()
Чтобы подсчитать тепловой эффект процесса при некоторой температуре Т2, нужно знать тепловой эффект процесса при Т1, а также характер изменения теплоемкости системы в интервале температур Т1-Т2.
Обычно в роли Т1 выступает стандартная температура 298К.
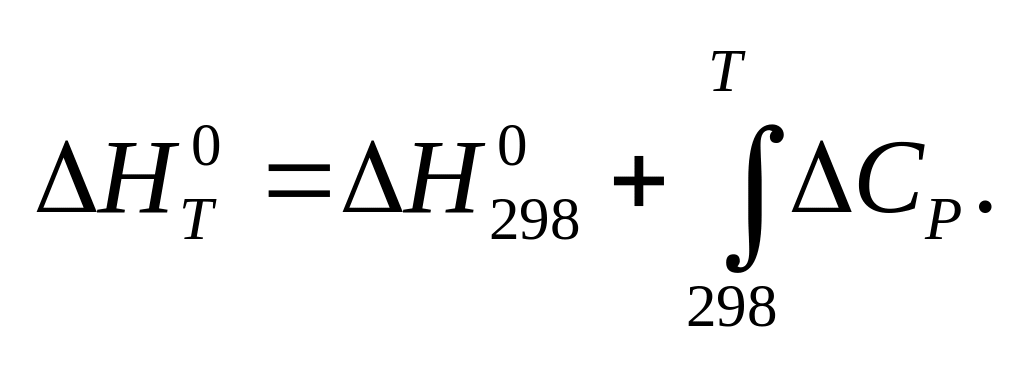
Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
Невозможен самопроизвольный переход
тепла от менее нагретого тела более
нагретому.Невозможно создание
вечного двигателя 2го рода(машины,
которая периодически превращает тепло
среды при пост.температуре в
работу.Термодинамич-й КПД:
![]() Для
изолир-ных систем критерием, позволяющим
судить о направлении процессов и об
условиях равновесия, является
функция-S-энтропия.Процессы
протекают в сторону увеличения энтропии.
При равновесии энтропия достигает
макс-ма. Обратное протекание процессов
не может быть самопроизв-м – требуется
затрата работы извне.Физ.смысл функ-и
состояния энтропии легче всего
проиллюстрировать на примере кипения
жидкости.При нагреве Т и U
увелич.до тех пор, пока жидкость не
закипит. При этом поглощается теплота
испарения, затрачиваемая на увеличение
беспорядка в системе.Таким образом,
энтропия – мера упорядоченности
состояния системы.
Для
изолир-ных систем критерием, позволяющим
судить о направлении процессов и об
условиях равновесия, является
функция-S-энтропия.Процессы
протекают в сторону увеличения энтропии.
При равновесии энтропия достигает
макс-ма. Обратное протекание процессов
не может быть самопроизв-м – требуется
затрата работы извне.Физ.смысл функ-и
состояния энтропии легче всего
проиллюстрировать на примере кипения
жидкости.При нагреве Т и U
увелич.до тех пор, пока жидкость не
закипит. При этом поглощается теплота
испарения, затрачиваемая на увеличение
беспорядка в системе.Таким образом,
энтропия – мера упорядоченности
состояния системы.
![]() -2е
начало термодинамики для обратимых
процессов.В изолированной системе
процессы самопроизвольные процессы
протекают в сторону увелич-я энтропии
-2е
начало термодинамики для обратимых
процессов.В изолированной системе
процессы самопроизвольные процессы
протекают в сторону увелич-я энтропии![]() В
неизолированных–возможно
В
неизолированных–возможно
![]() Примеры:
Примеры:
![]()
![]()
![]()
![]()
Постулат Планка. Стандартная энтропия веществ.
При абсолютном нуле энтропии реагирующих веществ в конденсированных системах равны нулю.
limT->0S=0
