
- •Основные стехиометрические законы.
- •Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
- •Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского Энергетические ячейки. Правило Хунда.
- •Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Образование химической связи. Энергия и длина связи.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •Направленность ковалентной связи. Π – связи. Гибридизация атомных орбиталей.
- •Ионная (электронная) связь.
- •Представление о методе электронных орбиталей.
- •Полярность связи. Полярность молекул и дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Система. Фаза. Компонент. Параметры. Функция состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •Стандартная энтальпия образования. Следствие из закона Гесса.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •Постулат Планка. Стандартная энтропия веществ.
- •Объединенная формула первого и второго начал термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •Условия самопроизвольного протекания химических реакций.
- •Изотерма химической реакции. Стандартное изменение свободной энергии.
- •Константа химического равновесия. Различные способы выражения констант равновесия . Соотношения между константами.
- •Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •Принцип Ле-Шателье.
- •Скорость химической реакции. Закон действующих масс. Константа скорости.
- •Молекулярность и порядок реакции.
- •Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Энергия активации химической реакции. Аналитический и графический метод расчета.
- •Скорость гетерогенной химической реакции. Особенности ее протекания.
- •Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
- •Дисперсные системы. Коллоидные растворы.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Закон Рауля. Криоскопия и эбуллиоскопия.
- •Электролитическая диссоциация. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Произведение растворимости. Условие выпадения осадка.
- •Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений. Расчет эдс гальванического элемента.
- •Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролизе. Перенапряжение.
- •Классификация химических источников тока.
- •Коррозия металлов. Химическая и электрохимическая коррозия.
- •Основные методы борьбы с коррозией.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды). ???? диаграмма
- •Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Поверхностные явления. Понятие поверхностного натяжения.
- •Адсорбция и абсорбция. Изотермы адсорбции.
Вопросы к экзамену по химии.
Оксиды. Основные химические свойства.
Кислоты. Основные химические свойства.
Основания. Основные химические свойства.
Соли. Основные химические свойства.
Основные газовые законы. Определение молекулярных масс газообразных веществ.
К основному газовому закону относится
уравнение состояния идеального газа
(уравнение Менделеева-Клапейрона):
![]()
Закон Авогадро.
В равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
Универсальный газовый закон
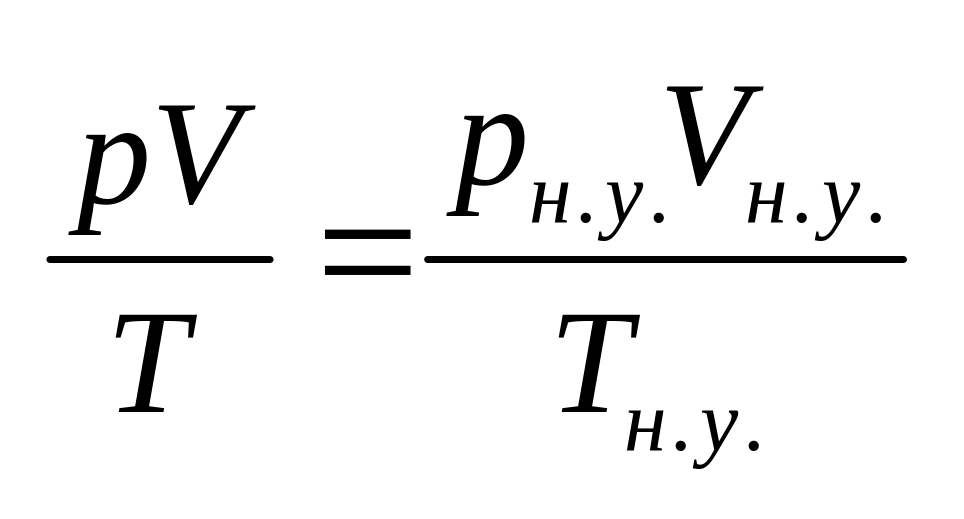
Для определения относительной молекулярной массы вещества обычно находят численно равную ей мольную массу вещества.
Единица молекулярной массы - 1/12 часть массы молекулы углерода, условно принятой равной 12.
Основные стехиометрические законы.
1. З.постоянства состава: в-во имеет постоянный состав независимо от способа его получения.
Пример. 2H2+O2=2H2O и 4NH3+3O2=6H2O+2N.
2. З.эквивалентов: в-ва вступают в хим. взаимодействие и замещают друг друга в соединениях в весовых количествах пропорциональным хим. эквивалентам этих веществ. Химический эквивалент - такое весовое количество вещества, которое реагирует с 1.008 весовых частей H2 или 8 в.ч. О2.
3. З. простых кратных отношений: если два элемента образуют несколько соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа. Пример:
H20/H2O2 , CO/CO2, N2O/NO/N2O3/NO2/N2O4/N2O5.
4. З. сохранения массы и энергии: в изолированной системе энергия постоянна и равна E=mc2
5. З. Авогадро: в равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять или быть каким-либо другим способом эквивалентна одному иону водорода в ионнообменных реакциях или одному электрону в ОВР.
Эквивалентная масса элемента - это масса 1 эквивалента элемента.
Эквивалентная масса вещества - это масса 1 эквивалента вещества.
Другими словами, эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты.
Закон химических эквивалентов:
Массы реаг. вещ-в пропорциональны их экв. массам.
Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
Уравнение де Бройля: =h/mV. Электроны проявляют свойства, присущие волне. Корпускулярные св-ва электрона проявляются в том, что он действует, как частица, как единое целое. Поскольку электрон обладает волновыми свойствами, положение его внутри объёма атома не определено.
Состояние любого электрона в атоме может быть охарактеризовано набором 4 квантовых чисел. n – главное квантовое число, l – побочное, m – магнитное, s – спиновое. Главное к.ч. характеризует собой общий запас энергии системы, если уподобить электрон облаку, то главное к.ч. характеризует собой размеры этого облака. Электроны одного и того же энергетического уровня образуют электронную оболочку. Электроны одного и того же уровня могут различаться по энергетическому состоянию. Электронные уровни подразделяются на подуровни. Электроны различных подуровней имеют различную форму облака. Энергетическое состояние электрона на подуровне характеризуется с помощью побочного к.ч. (l = n – 1). m – магнитное к.ч. – ориентация электронного облака в пространстве ( –l..0..+l). 2l+1 – кол-во орбиталей внутри подуровня. Спиновое к.ч. – характеризует направление вращения электрона. +/- 0,5
Электронная орбиталь - это область наиболее вероятного нахождения электрона в атоме.
Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
Принцип Паули: в атоме не может быть 2 электронов с одинаковым набором всех 4 к.ч. Максимальное число электронов на подуровне – 2(2l+1). Число электронов на уровне – 2n2. Максимальное число электронов на уровне - 32.
Распределение электронов по уровням и подуровням изображается с помощью электронных формул или ячеек.
