
- •Основные стехиометрические законы.
- •Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
- •Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского Энергетические ячейки. Правило Хунда.
- •Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Образование химической связи. Энергия и длина связи.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •Направленность ковалентной связи. Π – связи. Гибридизация атомных орбиталей.
- •Ионная (электронная) связь.
- •Представление о методе электронных орбиталей.
- •Полярность связи. Полярность молекул и дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Система. Фаза. Компонент. Параметры. Функция состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •Стандартная энтальпия образования. Следствие из закона Гесса.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •Постулат Планка. Стандартная энтропия веществ.
- •Объединенная формула первого и второго начал термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •Условия самопроизвольного протекания химических реакций.
- •Изотерма химической реакции. Стандартное изменение свободной энергии.
- •Константа химического равновесия. Различные способы выражения констант равновесия . Соотношения между константами.
- •Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •Принцип Ле-Шателье.
- •Скорость химической реакции. Закон действующих масс. Константа скорости.
- •Молекулярность и порядок реакции.
- •Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Энергия активации химической реакции. Аналитический и графический метод расчета.
- •Скорость гетерогенной химической реакции. Особенности ее протекания.
- •Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
- •Дисперсные системы. Коллоидные растворы.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Закон Рауля. Криоскопия и эбуллиоскопия.
- •Электролитическая диссоциация. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Произведение растворимости. Условие выпадения осадка.
- •Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений. Расчет эдс гальванического элемента.
- •Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролизе. Перенапряжение.
- •Классификация химических источников тока.
- •Коррозия металлов. Химическая и электрохимическая коррозия.
- •Основные методы борьбы с коррозией.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды). ???? диаграмма
- •Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Поверхностные явления. Понятие поверхностного натяжения.
- •Адсорбция и абсорбция. Изотермы адсорбции.
Овр. Ионно-электронный метод подбора коэффициентов в овр.
Любая ОВР состоит из процессов окисления
и восстановления.Окисление – отдача
электронов веществом, т.е повышение
степени окисления элемента.Пример.
![]() Вещества,
отдающие электроны, называют
восстановителями.Типичные
восстановители: водород, металлы,
углерод.Восстановление – смещение
электронов к веществу или понижение
степени окисления.Пример.
Вещества,
отдающие электроны, называют
восстановителями.Типичные
восстановители: водород, металлы,
углерод.Восстановление – смещение
электронов к веществу или понижение
степени окисления.Пример.
![]() Вещества,
принимающие электроны, называют
окислителями.Типичные окислители:
галогены, водород, соединения кислорода
Вещества,
принимающие электроны, называют
окислителями.Типичные окислители:
галогены, водород, соединения кислорода
![]() Существуют
реакции межмолекулярные (окислители
и восстановители – разные вещества) и
внутримолекулярные (окислители и
восстановители – атомы одной молекулы).
Существуют
реакции межмолекулярные (окислители
и восстановители – разные вещества) и
внутримолекулярные (окислители и
восстановители – атомы одной молекулы).
Пример.
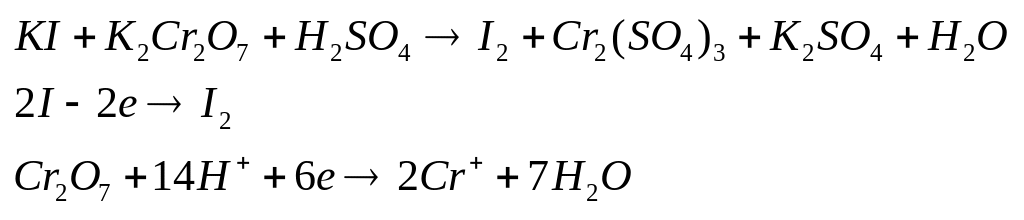
![]()
Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
Электрохимия – область
физической химии, охватывающая химические
процессы, сопровождающиеся возникновением
электрического тока, либо вызванные
действием электрического тока. Электрод
– проводник 1 рода, погруженный в раствор
электролита в условиях прохождения
через него тока. В объеме металла
устанавливается подвижное равновесие:
Ме=Men++
n*ē. При погружении электрода
в воду катионы металла гидратируются
полярными молекулами воды и переходят
в раствор, Men++
mH2O=Meрn+m*H2O.
Поверхность электрода заряжается
отрицательно за счет оставшихся
электронов, из-за этого перешедшие в
раствор катионы не могут отойти от
электрода. Катионы и электроны создают
двойной электрический слой (его
толщина зависит от концентрации
раствора, температуры, заряда металла).
Пограничный слой жидкости заряжается
положительно, поверхность металла
отрицательно, возникает скачок
электрического потенциала – электродный
потенциал.Потенциал, отвечающий
состоянию равновесия, когда скорость
перехода ионов в раствор равна скорости
их осаждения – равновесный потенциал.Для
всех металлов, погружаемых в чистую
воду, качественно наблюдается одинаковая
картина: металл заряжается отрицательно,
прилегающий слой жидкости –
положительно.Данный скачок можно
охарактеризовать реакцией:
![]() Рассмотрим
погружение в раствор активного и
неактивного металла.1. Активный металл
посылает большое число ионов в раствор,
равновесная концентрация его ионов
трудно достижима => металл будет
заряжаться отрицательно.2. Равновесная
концентрация очень мала => электроду
сообщается положительный заряд, а
оставшиеся анионы создают отрицательный
заряд у прилегающего слоя.
Рассмотрим
погружение в раствор активного и
неактивного металла.1. Активный металл
посылает большое число ионов в раствор,
равновесная концентрация его ионов
трудно достижима => металл будет
заряжаться отрицательно.2. Равновесная
концентрация очень мала => электроду
сообщается положительный заряд, а
оставшиеся анионы создают отрицательный
заряд у прилегающего слоя.
Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
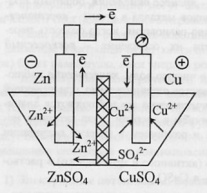
ЭДС.Гальванический элемент – любое
устройство, дающее возможность получать
электрический ток за счет проведения
той или иной химической реакции.Рассмотрим
систему, в которой медь и цинк в виде
пластинок помещены в растворы своих
солей, разделенных перегородкой –
диафрагмой. При разомкнутой цепи
электроды приобретают равновесные
потенциалы, которые отличаются по знаку
и по величине. При ее замыкании электроны
от цинкового электрода перемещаются к
медному. На электродах нарушается
равновесие:
![]() Получают
развитие две реакции: на катоде –
окисление Zn=Zn2++2ē, на аноде –
восстановление Cu2++2ē=Сu0.Суммарная
реакция:
Получают
развитие две реакции: на катоде –
окисление Zn=Zn2++2ē, на аноде –
восстановление Cu2++2ē=Сu0.Суммарная
реакция:
![]() Гальванический
элемент на основе такой реакции был
предложен русским ученым Якоби.
Создателем является и ученый Даниэль.В
связи с восстановлением катионов у
медного электрода накапливается избыток
анионов SO22-,
а у цинкового электрода их недостаток.
Эти анионы начинают перемещаться через
полупроницаемую перегородку, замыкая
цепь.Причина возникновения тока –
разность потенциалов на электродах.
ЭДС элемента – максимальная разность
потенциалов, отвечающая обратимым
условиям работы гальванического
элемента. Она равна алгебраической
сумме отдельных скачков потенциалов
на границах раздела фаз, образующих
элемент. Очевидно, чем больше ЭДС, тем
быстрее протекает реакция
окисления-восстновления.Гальваническая
цепь – последовательная совокупность
скачков потенциалов на поверхностях
раздела, отвечающих данному гальваническому
элементу. В данном случае цепь записывается:
Гальванический
элемент на основе такой реакции был
предложен русским ученым Якоби.
Создателем является и ученый Даниэль.В
связи с восстановлением катионов у
медного электрода накапливается избыток
анионов SO22-,
а у цинкового электрода их недостаток.
Эти анионы начинают перемещаться через
полупроницаемую перегородку, замыкая
цепь.Причина возникновения тока –
разность потенциалов на электродах.
ЭДС элемента – максимальная разность
потенциалов, отвечающая обратимым
условиям работы гальванического
элемента. Она равна алгебраической
сумме отдельных скачков потенциалов
на границах раздела фаз, образующих
элемент. Очевидно, чем больше ЭДС, тем
быстрее протекает реакция
окисления-восстновления.Гальваническая
цепь – последовательная совокупность
скачков потенциалов на поверхностях
раздела, отвечающих данному гальваническому
элементу. В данном случае цепь записывается:
![]()
![]() 1
и 3 – скачки на границах «электрод-электролит»,
2 – на границе электролита, 4 – на границе
двух металлов.Величиной
1
и 3 – скачки на границах «электрод-электролит»,
2 – на границе электролита, 4 – на границе
двух металлов.Величиной
![]() можно пренебречь.
можно пренебречь.
