
- •Основные стехиометрические законы.
- •Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
- •Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского Энергетические ячейки. Правило Хунда.
- •Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Образование химической связи. Энергия и длина связи.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •Направленность ковалентной связи. Π – связи. Гибридизация атомных орбиталей.
- •Ионная (электронная) связь.
- •Представление о методе электронных орбиталей.
- •Полярность связи. Полярность молекул и дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Система. Фаза. Компонент. Параметры. Функция состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •Стандартная энтальпия образования. Следствие из закона Гесса.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •Постулат Планка. Стандартная энтропия веществ.
- •Объединенная формула первого и второго начал термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •Условия самопроизвольного протекания химических реакций.
- •Изотерма химической реакции. Стандартное изменение свободной энергии.
- •Константа химического равновесия. Различные способы выражения констант равновесия . Соотношения между константами.
- •Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •Принцип Ле-Шателье.
- •Скорость химической реакции. Закон действующих масс. Константа скорости.
- •Молекулярность и порядок реакции.
- •Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Энергия активации химической реакции. Аналитический и графический метод расчета.
- •Скорость гетерогенной химической реакции. Особенности ее протекания.
- •Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
- •Дисперсные системы. Коллоидные растворы.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Закон Рауля. Криоскопия и эбуллиоскопия.
- •Электролитическая диссоциация. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Произведение растворимости. Условие выпадения осадка.
- •Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений. Расчет эдс гальванического элемента.
- •Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролизе. Перенапряжение.
- •Классификация химических источников тока.
- •Коррозия металлов. Химическая и электрохимическая коррозия.
- •Основные методы борьбы с коррозией.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды). ???? диаграмма
- •Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Поверхностные явления. Понятие поверхностного натяжения.
- •Адсорбция и абсорбция. Изотермы адсорбции.
Полярность связи. Полярность молекул и дипольный момент.
Предположим, что мы имеем соединение
АB. Оба элемента с большими
знач-миэлектроотрицательности (![]() ).=>
общая электронная пара в молекуле
смещена от атомаB к атомуА.Электронейтральность
нарушается,в мол-ле появл-ся полож-ный(B)
и отриц.(A) полюса. Такая
сист.наз-ся диполь–полярная молекула
(сист.из 2-х разноименных,одинак.по
величине зарядов, нах-ся на малом
расстоянии). Ков.св.–полярная.Осн.харак-ка
диполя–дипольный момент.
).=>
общая электронная пара в молекуле
смещена от атомаB к атомуА.Электронейтральность
нарушается,в мол-ле появл-ся полож-ный(B)
и отриц.(A) полюса. Такая
сист.наз-ся диполь–полярная молекула
(сист.из 2-х разноименных,одинак.по
величине зарядов, нах-ся на малом
расстоянии). Ков.св.–полярная.Осн.харак-ка
диполя–дипольный момент.
![]()
![]() -напряж.поля,созд.диполем.
-напряж.поля,созд.диполем.
l–плечо диполя.Примеры
полярных молекул-диполей:
![]() и др.Чем больше плечо, тем полярнее
молекула.
и др.Чем больше плечо, тем полярнее
молекула.![]() можно представить как произведение
некоторой величины D
(единицы Дебая) на
можно представить как произведение
некоторой величины D
(единицы Дебая) на
![]() Для
ионных соед.D=4-11 единиц,
для полярных D=0-4
единиц.Полярность св.– вектор,
напр-ный от отриц-го полюса к полож-му,
происходит взаимное уничтожение
векторов.
Для
ионных соед.D=4-11 единиц,
для полярных D=0-4
единиц.Полярность св.– вектор,
напр-ный от отриц-го полюса к полож-му,
происходит взаимное уничтожение
векторов.
Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
Донорно-акцепторная связь (ДАС) –
разновидность ковалентной связи.
Выделяют соед.1-го порядка(или
валентно-насыщенные соед.) Пример: H2O,
AgCl, NH3, HCl, KJ, CuSO4, FeCl3 и т.д. Реагируя друг
с другом дают соед.высшего порядка
(или компл.соед.).![]()
![]()
![]() В
компл.соед-х проявляются ДАС. Рассмотрим
пример:
В
компл.соед-х проявляются ДАС. Рассмотрим
пример: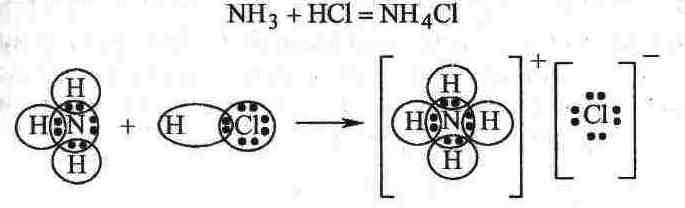
Азот в NH3 – донор, водород
в HCl–акцептор.
Компл.соед.–соед.высшего порядка,
возн-е из соед-й1-го порядка без образования
новых электронных пар, а за счет проявления
хотя бы одной ДАС. Предложено 2 теории
возникн-я компл.соед-й.1-я–Полин–теория
вал-х св-й. Комлексообразователь,координирующий
лиганды вокруг себя, имеет вакантные
орбитали.Т.е.образ-е компл.соед-1–результат
проявления ДАС,Вторая–Бете теория
кристаллического поля.Связь в
комплексах–электростатич-я,т.е. взаимод.
типа «ион-ион»или«ион-диполь».![]() Конст.равновесия
(нестойкости) К
Конст.равновесия
(нестойкости) К![]() Чем<значение Кн,тем прочнее компл-й
ион.
Чем<значение Кн,тем прочнее компл-й
ион.
Межмолекулярное взаимодействие. Водородная связь.
.Водородная связь наблюдается при взаимодействии атома водорода с атомами сильно электроотрицательных элементов–F,O,N,Cl,S.Природа этой связи до конца не изучена: проявление сил межмолекулярного взаимодействия, но характер сил – электростатический.В случае возникновения водородной связи водород ведет себя как двухвалентный элемент.Наличие водородных связей объясняет так называемые аномальные свойства воды:1. макс. плотность при температуре +4.
2. вода обладает наибольшей теплоемкостью из известных жидкостей.
При нагреве воды значительная часть
энергии затрачивается на разрыв связей,
отсюда и повышенная теплоемкость.Между
молекулами в газах, жидкостях и твердых
телах действуют одновременно силы
отталкивания и притяжения.Проявление
сил отталкивания – результат
взаимодействия заполненных электронных
оболочек, эти силы действуют на очень
малых расстояниях и быстро убывают с
увеличением расстояния.![]() A и n (12) –
эмпирические константы, r
– расстояние между частицами.Теоретически
лучше изложены силы притяжения.
Различают ориентационное, индукционное
и дисперсионное взаимодействия.Ориентационное.
Имеет место между молекулами – ярко
выраженными диполями.
A и n (12) –
эмпирические константы, r
– расстояние между частицами.Теоретически
лучше изложены силы притяжения.
Различают ориентационное, индукционное
и дисперсионное взаимодействия.Ориентационное.
Имеет место между молекулами – ярко
выраженными диполями. k
– константа Больцмана, «ню» - дипольные
моменты молекул.Индукционное. Если
одна из молекул полярна, вторая –
неполярна, но легко поляризуема.
k
– константа Больцмана, «ню» - дипольные
моменты молекул.Индукционное. Если
одна из молекул полярна, вторая –
неполярна, но легко поляризуема.![]() «альфа»
- коэффициент поляризации.Дисперсионное.
Возникновение мгновенных диполей.
«альфа»
- коэффициент поляризации.Дисперсионное.
Возникновение мгновенных диполей.![]() I
– потенциал ионизации, h
– постоянная Планка.В общем силы
притяжения могут быть представлены как
I
– потенциал ионизации, h
– постоянная Планка.В общем силы
притяжения могут быть представлены как
![]() B и m (6) –
константы.Суммарная энергия
B и m (6) –
константы.Суммарная энергия
![]()
