
- •Основные стехиометрические законы.
- •Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
- •Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского Энергетические ячейки. Правило Хунда.
- •Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Образование химической связи. Энергия и длина связи.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •Направленность ковалентной связи. Π – связи. Гибридизация атомных орбиталей.
- •Ионная (электронная) связь.
- •Представление о методе электронных орбиталей.
- •Полярность связи. Полярность молекул и дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Система. Фаза. Компонент. Параметры. Функция состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •Стандартная энтальпия образования. Следствие из закона Гесса.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •Постулат Планка. Стандартная энтропия веществ.
- •Объединенная формула первого и второго начал термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •Условия самопроизвольного протекания химических реакций.
- •Изотерма химической реакции. Стандартное изменение свободной энергии.
- •Константа химического равновесия. Различные способы выражения констант равновесия . Соотношения между константами.
- •Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •Принцип Ле-Шателье.
- •Скорость химической реакции. Закон действующих масс. Константа скорости.
- •Молекулярность и порядок реакции.
- •Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Энергия активации химической реакции. Аналитический и графический метод расчета.
- •Скорость гетерогенной химической реакции. Особенности ее протекания.
- •Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
- •Дисперсные системы. Коллоидные растворы.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Закон Рауля. Криоскопия и эбуллиоскопия.
- •Электролитическая диссоциация. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Произведение растворимости. Условие выпадения осадка.
- •Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений. Расчет эдс гальванического элемента.
- •Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролизе. Перенапряжение.
- •Классификация химических источников тока.
- •Коррозия металлов. Химическая и электрохимическая коррозия.
- •Основные методы борьбы с коррозией.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды). ???? диаграмма
- •Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Поверхностные явления. Понятие поверхностного натяжения.
- •Адсорбция и абсорбция. Изотермы адсорбции.
Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
 Электрод
– проводник 1 рода, погруженный в раствор
электролита в условиях прохождения
через него тока. Три типа: электроды
первого, второго и третьего рода.
Электроды 1-го рода. Металлы, погруженные
в растворы своих солей.солей:
Электрод
– проводник 1 рода, погруженный в раствор
электролита в условиях прохождения
через него тока. Три типа: электроды
первого, второго и третьего рода.
Электроды 1-го рода. Металлы, погруженные
в растворы своих солей.солей:
![]() Электроды
2-го рода. Металл погружен в насыщенный
раствор своей малорастворимой соли, к
которой добавлена другая соль с тем же
анионом, но хорошо растворимая. Пример.
Электроды
2-го рода. Металл погружен в насыщенный
раствор своей малорастворимой соли, к
которой добавлена другая соль с тем же
анионом, но хорошо растворимая. Пример.
![]() Процессы
на электроде:
Процессы
на электроде:
 Электроды
3-го рода (газовые электроды).Известны
водородный, кислородный и хлорный
электроды. Потенциал газового электрода
зависит как от активности ионов, так и
от давления газа.Кроме электродов
существуют цепи (концентрационные
и альмагамные). Концентрационная
цепь.В сосуд помещены 2 одинаковых
электрода и залиты раствором, содержащим
ионы металла.При замыкании цепи получают
развитие процессы, приводящие к
выравниванию концентрации всех
растворов.ЭДС элемента:
Электроды
3-го рода (газовые электроды).Известны
водородный, кислородный и хлорный
электроды. Потенциал газового электрода
зависит как от активности ионов, так и
от давления газа.Кроме электродов
существуют цепи (концентрационные
и альмагамные). Концентрационная
цепь.В сосуд помещены 2 одинаковых
электрода и залиты раствором, содержащим
ионы металла.При замыкании цепи получают
развитие процессы, приводящие к
выравниванию концентрации всех
растворов.ЭДС элемента:
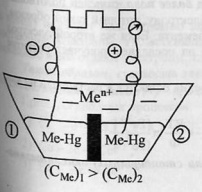
![]() Альмагамные
цепи.Альмагама – сплав металла со
ртутью, остающийся жидким при комнатной
температуре.В сосуд залиты альмагамы
с различной концентрацией металла и
электролит, содержащий ионы металла.При
работе элемента: окисление в первом
отделе, восстновление – во втором.Процессы
продолжаются до выравнивания концентраций
электролитов и альмагам.В принципе
любой электрод окислительно-восстановительный,
но этот термин применяется только в том
случае, если материал электродов не
изменяется, а служит лишь источником
или приемником электронов.Эти электроды,
таким образом, обеспечивают отвод/подвод
электронов.Имеются таблицы стандартных
окислительно-восстановительных
потенциалов.
Альмагамные
цепи.Альмагама – сплав металла со
ртутью, остающийся жидким при комнатной
температуре.В сосуд залиты альмагамы
с различной концентрацией металла и
электролит, содержащий ионы металла.При
работе элемента: окисление в первом
отделе, восстновление – во втором.Процессы
продолжаются до выравнивания концентраций
электролитов и альмагам.В принципе
любой электрод окислительно-восстановительный,
но этот термин применяется только в том
случае, если материал электродов не
изменяется, а служит лишь источником
или приемником электронов.Эти электроды,
таким образом, обеспечивают отвод/подвод
электронов.Имеются таблицы стандартных
окислительно-восстановительных
потенциалов.
Электролиз. Последовательность разряда ионов на катоде и аноде.
Электролиз - это окислительно-восстановительный
процесс, протекающий при прохождении
постоянного тока через раствор или
расплав электролита.Сущность
электролиза: на катоде(-) идет процесс
восстановления, на аноде(+) – процесс
окисления.Пример.
![]() Различают
первичные (электронный) и вторичные
(химический) процессы.Последовательность
разряда ионов в водных растворах.Вода
частично ионизирована.
Различают
первичные (электронный) и вторичные
(химический) процессы.Последовательность
разряда ионов в водных растворах.Вода
частично ионизирована.
![]() На катоде в первую очередь восстанавливается
тот катион, потенциал которого более
положителен.Все металлы можно разделить
на 3 группы.1-я группа – с наименьшей
алгебраической величиной
На катоде в первую очередь восстанавливается
тот катион, потенциал которого более
положителен.Все металлы можно разделить
на 3 группы.1-я группа – с наименьшей
алгебраической величиной
![]() от Li до Al (включительно). При электролизе
водных растворов, содержащих ионы
металлов 1-й группы на катоде идет только
процесс восстановление катионов Н+.2-я
группа - со средней алгебраической
величиной
от Mn до Fe
(Fe3+). При электолизе
водных растворов, содержащих ионы Ме
2ой группы на катоде идут 2 процесса:
Men++nē®Me°,
H++ē®H.
от Li до Al (включительно). При электролизе
водных растворов, содержащих ионы
металлов 1-й группы на катоде идет только
процесс восстановление катионов Н+.2-я
группа - со средней алгебраической
величиной
от Mn до Fe
(Fe3+). При электолизе
водных растворов, содержащих ионы Ме
2ой группы на катоде идут 2 процесса:
Men++nē®Me°,
H++ē®H.
![]() - выход по току, отношение практически
полученного на катоде вещества к
теоретически возможному, которое должно
было бы выделиться по закону Фарадея.3-я
группа – с наибольшей алгебраической
величиной
все
Ме, расположенные в ряду напряжений
после водорода. На катоде – только
восстановление катионов Ме, Меn++nē®Ме°.
Порядок окисления анионов на аноде: на
аноде в 1-ю очередь окисляется анион,
- выход по току, отношение практически
полученного на катоде вещества к
теоретически возможному, которое должно
было бы выделиться по закону Фарадея.3-я
группа – с наибольшей алгебраической
величиной
все
Ме, расположенные в ряду напряжений
после водорода. На катоде – только
восстановление катионов Ме, Меn++nē®Ме°.
Порядок окисления анионов на аноде: на
аноде в 1-ю очередь окисляется анион,
![]() которого более отрицателен.В случае
нерастворимого анода (графит, уголь,
Pt, Au, Ir) в первую очередь окисляются
анионы бескислородных кислот. Если этих
ионов нет, то если среда щелочная,
окисляются анионы гидроксила. Если
среда кислая или нейтральная, то имеет
место прямое окисление воды.В случае
растворимого анода, имеет место процесс:
которого более отрицателен.В случае
нерастворимого анода (графит, уголь,
Pt, Au, Ir) в первую очередь окисляются
анионы бескислородных кислот. Если этих
ионов нет, то если среда щелочная,
окисляются анионы гидроксила. Если
среда кислая или нейтральная, то имеет
место прямое окисление воды.В случае
растворимого анода, имеет место процесс:
![]()
