
- •Основные стехиометрические законы.
- •Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
- •Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского Энергетические ячейки. Правило Хунда.
- •Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Образование химической связи. Энергия и длина связи.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •Направленность ковалентной связи. Π – связи. Гибридизация атомных орбиталей.
- •Ионная (электронная) связь.
- •Представление о методе электронных орбиталей.
- •Полярность связи. Полярность молекул и дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Система. Фаза. Компонент. Параметры. Функция состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •Стандартная энтальпия образования. Следствие из закона Гесса.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •Постулат Планка. Стандартная энтропия веществ.
- •Объединенная формула первого и второго начал термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •Условия самопроизвольного протекания химических реакций.
- •Изотерма химической реакции. Стандартное изменение свободной энергии.
- •Константа химического равновесия. Различные способы выражения констант равновесия . Соотношения между константами.
- •Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •Принцип Ле-Шателье.
- •Скорость химической реакции. Закон действующих масс. Константа скорости.
- •Молекулярность и порядок реакции.
- •Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Энергия активации химической реакции. Аналитический и графический метод расчета.
- •Скорость гетерогенной химической реакции. Особенности ее протекания.
- •Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
- •Дисперсные системы. Коллоидные растворы.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Закон Рауля. Криоскопия и эбуллиоскопия.
- •Электролитическая диссоциация. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Произведение растворимости. Условие выпадения осадка.
- •Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений. Расчет эдс гальванического элемента.
- •Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролизе. Перенапряжение.
- •Классификация химических источников тока.
- •Коррозия металлов. Химическая и электрохимическая коррозия.
- •Основные методы борьбы с коррозией.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды). ???? диаграмма
- •Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Поверхностные явления. Понятие поверхностного натяжения.
- •Адсорбция и абсорбция. Изотермы адсорбции.
Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
В отличие от твердых веществ и жидкостей растворимость газов с повышением температуры уменьшается. При кипячении происходит почти полное удаление из нее растворенных газов.
З.Генри: Растворимость газа, выраженная в весовых единицах, при постоянной температуре пропорциональна давлению газа над раствором.
З. Дальтона: в случае растворения смеси газов в жидкости каждый из них растворяется пропорционально своему парциальному давлению.
Согласно закону распределения, вещество,
растворенное в двух несмешивающихся
или ограниченно смешивающихся жидкостях,
распределяется между ними в постоянном
отношении. Это отношение для идеальных
систем зависит только от температуры,
природы вещества и не зависит от
концентрации. Из этого закона следует,
что при одновременном растворении
нескольких веществ каждое из них
распределяется между обеими жидкими
фазами таким образом, как будто в системе
нет никаких других веществ, подлежащих
распределению. Закон распределения
справедлив лишь в том случае, если
распределяемое вещество в обеих фазах
находится в одной и той же форме. Константа
распределения вещества. Постоянная
величина, выражающая отношение
концентраций распределяемого вещества,
находящегося в обеих фазах (после
наступления равновесия) в одной и той
же форме, называется константой
распределения: ![]()
где Р о — константа распределения: [А] о —концентрация вещества в фазе органического растворителя, моль/л; [А] В — концентрация вещества в водной фазе, моль/л.
Закон Рауля. Криоскопия и эбуллиоскопия.
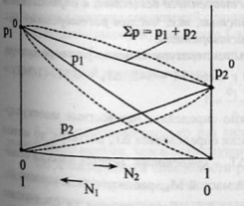 Особенность
растворов: давление пара растворителя
над раствором ниже, чем над чистым
растворителем.
Особенность
растворов: давление пара растворителя
над раствором ниже, чем над чистым
растворителем.
Первый закон. Давление пара
растворителя над раствором пропорционально
мольной доле растворителя в растворе.или
Относительно понижение давление пара
растворителя над раствором равно мольной
доли растворенного вещества.Введем
обозначения:![]() давление пара растворителя над чистым
растворителем;
давление пара растворителя над чистым
растворителем;![]() давление пара растворителя над раствором;
давление пара растворителя над раствором;![]() абсолютное понижение давления;
абсолютное понижение давления;![]() относительное понижение давления.
относительное понижение давления.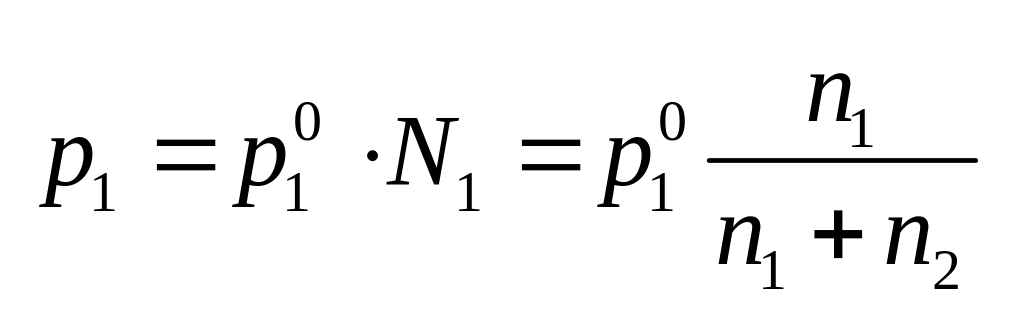
![]() Если
система полностью подчиняется закону,
на графике наблюдаются прямолинейные
зависимости. Однако в реальных системах
наблюдаются отклонения. Температура
замерзания раствора ниже температуры
замерзания чистого растворителя, а
температура кипения – выше.
Если
система полностью подчиняется закону,
на графике наблюдаются прямолинейные
зависимости. Однако в реальных системах
наблюдаются отклонения. Температура
замерзания раствора ниже температуры
замерзания чистого растворителя, а
температура кипения – выше.
Второй закон. Повышение температуры
кипения раствора и понижение температуры
его замерзания пропорциональны моляльной
концентрации раствора.![]()
![]() К – константа, характеризующая
растворитель.
К – константа, характеризующая
растворитель.![]() не зависит от природы вещества, а
определяется природой растворителя и
моляльностью, т.е. числом растворенных
молекул в определенном количестве
растворителя.С помощью законов Рауля
можно определять неизвестные молекулярные
массы растворенных веществ.
не зависит от природы вещества, а
определяется природой растворителя и
моляльностью, т.е. числом растворенных
молекул в определенном количестве
растворителя.С помощью законов Рауля
можно определять неизвестные молекулярные
массы растворенных веществ.
С помощью закона Рауля можно определять неизвестные молекулярные массы растворенных веществ. Если определяется ∆Тk раствора, то метод носит название эбуллиоскопия, если ∆Тk – криоскопия.
