
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Полярная связь. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •19. Зависимость теплового эффекта реакции от температуры.
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •22. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •24. Принцип подвижного равновесия (принцип Ле-Шателье).
- •25. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •26. Молекулярность и порядок реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •30. Скорость гетерогенной химической реакции.
- •31. Катализ. Сущность гомогенного и гетерогенного катализа.
- •32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
- •33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •35. Законы Рауля.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •37. Константы диссоциации. Закон разведения.
- •38. Сильные электролиты. Понятие активности и коэффициента активности.
- •39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •40. Гидролиз солей.
- •41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •44. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •47. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •48. Законы Фарадея. Выход по току.
- •49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •50. Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
- •60. Произведение растворимости. Условия выпадения осадка.
20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
Второй закон используется для выяснения направления протекания процессов и положения равновесия.
Формулировки:
-невозможен самопроизвольный переход тепла от менее нагретого тела к более нагретому.
-невозможно создание вечного двигателя 2 рода, т.е. машины, которая периодически превращает тепло среды при постоянной температуре в работу.
-невозможен процесс, единственным результатом которого было бы превращение теплоты в работу.
Второе начало термодинамики для изолированных систем: в изолированных системах самопроизвольно идут только те процессы, которые сопровождаются возрастанием энтропии.
Энтропия – аддитивная величина, принимающая экстремальные значения при равновесии.
S=k*ln(W), где W – термодинамическая вероятность.
dS=δQ/T.
Окончательная формулировка: существует функция состояния – энтропия, приращение которой при обратимых процессах равно приведенному теплу; энтропия изолированной системы стремится к максимуму.
21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
δA≤TdS-dU
при V,T=const Amax=T(S2-S1)-(U2-U1)=U1-TS1-(U2-TS2)=-∆F
F=U-TS (F-свободная энергия Гельмгольца)
При p,T=const
δA'max≤TdS-dU-pdV
A’max=T(S2-S1)-(U2-U1)-p(V2-V1)=(U1+pV1-TS1)-(U2+pV2-TS2)=-∆G
G=H-TS – свободная энергия Гиббса.
22. Условия самопроизвольного протекания химических реакций.
dF=dU-TdS-SdT
dG=dH-TdS-SdT=dU+pdV+Vdp-TdS-SdT
dU≤TdS-pdV
dF=TdS-pdV-TdS-SdT=-pdV-SdT
dG≤0
V,T=const dF≤0, ∆F<0 – самопроизвольное протекание (в прямом направлении)
P,T=const dG≤0, ∆G<0 – самопроизвольное протекание (в прямом направлении)
1) изменение свободной энергии не зависит от пути процесса
2) знак ∆ свободной энергии определяет направление реакции:
Если ∆<0, то
∆>0, то
23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
Химические реакции протекают не до полного исчезновения исходных веществ, а останавливаются при достижении определенного состояния равновесия, при этом в равновесной смеси содержатся как продукты реакции, так и исходные вещества. На практике важно знать, в какую сторону смещено равновесие.
Кр=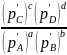 ,
при равновесных парциальных давлениях,
,
при равновесных парциальных давлениях,
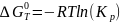
Уравнение изотермы х.р.
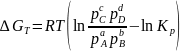
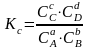
24. Принцип подвижного равновесия (принцип Ле-Шателье).
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие.
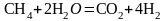
1. Влияние концентраций (парциальных давлений). Увеличение С метана увеличивает С продуктов, уменьшает С водяного пара, равновесие смещается вправо. Введение диоксида углерода сместит равновесие влево.
2. Влияние общего давления в системе. Увеличение общего давления вызывает смещение расновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. В данной реакции – влево.
3. Влияние температуры.
С увеличением температуры равновесие
смещается в сторону эндотермических
реакций. Повышение температуры в данной
реакции (∆Н>0) смещает равновесие
вправо, а для экзотермической реакции
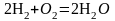 (∆H<0)
влево.
(∆H<0)
влево.
