
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Полярная связь. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •19. Зависимость теплового эффекта реакции от температуры.
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •22. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •24. Принцип подвижного равновесия (принцип Ле-Шателье).
- •25. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •26. Молекулярность и порядок реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •30. Скорость гетерогенной химической реакции.
- •31. Катализ. Сущность гомогенного и гетерогенного катализа.
- •32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
- •33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •35. Законы Рауля.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •37. Константы диссоциации. Закон разведения.
- •38. Сильные электролиты. Понятие активности и коэффициента активности.
- •39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •40. Гидролиз солей.
- •41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •44. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •47. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •48. Законы Фарадея. Выход по току.
- •49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •50. Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
- •60. Произведение растворимости. Условия выпадения осадка.
39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
Удельная электроотрицательность дистиллированной воды составляет:
cc=5.48*10-8 Ом-1*см-1
 (термохимическое правило
знаков т.е. теплота поглощается)
(термохимическое правило
знаков т.е. теплота поглощается)
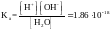 при
t=220
при
t=220
Вода-смесь молекул воды, катионов водорода и анионов гидроксила, в знаменателе – концентрация недиссоциированных молекул воды в воде.
KД[H2O]=[H+][OH-]=KВ – ионное произведение воды.
Полагаем, что концентрация недиссоциированных мол-л воды в воде равна общей мольной концет-ии воды.
[H2O]=1000/18.016=55.56 моль/л
КВ=[H+][OH-]=1.8*10-16*55.56=10-14 при t=220С
Поскольку процесс диссоц-ии воды – пр-сс эндотермический, то с ростом температуры дис-ция воды будет усиливаться,. а значит ионное произведение воды будет увеличиваться.
КВ=а*10-14
t0C |
a |
KB |
0 |
0.13 |
0.13*10-14 |
22 |
1.0 |
10-14 |
25 |
1.008 |
… |
50 |
5.66 |
… |
100 |
74.0 |
… |
[H+]=[OH-] – условие нейтральности воды.
 г-ион/л
г-ион/л
t=250C - [H+]=10-7 г-ион/л (приблизительно)
Мы можем определить aa:
aa=[H+]/[H20]=1.004*10-7/55.56=1.8*10-9 при t=250C
нейтральный раствор:[H+]=10-7 г-ион/л
кислый раствор: [H+]>10-7 г-ион/л
щелочной раствор: [H+]<10-7 г-ион/л
Допустим : [H+]=10-4; КВ=[H+][OH-]=10-14
Отсюда находим [OH-]=КВ/[H+]=10-10
10-4>10-10ÞЮ[H+]>[OH=],ÞЮ раствор имеет кислую реакцию. Т.к. неудобно иметь дело с отрицательными степенями договорились степень кислотности растворов оценивать при помощи водородного покпзателя pH=-lg[H+]
нейтральный раствор pH=7
кислый раствор pH<7
щелочной рас-р pH>7
Сок лимона-2.1, черный кофе-5, дождевая вода-6.5, кровь здоровогочел-ка-7.4.
Индикаторы- это слабые органич-ие кислотыили основания, к-ые меняют окраску при изменении велечины pH.
Нинд««Н++инд - (лакмус, фенолфталеин)
индОН««инд++ОН-
DDрН для лакмуса=3ед(5¸ё8) или 2ед(6¸ё8) (красный окрас®®синий окрас)
Молекулы лакмуса – красные, ионы – синие. В кислоте равновесие смещается влево – к красному, в щелочи водород связывается, равновесие вправо к синему.
Фенолфталеин – кислота. Молекулы – бесцветные, а анион (инд-) емеет малиновый цвет). Если введем в рас-р щелочи, то за счет связывания катионов Н, получается малиновый цвет, в кислом рас-ре окрас бесцветный.
Наименование Инд |
кислота или основание |
интервал изменения рН |
изменение окраски |
метил-оранж |
основание |
3.1-4.4 |
красный-желтый |
метил-рот |
основание |
4.2-6.3 |
красный-желтый |
лакмус |
кислота |
5(6)-8 |
красный-синий |
ф-фталеин |
кислота |
8.3-9.8 |
бесцвет-малиновый |
тимолфталеин |
кислота |
9.8-10.5 |
бесцвет- синий |
Универсальный Инд-смесь целого ряда инд-оров.
