
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Полярная связь. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •19. Зависимость теплового эффекта реакции от температуры.
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •22. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •24. Принцип подвижного равновесия (принцип Ле-Шателье).
- •25. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •26. Молекулярность и порядок реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •30. Скорость гетерогенной химической реакции.
- •31. Катализ. Сущность гомогенного и гетерогенного катализа.
- •32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
- •33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •35. Законы Рауля.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •37. Константы диссоциации. Закон разведения.
- •38. Сильные электролиты. Понятие активности и коэффициента активности.
- •39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •40. Гидролиз солей.
- •41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •44. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •47. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •48. Законы Фарадея. Выход по току.
- •49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •50. Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
- •60. Произведение растворимости. Условия выпадения осадка.
1. Основные газовые законы. Определение молекулярных масс газообразных веществ.
2. Основные стехиометрические законы.
3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
7. Периодический закон Д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
9. Образование химической связи. Энергия связи и длина связи.
10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
11. Направленность ковалентной связи. Сигма и П-связи. Гибридизация атомных орбиталей.
12. Ионная (электронная) связь.
13. Полярная связь. Полярность молекул и их дипольный момент.
14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
15. Межмолекулярное взаимодействие. Водородная связь.
16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
19. Зависимость теплового эффекта реакции от температуры.
20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
22. Условия самопроизвольного протекания химических реакций.
23. Константа химического равновесия. Расчет Кр и Кс.
24. Принцип подвижного равновесия (принцип Ле-Шателье).
25. Скорость химической реакции. Закон действующих масс. Константа скорости.
26. Молекулярность и порядок реакции.
27. Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
28. Зависимость скорости реакции от температуры. Правило Ванг-Гоффа. Уравнение Аррениуса.
29. Энергия активации химической реакции. Аналитический и графический метод расчета.
30. Скорость гетерогенной химической реакции.
31. Катализ. Сущность гомогенного и гетерогенного катализа.
32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
35. Законы Рауля.
36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
37. Константы диссоциации. Закон разведения.
38. Сильные электролиты. Понятие активности и коэффициента активности.
39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах
40. Гидролиз солей.
41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
43. Медно-цинковый гальванический элемент. Процессы на электродах. ЭДС.
44. Зависимость ЭДС гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная ЭДС.
45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
47. Электролиз. Последовательность разряда ионов на катоде и аноде.
48. Законы Фарадея. Выход по току.
49. Химическая и полицентрационная поляризация при электролизе. Перенапряжение.
50. Классификация химических источников тока.
51. Коррозия металлов. Химическая и электрохимическая коррозия.
52. Основные методы борьбы с коррозией.
53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
56. Эвтектическая диаграмма плавкости(без образования твердых растворов).
57. диаграмма плавкости непрерывных твердых растворов. Правило «рычага».
58. диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
59. диаграмма плавкости бинарной системы с образованием химических соединений.
60. Произведение растворимости. Условия выпадения осадка.
Основные газовые законы. Определение молекулярных масс газообразных веществ.
Газовые законы - законы термодинамических процессов, протекающих в системе с неизменным количеством вещества при постоянном значении одного из параметров: закон Шарля, закон Гей-Люссака, закон Бойля-Мариотта, а также закон Авогадро, закон Дальтона.
Четыре первых закона
вытекают из общего уравнения
Менделеева-Клайперона
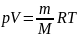 .
Необходимо помнить и об уравнении
Ван-дер-Ваальса, описывающем реальные
газы. Закон Авогадро - закон идеальных
газов, согласно которому в равных объемах
различных газов при одинаковой температуре
и давлении содержится одинаковое число
молекул. Закон Бойля-Мариотта - закон
идеальных газов, согласно которому для
данной массы данного газа при постоянной
температуре произведение давления на
объем есть величина постоянная. Закон
Бойля-Мариотта описывает изотермический
процесс. Закон Гей-Люссака - закон
идеальных газов, согласно которому
объем данного количества газа при
постоянном давлении прямо пропорционален
абсолютной температуре. Закон Шарля -
закон идеальных газов, согласно которому
давление данной массы идеального газа
при постоянном объеме прямо пропорционально
абсолютной температуре. Закон Дальтона
- физический закон, согласно которому
давление смеси химически не взаимодействующих
идеальных газов равно сумме парциальных
давлений этих газов. При постоянной
температуре растворимость в данной
жидкости каждого из компонентов газовой
смеси, находящейся над жидкостью,
пропорциональна их парциальному
давлению.
.
Необходимо помнить и об уравнении
Ван-дер-Ваальса, описывающем реальные
газы. Закон Авогадро - закон идеальных
газов, согласно которому в равных объемах
различных газов при одинаковой температуре
и давлении содержится одинаковое число
молекул. Закон Бойля-Мариотта - закон
идеальных газов, согласно которому для
данной массы данного газа при постоянной
температуре произведение давления на
объем есть величина постоянная. Закон
Бойля-Мариотта описывает изотермический
процесс. Закон Гей-Люссака - закон
идеальных газов, согласно которому
объем данного количества газа при
постоянном давлении прямо пропорционален
абсолютной температуре. Закон Шарля -
закон идеальных газов, согласно которому
давление данной массы идеального газа
при постоянном объеме прямо пропорционально
абсолютной температуре. Закон Дальтона
- физический закон, согласно которому
давление смеси химически не взаимодействующих
идеальных газов равно сумме парциальных
давлений этих газов. При постоянной
температуре растворимость в данной
жидкости каждого из компонентов газовой
смеси, находящейся над жидкостью,
пропорциональна их парциальному
давлению.
2. Основные стехиометрические законы.
1. Закон постоянства состава: в-во имеет постоянный состав независимо от способа его получения:
2H2+O2=2H2O и 4NH3+3O2=6H2O+2N. (состав H2O = const)
2.Закон эквивалентов: в-ва вступают в химическое взаимодействие и замещают друг друга в соединениях в весовых количествах пропорциональным химическим эквивалентам этих веществ.. Хим.эквивалент - это такое весовое кол-во в-ва, которое реагирует с 1.008 вес.част. H2 или 8 в.ч. О2.
3. Закон простых кратных отношений: если два элемента образуют несколько соединений, то на одно и тоже весовое кол-во одного элемента приходится такие весовые кол-ва др. Элемента, которые относятся между собой, как простые целые числа. Например, H20/H2O2 , CO/CO2, N2O/NO/N2O3/NO2/N2O4/N2O5.
Если в-во имеет молекулярную структуру (пар\газ\молек.крист.реш.) то все стехиометрические законы полностью выполняются, иначе - нет. Состав соединения зависит от условий получения.
3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
Эквивалентом называют условную или реальную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в ОВР. Эквивалентная масса элемента (вещества) определяется формулой Э=А/n, где А – масса одного моля элемента (вещества), n – его валентность. Закон химических эквивалентов – моль эквивалентов одного вещества реагирует с молем эквивалентов другого вещества.
