
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Полярная связь. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •19. Зависимость теплового эффекта реакции от температуры.
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •22. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •24. Принцип подвижного равновесия (принцип Ле-Шателье).
- •25. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •26. Молекулярность и порядок реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •30. Скорость гетерогенной химической реакции.
- •31. Катализ. Сущность гомогенного и гетерогенного катализа.
- •32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
- •33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •35. Законы Рауля.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •37. Константы диссоциации. Закон разведения.
- •38. Сильные электролиты. Понятие активности и коэффициента активности.
- •39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •40. Гидролиз солей.
- •41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •44. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •47. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •48. Законы Фарадея. Выход по току.
- •49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •50. Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
- •60. Произведение растворимости. Условия выпадения осадка.
13. Полярная связь. Полярность молекул и их дипольный момент.
Предположим, что мы имеем соединение АB, при этом взаимодействуют атомы A B с большим значением энергии сродства к электрону. ЭОa>ЭОb -> общая электронная пара в молекуле AB смещена от атома B к атому А. Электронейтральность нарушается, в молекуле появляются положительный и отрицательный полюса. Такая структура молекулы носит название полярная структура. Полярная молекула HCl. Связь в результате которой возникает полярная молекула носит название П.К.С. Очевидно чем больше расстояние между полюсами, тем ярче выражена полярная структура молекулы. 1) Cl2-чисто ков.связь, 2) НСl-полярная связь 3) NaCl-ионная связь. Вывод: любая химическая связь образованна электронными парами. Расположение электронных пар в молекуле опред. отн. ЭО атомов вступающих в связь. Если ЭО одинаковы, то электронные пары располагаются симметрично относит. атомов, вступивших в связь. Если ЭО неодинаковы, то электронная пара смещается к одному из атомов.(полярная связь) При низких различиях ЭО мы имеем ионную связь. (см.рис10) Полярная молекула – диполь. Основной характеристикой диполя является дипольный момент. µ=ē*l. l-плечо диполя, µ-характеризует напряженность электростатического поля, создаваемое диполем. ē~4,8*10**-10 эл.стат.ед. µ=D*10**-18. D-единица Дебая. Для полярных соединений µ=0-4 D, для ионных соединений µ=4ч11D(?), для ковалентных соединений µ=0.
14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
Является разновидностью ковалентной связи. Соединения первого порядка или валентно насыщенные соединения. H2O, AgCl, NH3, HCl, KJ, HgJ2, CuSO4, FeCl3 и т.д. Они могут давать соединения высшего порядка или комплексные соединения. 1)NH3+ HClàа [NH4]Cl, 2)AgCl+2NH3=[Ag(NH3)2]Cl, 3)CuSO4+4NH3= [Cu(NH3)4]SO4, 4)2KJ+HgJ2= K2[HgJ4], 5)FeCl3+6H2Oàа [Fe(H2O)6]Cl3. Комплексные соединения- соединения, которые образуются без возникновения новых электронных пар, а за счет проявления дон.-акц. связи. BF3+NH3àаBF3NH3, B-акцептор, N-донор. Общие св-ва ков. и дон.-акцепторных связей. Возникают за счет общих электронных пар. В случае ковалентной связи все участники равноправны (каждый участник дает по 1 электрону) , д-а (один участник дает электронную пару, другой – пустую орбиталь). [Cu(NH3)4]SO4. Cu-комплексообразователь, 4-координационное число. Внутри []- внутренняя сфера, за []-внешняя сфера, NH3-лиганды. Заряд внутри сферы представляет собой сумму зарядов центрального иона и заряда лиганд. В целом заряд нейтрален.
Существует 2 теории возникновения комплексных соединений. 1 – теория Полинга – на основе донорно-акцепторных связей, вторая – Бете – теория кристаллического поля, т.е. электростатического взаимодействия.
15. Межмолекулярное взаимодействие. Водородная связь.
Между валентно-насыщенными и в сумме электронейтральными молекулами вещества в различных агрегатных состояниях действуют силы притяжения и отталкивания, имеющие электростатическую природу. Относительная интенсивность этих сил во многом определяет физико-химические свойства вещества. Например, проявление сил отталкивания объясняет малую сжимаемость жидкостей и твердых тел. Силы притяжения лежат в основе таких явлений, как сжимаемость газов, адсорбция и т.д. Силы отталкивания есть результат взаимного отталкивания одноименно заряженных электронных оболочек. Силы отталкивания проявляются лишь на очень маленьких расстояниях и быстро убывают с увеличением расстояния. Eотт. =Ar-n , n=12 r - расстояние между молекулами. A и n - константы, характеризующие конкретное вещество. Часто силы межмолекулярного притяжения называют силами Ван-Дер-Ваальса, так как в газах и жидкостях мера взаимного притяжения определяется как a/V2 из уравнения Ван-Дер-Ваальса. Притяжение АА и ВВ – проявление когезии, АВ – адгезии. Различают
а) ориентационные силы
б) деформационные (индукционные)
в) дисперсионные силы.
a) ориентационные: они проявляются в случае, если молекула- ярко выраженный диполь. Такие молекулы стремятся расположиться упорядоченно: (+-) (-+) (+-) - уменьшение Eизб. В системе.
Еориент=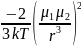
б)одна молекула полярна,
другая – легко поляризуема. Под действием
э.с. поля первой молекулы на 2 наводится
диполь и они взаимодействуют. Еинд=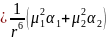
в) дисперсионное. Если молекулы не полярны, возникает так называемые мгновенные диполи. В случае многоатомных молекул в эл.оболочке в одних местах сгущение, а в других - разряжение электронов : на какой-то момент времени молекула - диполь. Дисперсионные силы суммируются. Это преобладающий вид взаимодействия. Eд= (3h12 *I1*I2) / (2r^6* (I1+I2) [I1 ,I2- потенциалы ионизации.
Ориентационное взаимодействие преобладает, если молекулы - яркие диполи. В общем виде:
Eпритяж.=-B*r-m , m=6.
Eсум. = Eпритяж.+Eотталк. = A*r-n -B*r-6. Эти силы действуют на расстояниях 3-5 A (10^-8 см.)
E ~ 0.4*10^-4 кДж/Моль
Водородная связь наблюдается при взаимодействии водорода с сильно электроотрицательными элементами – O, F, N, реже Cl, S. Природа водородной связи до конца не изучена, так как она характеризуется как межмолекулярным, так и электростатическим взаимодействием.
В молекуле воды (сильной диполи) атомы водорода практически лишены электронных оболочек – они почти протоны, что дает им возможность притягиваться к кислороду из другой молекулы. Возникают ассоциаты (H2O)x, где х зависит от температуры.
В случае возникновения водородной связи водород ведет себя как двухвалентный элемент. LO…H=1.76 ангстрем, lO-H (ковал)=0,96 ангстрем. Энергия водородной связи 20-40 кДж/моль.
Водородная связь объясняет т.н. аномальные свойства воды – макс плотность при 4С (в этом случае (H2O)2, максимально плотно упаковываются), макс теплоемкость – т.к. энергия нагрева идет на разрыв водородных связей.
