
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Полярная связь. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •19. Зависимость теплового эффекта реакции от температуры.
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •22. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •24. Принцип подвижного равновесия (принцип Ле-Шателье).
- •25. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •26. Молекулярность и порядок реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •30. Скорость гетерогенной химической реакции.
- •31. Катализ. Сущность гомогенного и гетерогенного катализа.
- •32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
- •33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •35. Законы Рауля.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •37. Константы диссоциации. Закон разведения.
- •38. Сильные электролиты. Понятие активности и коэффициента активности.
- •39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •40. Гидролиз солей.
- •41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •44. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •47. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •48. Законы Фарадея. Выход по току.
- •49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •50. Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
- •60. Произведение растворимости. Условия выпадения осадка.
47. Электролиз. Последовательность разряда ионов на катоде и аноде.
Электролиз – ОВ процесс, протекающий в растворе или расплаве при прохождении постоянного электрического тока.
Электролиз HCl:
К
(-)

А
(+)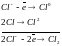
Последовательность катодных процессов. Процесс идет в направлении уменьшения потенциала.
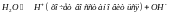
Металлы можно разбить на 3 группы:
1.
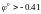 В,
ВСЕГДА восстанавливается на катоде.
В,
ВСЕГДА восстанавливается на катоде.
2.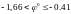 восстанавливаются вместе с водородом:
восстанавливаются вместе с водородом:
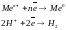
3.
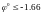 В,
НИКОГДА не восстанавливаются.
В,
НИКОГДА не восстанавливаются.

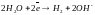 -
в нейтральной или кислой средах.
-
в нейтральной или кислой средах.
Последовательность анодных процессов.
А)с растворимым анодом, окисляется сам анод
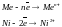
Б)угольные инертные электроды, процесс идет в порядке увеличение потенциала.
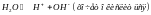
1)идет окисление бескислородных анионов кислот, за исключением Cl
2)кислородсодержащие ионы в водных растворах не окисляются (сильная ковалентная связь)
3)в случае отсутствия бескислородных ионов:
В
щелочном растворе

В
кислой, нейтральной среде

48. Законы Фарадея. Выход по току.
1. При электролизе данного электролита количество вещества, выделяющегося на электродах пропорционально количеству электричества.
2. При электролизе разных электролитов одинаковое количество электричества выделяет на электродах количество вещества, пропорциональное их эквиваленту.
3. При пропускании через электролит электричества в 1Ф=96493Кл на электродах выделяется 1 эквивалентная масса (1 моль-эквивалент)
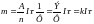 ,
где к – электрохимический эквивалент.
,
где к – электрохимический эквивалент.
Выход
по току:
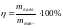
Удельный
расход энергии:
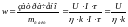
49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
В процессе электролиза всегда возникает некоторая разность потенциалов, направленная противоположно той, которая накладывается извне. Это явление носит название поляризации. Различают химическую и концентрационную поляризации.
Рассмотрим электролиз
раствора
 с платиновыми электродами. Для того,
чтобы газы – водород и кислород –
удалялись с электродов в виде пузырьков,
необходимо чтобы их парциальные давления
были больше 1 атм, в противном случае
удаление будет диффузным, т.е. очень
медленным.
с платиновыми электродами. Для того,
чтобы газы – водород и кислород –
удалялись с электродов в виде пузырьков,
необходимо чтобы их парциальные давления
были больше 1 атм, в противном случае
удаление будет диффузным, т.е. очень
медленным.
Для
этого необходимо приложить стандартную
ЭДС, отвечающую
 для реакции образования воды (
для реакции образования воды ( :
:
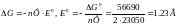
Если внешняя ЭДС меньше 1.23 В, то электролиз практически не идет из-за медленности удаления газов. Из-за адсорбции газов на электродах система начинает функционировать как водородно-кислородный гальванический элемент, ЭДС которого направлена навстречу внешней ЭДС. Данная поляризация обусловлена химическими изменениями на поверхности электродов и поэтому носит название химической.
Если
Евнешн>1.23, то
 ,
где Еп – ЭДС поляризации.
,
где Еп – ЭДС поляризации.
При малых значениях внешней ЭДС ЭДС поляризации также мала из-за частичной диффузии газов, поэтому ток всегда положителен. С ростом Евнешн растет и Еп до предельного значения в 1.23В, рост Евнешн не ограничен. На I-E кривой напряжение разложения – то наименьшее значение внешней ЭДС, при достижении которого начинается длительный электролиз (с выделением продуктов), а кривая резко поднимается.
В
силу необратимости ряда стадий электродных
процессов для электролиза серной кислоты
нужно приложить 1.7В. Перенапряжение
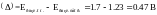
Перенапряжение – это разность между напряжением разложения, фактически необходимым для протекания электролиза в данной электрохимической системе, и ЭДС гальванического элемента, отвечающего этой системе.
Рассмотрим концентрационную поляризацию.
Два серебряных электрода помещены в раствор AgNO3. Без наложения внешней поляризации потенциалы электродов одинаковы. Концентрация потенциалообразующих ионов Ag+ в процессе электролиза у катода и анода будет различаться – у катода она меньше равновесной, у анода – больше. Возникает концентрационный элемент, ЭДС которого направлена навстречу внешней ЭДС. Это явление и называется К.П. Оно может быть существенно уменьшено простым перемешиванием раствора.
