
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Полярная связь. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •19. Зависимость теплового эффекта реакции от температуры.
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •22. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •24. Принцип подвижного равновесия (принцип Ле-Шателье).
- •25. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •26. Молекулярность и порядок реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •30. Скорость гетерогенной химической реакции.
- •31. Катализ. Сущность гомогенного и гетерогенного катализа.
- •32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
- •33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •35. Законы Рауля.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •37. Константы диссоциации. Закон разведения.
- •38. Сильные электролиты. Понятие активности и коэффициента активности.
- •39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •40. Гидролиз солей.
- •41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •44. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •47. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •48. Законы Фарадея. Выход по току.
- •49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •50. Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
- •60. Произведение растворимости. Условия выпадения осадка.
36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
Электролитическая диссоциация – процесс распада электролитов (кислот, оснований, солей) на ионы в воде. Степень диссоциации – это доля растворенного электролита, распавшаяся на ионы. По способности к диссоциации электролиты подразделяют на слабые и сильные. Процесс диссоциации слабых электролитов обратим. При дальнейшем разбавлении раствора слабого электролита степень диссоциации увеличивается.
Степень
диссоциации обычно определяют через
электропроводимость, удельную χ или
эквивалентную λ. χ обратна удельному
сопротивлению, составляет проводимость
кубика с ребром 1 см. зависимость χ от
разбавления χ=f(V0), где V0-т.н.
единичный объем, т.е. объем, в котором
растворена единица вещества
 .
χ сначала возрастает из-за увеличения
α, а затем уменьшается вследствие
уменьшения числа ионов при большом
разбавлении.
.
χ сначала возрастает из-за увеличения
α, а затем уменьшается вследствие
уменьшения числа ионов при большом
разбавлении.
λ
– электропроводимость такого объема
раствора, в котором содержится 1г
эквивалента вещества. Суммарная
электропроводность n параллельно
включенных кубиков
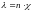
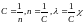
λ
увеличивается до некой предельной
величины, когда α=1, при этом предельное
значение λпред носит название
электропроводимость при бесконечном
разбавлении
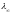 .
Таким образом для слабых электролитов
.
Таким образом для слабых электролитов
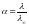
37. Константы диссоциации. Закон разведения.
Константа диссоциации – константа равновесия процесса диссоциации.

 где
См – концентрация недиссоциированных
молекул электролита.
где
См – концентрация недиссоциированных
молекул электролита.
Изотерма
диссоциации:

Для
стандартных условий
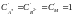 ,
,

Константа диссоциации в одном и том же растворителе при постоянной температуре – величина постоянная, она характерна данному электролиту. Степень же диссоциации α характеризует состояние электролита в растворе данной концентрации и меняется с её изменением.
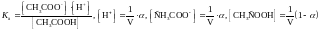
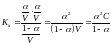
Для
слабого электролита
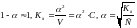 -
закон разведения Освальда.
-
закон разведения Освальда.
Связь
между Кд и λ:
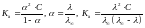
Электролиты: α>0.7 – сильные, 0.3<α<0.7 – средние, α<0.3 – слабые.
38. Сильные электролиты. Понятие активности и коэффициента активности.
Состояние сильных э-литов в р-ре. Истинная степень диссоциации в р-рах сильных э-литов примерно равна 1. В р-рах сильных э-литов действуют мощные электростатические силы между ионами. Возникновение ионных атмосфер.
Каждый ион внутри сферы является центром своей ионной атмосферы. Измерение диссоциации через степень электропроводимости. При пропускании тока центральный ион тащит за собой ионы противоположного знака, что тормозит его перемещение отсюда и снижение электропроводности, а следовательно снижение диссоциации. Кажущаяся степень диссоц. При разбавлении р-ра каж. степень увеличивается за счет увеличения промежутков между ионами, след уменьшается электростатич. Действие. Для р-ров сильных э-литов введено понятие активности/активной концентрации. Если взять т/динамич. ур-я, описывающую идеальную систему и вместо концентрации использовать активности, то можно ур-я идеальных систем использовать для реальных систем. Т.о. активность учитывает все виды взаимодействия между ионами. В качестве стандартного – принимают состояние полной диссоциации, при отсутствии осложняющего воздействия ионов друг на друга.
а- активная концентрация
γ-коэффициент активности
с-концентрация [грамм-ион/литр]
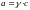
при
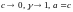 при
концентрации
при
концентрации
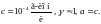
в
более концентрированных растворах

