
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Полярная связь. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •19. Зависимость теплового эффекта реакции от температуры.
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •22. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •24. Принцип подвижного равновесия (принцип Ле-Шателье).
- •25. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •26. Молекулярность и порядок реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •30. Скорость гетерогенной химической реакции.
- •31. Катализ. Сущность гомогенного и гетерогенного катализа.
- •32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
- •33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •35. Законы Рауля.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •37. Константы диссоциации. Закон разведения.
- •38. Сильные электролиты. Понятие активности и коэффициента активности.
- •39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •40. Гидролиз солей.
- •41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •44. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •47. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •48. Законы Фарадея. Выход по току.
- •49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •50. Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
- •60. Произведение растворимости. Условия выпадения осадка.
53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
Кристаллическое состояние характеризуется дальним порядком, т.е. трехмерной периодичностью структуры по всему объему твердого тела. Регулярное расположение частиц в твердом теле изображается в виде решетки, в узлах которой находятся те или иные частицы, соединенные воображаемыми линиями.
Деление химической связи на типы носит условный характер. Для металлической связи характерны некоторые признаки ковалентной, если принять во внимание перекрывание атомных орбиталей атомов. В образовании водородной связи, помимо электростатического взаимодействия, не последнюю роль играет ДА характер взаимодействия.
В реальных веществах в чистом виде типы связей не встречаются, поэтому возможен переход между всеми типами – ионной, ковалентной, металлической и остаточной связью.
54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
Правило фаз Гиббса – число степеней свободы С, фаз Ф, независимых компонентов К и внешних условий n, влияющих на равновесие, связаны соотношением С+Ф=К+n
В основе метода ФХА лежит изучение свойств равновесной системы, зависимости ее от параметров состояние. Эти зависимости получают в виде диаграммы состав-свойство и (или) состав-температура. В методе ФХА широко используется изучение зависимости температуры кристаллизации или плавления от состава. Получают кривые охлаждения. Для этого охлаждают расплавы веществ и их смесей и наблюдают изменение во времени.
Метод ФХА заключается в изучении зависимости между свойствами двух многокомпонентных систем и их параметрами.
2 основных принципа ФХА (Курнаков):
1) принцип непрерывности. При непрерывном изменении параметров состояния свойства отдельных фаз системы изменяются также непрерывно. Свойства системы в целом изменяются непрерывно до тех пор, пока не изменится число или характер фаз.
2) принцип соответствия. Каждой совокупности фаз, находящихся в равновесии в данной системе отвечает на диаграмме состояния (например плавкости) определенный геометрический образ.
Диаграмма состояния воды. Области между кривыми – однофазные (с=2), кривые соответствуют состоянию равновесия (с=1) ОС – равновесие процесса кипения. Кривая ОС оканчивается критической точкой. Вода выше критической точки переходит в сверхкритическое состояние, свойства между жидкостью и газом. ОВ – кривая плавления, ОА – процесс сублимации (перехода из твердого в газообразное минуя жидкое), ОД – поведение воды в неустойчивом состоянии. Точка О – тройная точка, точка общего равновесия (610 Па, 275.5 К)
55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
Сущность ТГА – снятие кривых охлаждения. Характерные точки – точки начала и конца кристаллизации. По геометрическому образу судят об изменениях в системе.
60. Произведение растворимости. Условия выпадения осадка.
Произведение ионов активностей электролита, содержащихся в его насыщенном растворе, есть величина постоянная. Это величину называют произведением растворимости электролита, обозначают ПР. ПР зависит от природы растворенного вещества.
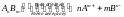
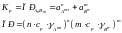 ,
где γ – коэфф активности.
,
где γ – коэфф активности.
Условия выпадения осадка:
