
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Полярная связь. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •19. Зависимость теплового эффекта реакции от температуры.
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •22. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •24. Принцип подвижного равновесия (принцип Ле-Шателье).
- •25. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •26. Молекулярность и порядок реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •30. Скорость гетерогенной химической реакции.
- •31. Катализ. Сущность гомогенного и гетерогенного катализа.
- •32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
- •33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •35. Законы Рауля.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •37. Константы диссоциации. Закон разведения.
- •38. Сильные электролиты. Понятие активности и коэффициента активности.
- •39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •40. Гидролиз солей.
- •41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •44. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •47. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •48. Законы Фарадея. Выход по току.
- •49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •50. Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
- •60. Произведение растворимости. Условия выпадения осадка.
11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
Перекрывание электронных облаков при образовании ковалентных связей возможно только при определенной их ориентации в пространстве – отсюда направленность ковалентных связей, приводящая к той или иной стереохимии молекул, т.е. к определенной их форме.
1)AA, BB. Этот тип молекул характерен для Н2 (сигма-связь), галогенов, и соединений Н с галогенами. Молекулы водорода имеют линейную структуру. Химическая связь действует по кратчайшему расстоянию, связывая атомы сигама-связью.
2)А2В. Этот тип характерен для соединений, образованных элементами главной подгруппы 6-ой группы: Н2О, Н2S.(см.рис) ( Н2О – угол –1050, Н2S – 920 35’) Максимальная плотность возникает при темп.=4 градуса цельсия.
3)А3В. Элементы главной подгруппы 3 группы(N,P,As,Sb). NH3 – тетраэдр.
4)А4В Главная подгруппа 4 группа(Si,C,Ge,Sn). СН4 – электроны последнего уровня углерода – s2p2. После возбуждения - sp3. Гибридизация электронных облаков. s2p2 ®® sp3 ®® q4 Гибридизация требует затрат энергии, но эта энергия компенсируется при протекании реакции образования связи. Все связи энергетически равноценны.
5)АВ3 – характерно для соединений гл. подгруппы 3-ей группы.(B,Al,Ga,In,Tl) BCl3. s2p ®® sp2 ®® q3.
6)АВ2 –для некоторых соединений, образованными элементами главной подгруппы 2 группы. ВеCl2 (линейная структура, угол – 1800). sp ®®spàа q2 d2 sp3 ®® q6.
Если в молекуле имеется кратная связь между атомами (двойная и тройная), то только одна связь является прочной - сигма-связь. Видно на примере этилена. S2p2->sp3->sp2p->q3p – неполная гибридизация. Поскольку сигма связи действуют по кратчайшему расстоянию, повышенная электронная плотность оказывается в области между ядрами, за счет чего происходит стягивание ядер. В случае пи-связи повышенная плотность возникает вдали от межъядерной линии, дополнительное стягивание не возникает.
Гибридизация: sp- 180 (ZnCl2), sp2,dp2,sd2-120 (BCl3,AlF3), sp3,sd3 109.28(CH4,SiH4),
Dsp2-плоский
квадрат – 90 ( ),
dsp3-триагональная
бипирамида – 90, 120 (PF5),
d2sp3
– 90 – октаэдр (SF6,
),
dsp3-триагональная
бипирамида – 90, 120 (PF5),
d2sp3
– 90 – октаэдр (SF6,
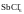 ),
d4sp3
– додекаэдр (
),
d4sp3
– додекаэдр ( )
)
12. Ионная (электронная) связь.
Ионная связь – такая связь, при которой преобладают электростатические взаимодействия между атомами. И.с. возникает между элементами, которые значительно отличаются по величинам электроотрицательности. (NaCl: Na – e -> Na+ ; Cl + e -> Cl- ; Na+ + Cl- -> NaCl
Ионы натрия и хлора сближаются, пока силы притяжения не компенсируются силами отталкивания одноимённых зарядов электронных оболочек. Ионы занимают в пространстве строго определённое место. Если взаимодействуют тв. Na и г. Cl, то образуется твердокристаллическая решётка NaCl. Если взаимодействие происходит в растворе – ионы Na и Cl – в сольватированном виде (в сл. воды – в гидротированном). Вокруг ионов образуется оболочка растворителя. При кристаллизации из раствора образуется кристаллическая решётка. Валентность атомов в соединениях определяется по числу потерянных или приобретённых электронов. Координационное число показывает сколько ионов противоположного знака в растворе ион данного знака (к.ч. Na=6, к.ч. Cl=6). Понятие молекулы не применимо в случае ионной связи. Весь кристалл представляет собой одну гигантскую молекулу. Соединений с чисто ионной связью не существует (имеет место определённая ковалентность). Электростатическое взаимодействие очень мощное. Это объясняет высокую прочность соединений с ионной связью, высокую температуру плавления и кипения. Соединения с ионной связью – проводники второго рода.
