
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Полярная связь. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •19. Зависимость теплового эффекта реакции от температуры.
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •22. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •24. Принцип подвижного равновесия (принцип Ле-Шателье).
- •25. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •26. Молекулярность и порядок реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •30. Скорость гетерогенной химической реакции.
- •31. Катализ. Сущность гомогенного и гетерогенного катализа.
- •32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
- •33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •35. Законы Рауля.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •37. Константы диссоциации. Закон разведения.
- •38. Сильные электролиты. Понятие активности и коэффициента активности.
- •39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •40. Гидролиз солей.
- •41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •44. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •47. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •48. Законы Фарадея. Выход по току.
- •49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •50. Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
- •60. Произведение растворимости. Условия выпадения осадка.
42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
В электрохимии электродом называется проводник первого рода, погруженный в раствор электролита в условиях прохождения через него тока.
В
объеме металла имеем подвижное равновесие:
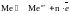
На
электроде имеем:
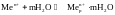
Поверхность электрода заряжается отрицательно за счет оставшихся на нем электроном, вследствие чего перешедшие в раствор гидратированные катионы не могут отойди от электрода и остаются вблизи него, образуя в совокупности с электронами т.н. двойной электрический слой. Пограничный слой жидкости заряжается положительно, металл – отрицательно, получается конденсатор. Возникает скачок электрических потенциалов – электродный потенциал.
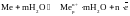
Толщина двойного слоя зависит от концентрации, температуры, заряда металла, колеблясь от нескольких ангстрем до микрона. Переход ионов металла в раствор – окисления, обратный процесс превращения гидратированных ионов металла в атомы – восстановление. Потенциал, отвечающий состоянию равновесию, когда скорость восстановления равна скорости окисления, называют равновесным потенциалом.
При погружении любого металла в воду имеем качественно одно и то же – металл заряжается отрицательно, жидкость вокруг – положительно.
При помещении активного и неактивного металла в растворы их солей активный заряжается отрицательно, а неактивный – положительно.
43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
При разомкнутой внешней цепи электроды приобретают равновесные потенциалы, которые отличаются и по знаку и по велечине.
Ме+mH2O <-> Men+ + nH2O + nē (1)
Замыкаем внешнюю цепь на сопротивление. ē – ы идут от Zn k Cu. Равновесие (1) на Zn-ом электроде нарушилось. Для того, чтобы равновесие восстановилось, Zn-ый электрод начинает растворяться, при этом в раствор переходят ионы цинка. Электроны, приходящие на медный электрод, восстанавливают медь. В рез-те этого процесс равновесия (1) тоже нарушается. Чтобы равновесие восстановилось, из глубины рас-ра к Cu поступают новые порции катионов меди:
(-) Zn-> Zn2+ + 2 ē (окислитель)
(+) Cu2++ 2 ē->Сu0
Zn+Cu2+<->Zn2++Cu0
Zn+CuSO4<->ZnSO4+Cu
Поскольку в левом отделении увеличивается концентрация катионов Zn, в этом отделении будет наблюдаться недостаток анионов SO4. В правом отделении за счет ухода катионов меди наблюдается избыток анионов SO4. Избыточные анионы SO4 через пористую перегородку проходят в левую часть. Цепь замыкается.
Гальванический элемент – это любое устройство, позволяющее получить электрический ток за счет проведения в этом устройстве химической реакции. Гальваническая цепь – это последовательная совокупность скачков потенциалов на границах раздела фаз. Причиной возникновения эл. тока является разность потенциалов на электродах. MAX разность потенциалов, отвечающая обратимому протеканию процесса называется ЭДС элемента, E.
φ4
(-) Zn ¦ZnSO4¦CuSO4 ¦Cu (+)
φ1 φ2 φ3
E= φ1 + φ2 + φ3 + φ4 (алгебраическая сумма скачков потенциалов на границе раздела фаз)
В электрохимии почти 100 лет шел спор о том, какие скачки потенциала определяют величину ЭДС. Физики: φ4 –основная роль. Химики: φ1 и φ 3 т.к. на величину ЭДС влияет изменение концентрации электролитов. В 1954г. было доказано, что они одинаково важны.
