- •Опорні лекції розділу Динамічна біохімія
- •Лекція №1. Загальні уявлення про обмін речовин і енергії
- •Суттєві ознаки обміну речовин у живих організмах:
- •Типи метаболічних реакцій
- •Шляхи використання енергії організмом:
- •Перетворення адф на атф
- •Проміжний метаболізм
- •Проміжний метаболізм
- •Лекція 2. Ферменти Основні питання:
- •Будова активного центру ферментів
- •Ферментативний аналіз
- •Лекція №3. Механізми перетворення поживних речовин у травному тракті
- •Основні перетравлювальні процеси
- •Сік підшлункової залози (підшлунковий або панкреатичний сік);
- •Сік, що виробляється клітинами печінки (жовч);
- •Сік, що виробляється слизовою оболонкою самої кишки (кишковий сік).
- •Білковий обмін
- •Білковий обмін: загальні відомості
- •Етапи розщеплення білків:
- •Процеси перетворення амінокислот і білків у товстій кишці
- •Гниття білків
- •Отруйні речовини
- •Шляхи розщеплення білків:
- •Біогенні аміни та реакції декарбоксилювання
- •Шляхи перетворення амінокислот в печінці
- •Лекція 5. Обмін вуглеводів
- •Розкладання вуглеводів у тканинах організму людини
- •Біосинтез вуглеводів в організмі
- •Лекція 6. Обмін ліпідів. Взаємозв’язок між різними процесами обміну речовин
- •Метаболізм жирів
- •Обмін нуклеїнових кислот
- •Взаємозв’язок між обміном вуглеводів і ліпідів:
- •Взаємозв’язок між обміном вуглеводів і білків:
- •Взаємозв’язок між обміном білків і ліпідів:
Ферментативний аналіз
Ферментативний аналіз, як принцип, вільний від недоліків і помилок, оскільки він представляє систему для вимірювань, яку успішно використовує жива клітина впродовж мільйонів років.
(Г.Бергман – засновник ферментативного аналізу)
Ферментативний аналіз – один з основних аналітичних інструментів у міжнародній та вітчизняній практиці наукових досліджень, сучасного виробничого та сертифікаційного контролю якості продуктів харчування, харчової сировини та біологічних матеріалів.
Ферментативний аналіз – складова частина ензимології та аналітичної хімії, використовується для специфічного визначення речовин за допомогою високо очищених препаратів ферментів.
В основі ферментативного аналізу лежать природні біохімічні процеси обміну речовин: реакція ферменту з субстратом, причому досліджувана речовина проби виступає як субстрат.
Переваги застосування ферментативних методів аналізу:
специфічність, що забезпечує високу достовірність результатів;
Специфічність дії ферментів базується на компліментарності. При розробці методів ферментативного аналізу окремих компонентів продуктів харчування як правило використовують декілька ферментів, які послідовно функціонують в даній системі.
висока чутливість;
Дозволяє визначати слідові кількості речовин. У продуктах харчування можуть бути виявлені наступні концентрації компонентів (г/л): етанол – 0,001; ацетальдегід – 0,001; лимонна кислота – 0,002; гліцерин – 0,001; D-глюкоза – 0,002; D-сорбіт – 0,001; лактоза – 0,005; нітрати – 0,001.
прості способи підготовки проб, які виключають втрату досліджуваного компоненту;
Використовують наступні способи підготовки проб: розведення, фільтрування (центрифугування), нейтралізація (підкислення), екстракція, знежирення, освітлення, знебарвлення. При абсолютній специфічності ферменту до досліджуваної речовини та при відсутності будь-яких заважаючи речовин використовують прямий аналіз проби без її попередньої підготовки.
універсальність застосування, висока точність;
швидка та проста процедура вимірювань, що не потребує використання дуже дорогого обладнання;
У більшості визначень використовують фотометричні способи вимірювання результатів аналізу. З цією метою всі компоненти штучної тестової системи (буфер, коферменти, активатори, допоміжні ферменти, проба) змішують у фотометричній кюветі. Після вимірювання початкової оптичної густини додають стартовий фермент, який ініціює реакцію. В кінці реакції повторно вимірюють оптичну густину тестової системи. За законом Бугера-Ламберта-Бера обчислюють концентрацію досліджуваного компонента.
Для проведення ферментативного аналізу використовується стандартне обладнання: спектрофотометри и фотометри з інтервалом вимірювань від 325 до 800нм; кювети для фотометричних вимірювань, мірні піпетки та дозатори, терези, центрифуга, рН-метр, водяний термостат, фільтри.
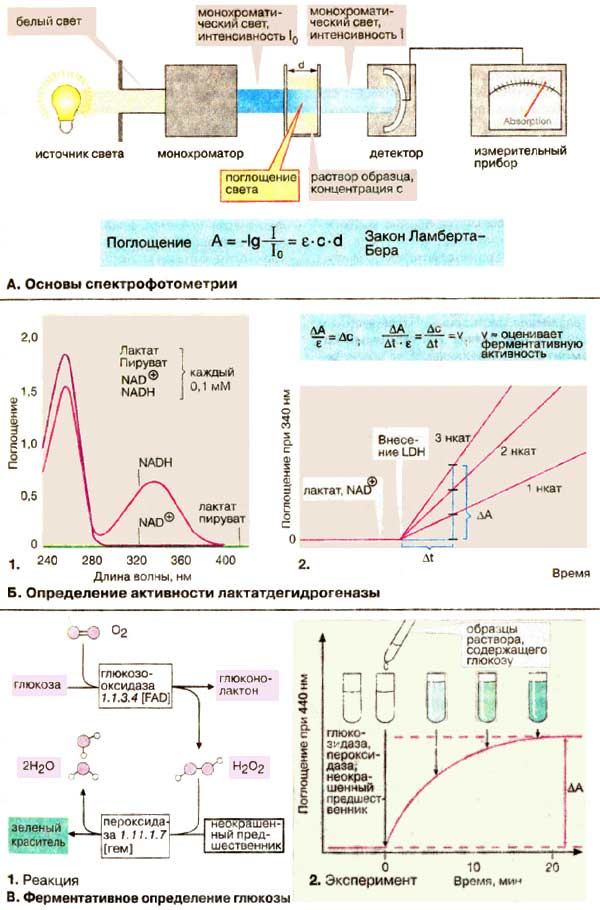
Основи спектрофотометрії Молекули поглинають світло у видимій або ультрафіолетовій областях спектра, що використовуються для визначення концентрації речовини. Величина поглинання залежить від типу та концентрації речовини, від довжини хвилі використаного світла. Використовують монохроматичне світло (світло певної довжини хвилі, що виокремлюють із білого світла монохроматором). Монохроматичне світло інтенсивності I0 проходить через скляну (кварцеву) кювету з розчином досліджуваної речовини. Інтенсивність I світла, що виходить з кювети, ослаблений поглинанням, вимірюється за допомогою детектора. Поглинання світла (А) розчину (оптична густина) визначається як негативний логарифм відношення I / I0. |
|
використання безпечних реактивів;
низькі затрати на проведення аналізу.
Ф
 ерментативні
методи аналізу широко застосовуються
для аналізу харчових кислот в продуктах:
ерментативні
методи аналізу широко застосовуються
для аналізу харчових кислот в продуктах:
виробничого контролю;
системи забезпечення якості готової продукції;
контролю сировини;
оцінки гігієнічного статусу;
аналізу складу з метою встановлення харчових властивостей та їх відповідності нормативним документам;
виявлення небажаних компонентів;
встановлення фальсифікації;
визначення частки натуральної сировини;
в
 изначення
автентичності.
изначення
автентичності.
Визначення активності лактатдегідрогенази Визначення активності лактатдегідрогенази [ЛДГ (LDH)] базується на тому, що відновлений кофермент НАДН + H+ поглинає світло при 340 нм, проте НАД+ (NAD+ ) за цієї довжини хвилі не поглинає світло. Різниця у поглинанні НАД+ и НАДН між 300 та 400 нм обумовлені змінами никотинамідного кільця при окисленні або відновленні. Для визначення активності в кювету вміщують розчини лактату і НАД+ та реєструють поглинання світла при довжині хвилі 340нм. Некаталітична реакція відбувається дуже повільно. Тому вимірювані кількості НАДН утворюються тільки після додавання ЛДГ. Так як швидкість зростання поглинання ΔA/Δt за законом Ламберта-Бера пропорційна швидкості реакції Δc/Δt, активність ЛДГ можна обчислити за значенням коефіцієнту екстинкції ε при 340 нм або порівнянням зі стандартним розчином. |
|
Більшість біомолекул не поглинають світло у видимій або ультрафіолетовій областях спектра. Крім того, вони наявні у суміші з іншими сполуками, які також дають аналогічні хімічні реакції. Використовуючи потрібний фермент можна вибірково перевести досліджуваний метаболіт у забарвлену сполуку, концентрацію якої визначають за величиною інтенсивності поглинання світла.
Визначення глюкози Метод визначення глюкози в крові оснований на двох послідовних реакціях: 1) утворення глюконолактону і пероксиду водню H2O2 під дією ферменту глюкозооксидази; 2) окислення безбарвної речовини пероксидом водню у забарвлену в зелений колір сполуку в реакції, що каталізується пероксидазою. Коли вся глюкоза, що міститься в пробі, витрачена, кількість утвореної забарвленої речовини можна визначити за світлопоглинанням, яке прямо пропорційно початковому вмісту глюкози. |
|
На всіх етапах переробки зерна у борошно, в процесі його зберігання, а також при виготовленні тіста та випіканні хліба, по різному виявляється активність гідролітичних і окислювальних ферментів, що суттєво впливає на якість готового продукту.
У зерні ферменти містяться в тканинах зародка, алейронового шару і ендосперму. Це характерні для живих рослинних клітин ферменти, що обумовлюють специфічні функції в процесах обміну речовин. Ферменти, які впливають або можуть впливати на якість продуктів переробки зерна: амілази, протеази, ліпази, ліпоксигенази, поліфенолоксидази та інші.
Амілази мають велике біологічне значення при дозріванні та пророщуванні зерна, а також в ряді технологічних процесів харчових виробництв, в основі яких лежать гідролітичні перетворення крохмалю під впливом амілаз зерна.
У зерні злакових культур містяться два специфічні ферменти, що спричиняють гідроліз крохмалю, зокрема:
1,4 ‑ глюкангідролаза або αα-амілаза, гідролізує α-1,4-глюканові зв'язки крохмалю та споріднених йому полісахаридів, причому ці зв'язки розриваються безладно;
1,4 ‑ глюканмальтогідролаза або αβ ‑ амілаза, гідролізує α-1, 4 ‑ глюканові зв'язки в полісахаридах, послідовно відщеплюючи залишки мальтози від нерудукованих рештків ланцюгів.
Під впливом протеаз відбуваються розрідження клейковини, що, у свою чергу, спричиняє погіршення якості хліба.
Ліпази спричиняють гідроліз жирів, тобто розщеплюють складні ефіри гліцерину з утворенням вільних жирних кислот, в результаті чого підвищується кислотність зерна і борошна.
За участю ліпоксигеназ відбувається окислення ненасичених жирних кислот, утворюються низькомолекулярні карбонільні і карбоксильні сполуки з неприємним запахом і гіркуватим присмаком. Цей процес називають прогірканням жирів (борошна).
Деякі ферменти зерна можуть слугувати хорошими індикаторами його фізіологічного стану. Наприклад, каталаза, є дуже термолабільною, ілюструє зменшення схожості при висушуванні зерна. Визначення активності каталази використовується для контролю процесу сушіння.
Фермент каталаза (клас оксиредуктаз) відіграє важливу роль у життєдіяльності організмів, розкладає отруйний для клітин пероксид водню, що утворюється в процесі дихання згідно рівняння хімічної реакції: 2Н2О2 → 2Н2О + О2
Кількісне визначення каталази базується на визначенні вмісту пероксиду водню шляхом титрування робочим розчином перманганату калію.
Хімічна реакція:
2KMnO4 + 5H2O2 + 4H2SO4 → 2KHSO4 + 2MnSO4 + 8H2O + 5O2
Про кількість пероксиду водню, що був розкладений ферментом, судять за різницею кількостей 0,1 моль/дм3 розчину КМnО4, витрачених на титрування в контрольному і робочому дослідах.