- •Опорні лекції розділу Динамічна біохімія
- •Лекція №1. Загальні уявлення про обмін речовин і енергії
- •Суттєві ознаки обміну речовин у живих організмах:
- •Типи метаболічних реакцій
- •Шляхи використання енергії організмом:
- •Перетворення адф на атф
- •Проміжний метаболізм
- •Проміжний метаболізм
- •Лекція 2. Ферменти Основні питання:
- •Будова активного центру ферментів
- •Ферментативний аналіз
- •Лекція №3. Механізми перетворення поживних речовин у травному тракті
- •Основні перетравлювальні процеси
- •Сік підшлункової залози (підшлунковий або панкреатичний сік);
- •Сік, що виробляється клітинами печінки (жовч);
- •Сік, що виробляється слизовою оболонкою самої кишки (кишковий сік).
- •Білковий обмін
- •Білковий обмін: загальні відомості
- •Етапи розщеплення білків:
- •Процеси перетворення амінокислот і білків у товстій кишці
- •Гниття білків
- •Отруйні речовини
- •Шляхи розщеплення білків:
- •Біогенні аміни та реакції декарбоксилювання
- •Шляхи перетворення амінокислот в печінці
- •Лекція 5. Обмін вуглеводів
- •Розкладання вуглеводів у тканинах організму людини
- •Біосинтез вуглеводів в організмі
- •Лекція 6. Обмін ліпідів. Взаємозв’язок між різними процесами обміну речовин
- •Метаболізм жирів
- •Обмін нуклеїнових кислот
- •Взаємозв’язок між обміном вуглеводів і ліпідів:
- •Взаємозв’язок між обміном вуглеводів і білків:
- •Взаємозв’язок між обміном білків і ліпідів:
Перетворення адф на атф
Проміжний метаболізм
Проміжний метаболізм
Ряд основних метаболічних шляхів є спільним для більшості клітин і організмів.
Проміжний метаболізм ‑ шляхи в результаті яких відбувається синтез, руйнування і взаємоперетворення найбільш важливих метаболітів, а також накопичення хімічної енергії.
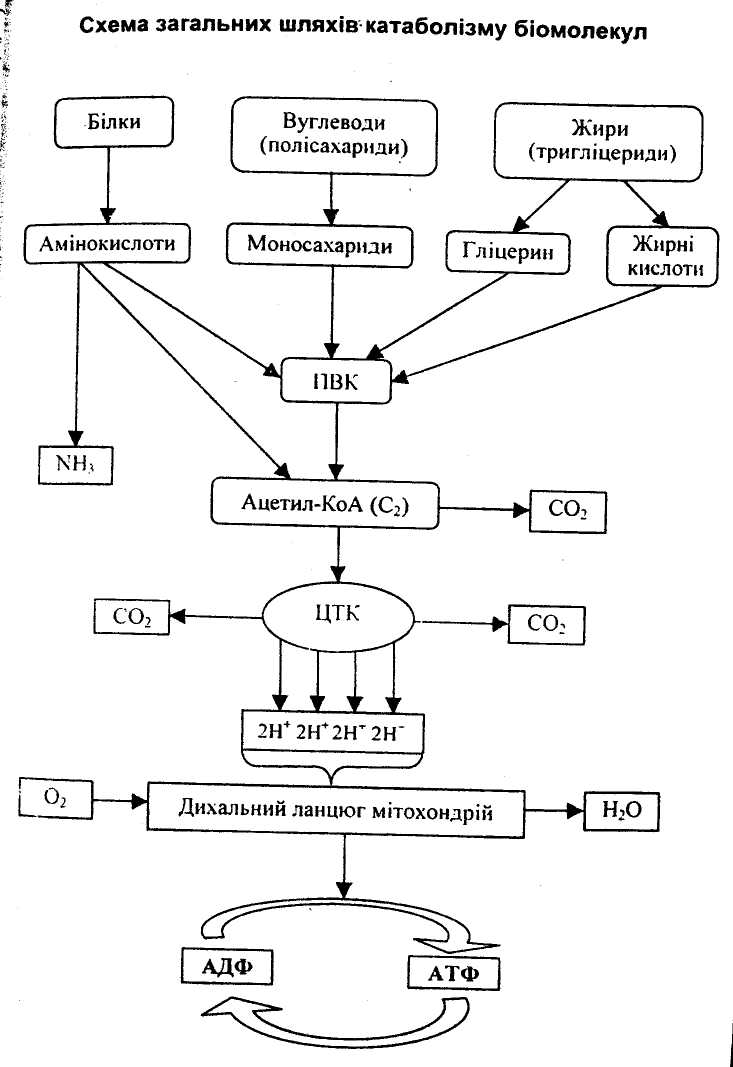
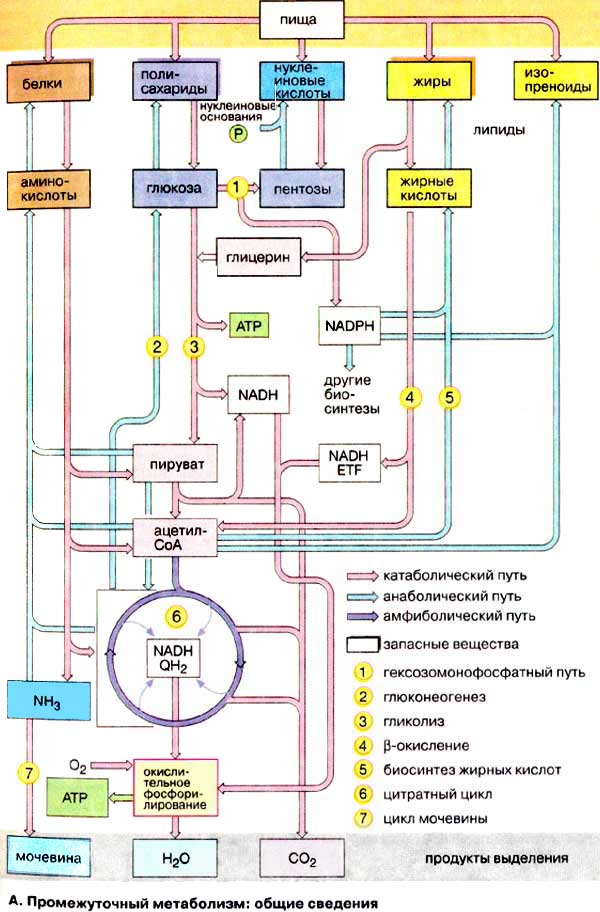
Живі клітини постійно потребують органічних і неорганічних речовин, а також хімічної енергії, яку вони отримують переважно з АТФ. Так як більша частина цих харчових речовин (білки, вуглеводи, нуклеїнові кислоти та ліпіди) не могуть утилізуватися безпосередньо, вони спочатку руйнуються на менші фрагменти катаболічниим шляхом (на схемі червоні стрілки). Утворені метаболіти (у сукупності їх називають «пулом метаболітів»), потім руйнуються із вивільненням вільної енергії або використовуються в анаболічних шляхах (голубі стрілки) для синтезу більш складних молекул.
Три найбільш важливі метаболіти ‑ піруват, ацетил-КоА та гліцерин ‑ пов’язують метаболізм білків, вуглеводів і ліпідів.
До метаболічного пулу належать також проміжні метаболіти цитратного циклу (6) – амфіболічний шлях. Кінцевими продуктами руйнування органічних речовин в тваринних організмах є діоксид вуглецю (CO2), вода (H2O) та аміак (NH3). Аміак перетворюється на сечовину і в такій формі виводиться з організму.
Найбільш важливою формою накопичення хімічної енергії в клітинах є аденозинтрифосфат (АТФ). На утворення АТФ повинна витрачатися енергія, тобто реакція є ендергонічною. В той же час при розщепленні АТФ до АДФ і фосфат вивільняється вільна енергія. За рахунок екзергонічного гідролізу АТФ забезпечує енергетичне спряження (для здійснення енергозалежних (ендоергічних) процесів ‑ більшість анаболічних шляхів, а також процеси руху та перенесення.
Найбільш важливий шлях синтезу АТФ ‑ окислювальне фосфорилювання. В цьому процесі електрони переносяться з відновлених коферментів, утворених в процесах катаболізму, на атом кисню. Такі екзергонічні процеси катаболізму непрямим способом використовуються для синтезу АТФ.
Більшість організмів могуть в анаеробних умовах, тобто у відсутності кисню, отримувати АТФ за рахунок гліколізу (3). Цей менш ефективний спосіб синтезу АТФ ‑ бродіння.
В окислювальному фосфорилюванні використовується тільки НАДН (NADH), а хімічно подібний кофермент НАДФН + Н+ (NADPH) слугує відновником в анаболічних шляхах. НАДФН + Н+ утворюється переважно в гексозомонофосфатному шляху.
Лекція 2. Ферменти Основні питання:
Хімічна природа ферментів. Номенклатура та класифікація ферментів.
Механізм дії ферментів.
Активність ферментів, вплив на неї різних факторів.
Використання ферментів. Ферментативний аналіз.
Ферменти ‑ біологічні каталізатори білкової природи, які утворюються будь-якою живою клітиною та здатні активізувати різноманітні хімічні сполуки. На сьогодні відомо близько 2тис. ферментів.
Організована послідовність процесів обміну можлива лише за умови, що кожна клітина забезпечена особистим генетично заданим набором ферментів. Тільки за цієї умови відбувається узгоджена послідовність реакції (метаболічні шляхи). Ферменти беруть участь також у регуляції багатьох метаболічних процесів, забезпечуючи тим самим відповідність обміну речовин зміненим умовам. Більшість ферментів ‑ білки. Відомі також каталітично активні нуклеїнові кислоти — «рибозими».
За хімічною будовою ферменти класифікують на:
Однокомпонентні ферменти, ферменти-протеїни (прості ферменти): складаються тільки з поліпептидних ланцюгів, при гідролізі розщеплюються до амінокислот, каталізують процеси гідролізу. Належать ферменти, які складаються тільки з каталітично активного білка. Роль активних груп виконують певні хімічні групування, що входять до складу білка (каталітичні центри, активні центри). Приклади: пепсин, трипсин, рибонуклеаза, уреаза, естераза печінки.
Двокомпонентні ферменти, ферменти-протеїди (складні ферменти): складаються з білкової частини (апофермент) і небілкового компоненту – кофактор.
Якщо небілковий компонент тісно пов’язаний з білком і відокремлюється тільки при дії денатуруючих факторів – простетична група. Якщо група небілкової природи (кофактор) сполучена з білковою частиною ферменту слабкими електростатичними або Ван-дер-ваальсівськми силами, то вона називається кофермент. Основними коферментами є НАД+, ФАД, КоА.
Каталітичну дію окремо не виявляють ні апофермент, ні кофермент. Каталітичну дію демонструє тільки комплекс (холофермент) – молекула ферменту.
Апофермент зумовлює специфічність взаємодії між ферментом і субстратом.
Кофактор підвищує стійкість білкової частини, може каталізувати інші процеси.
|
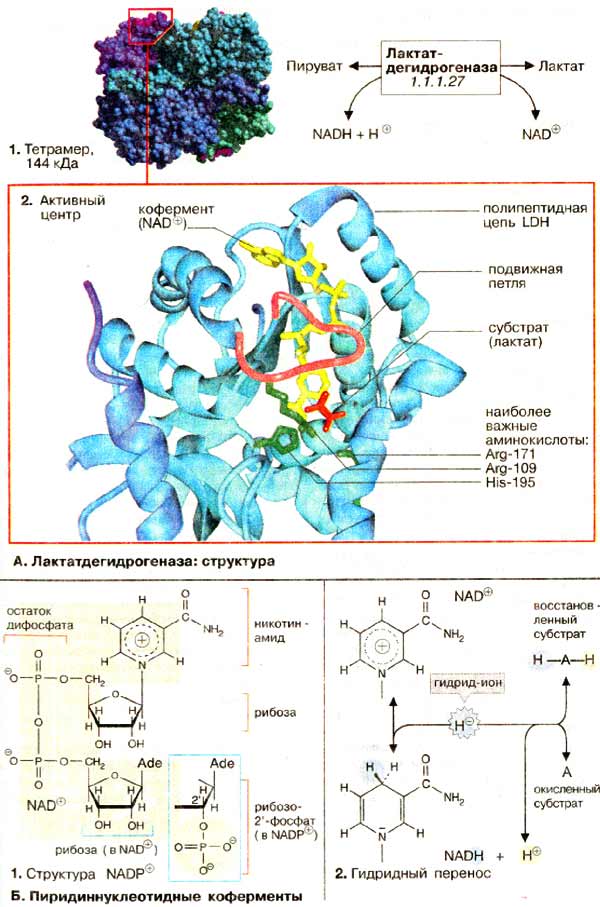
|
молекула лактатдегідрогенази (ЛДГ) |
Лізоцим куриного яйця (простий фермент) |
Активною формою лактатдегідрогенази є тетрамер з 4 субодиниць (1) Кожна субодиниця утворена пептидним ланцюгом з 334 амінокислот. В тетрамері субодиниці займають еквівалентні положення; кожний мономер містить активний центр. Пептидний остов білка зображений у вигляді стрічки (світло-блакитний), додатково представлені молекули: субстрату — лактат (червоного кольору), кофермент НАД+ (жовтого кольору), три бічних ланцюга амінокислот (зеленого кольору), які безпосередньо в каталізі. Пептидний ланцюг (малиновий колір), утворена амінокислотними залишками 98-111.


|
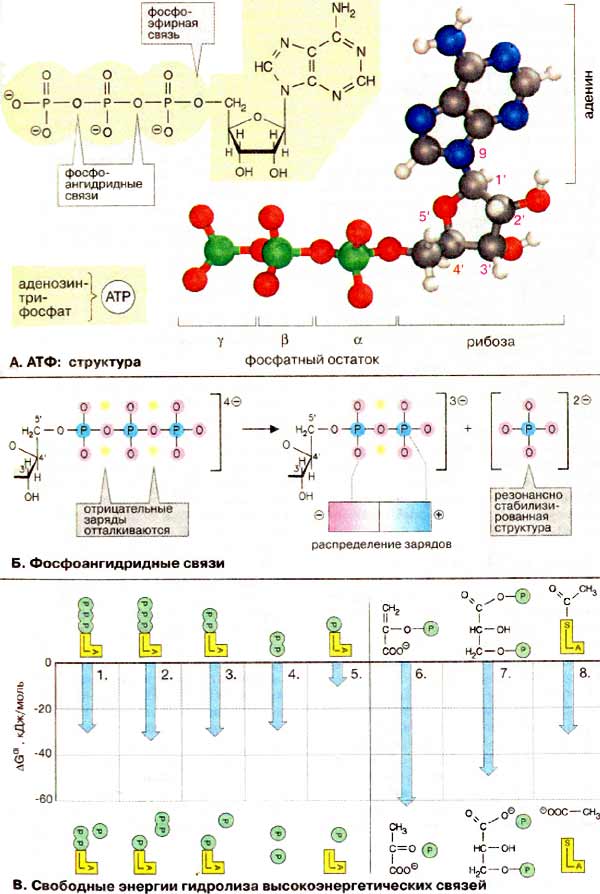
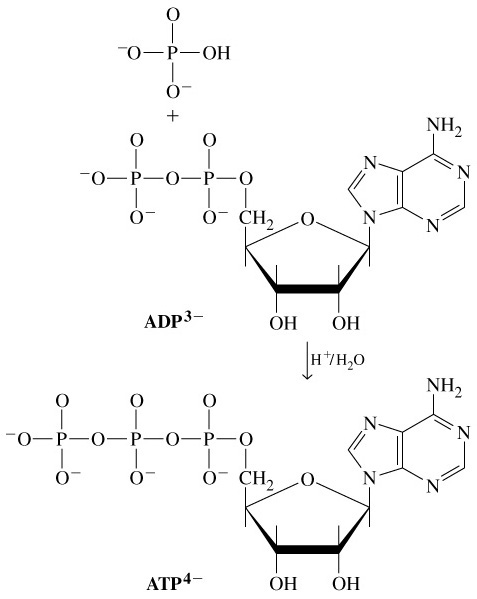
Нуклеотидний кофермент аденозинтрифосфат [АТФ (АТР)] є найбільш важливою формою збереження хімічної енергії в клітинах. Розщеплення АТФ — високо екзергонічна реакція. Хімічна енергія гідролізу АТФ може використовуватися для спряження з ендергонічними процесами, такими, як біосинтез, рух і транспорт. Інші нуклеозидтрифосфатні коферменти (ГТФ, ЦТФ та УТФ), хімічно подібні до АТФ, виконують в метаболічних процесах інші функції. А. АТФ: структура В АТФ ланцюг з трьох фосфатних залишків сполучений з 5'-OH-групою аденозину. Фосфатні групи позначаються як α, β и γ. Рибоза сполучена з α-фосфатом фосфоефірним зв’язком. Три фосфатні залишки сполучені між собою менш стійкими фосфоангідридними зв’язками. При фізіологічних значеннях рН АТФ несе чотири негативні заряди. Діючим коферментом є комплекс АТФ з іоном Mg2+, координаційно зв’язаним з α- та β-фосфатом. Для простоти говорять тільки про АТФ. Б. Фосфоангідридні зв’язки На схемі: в АТФ атоми кисню всіх трьох фосфатних залишків несуть приблизно однаковий негативний заряд, а атоми фосфори заряджені позитивно. Причиною відносної нестабільності фосфоангідридних зв’язків є сильне відштовхування негативно заряджених атомів кисню, яке послаблюється при гідролітичному відщепленні кінцевої фосфатної групи. Тому такі реакції є високо екзергонічними. При гідролізі АТФ утворюється вільний фосфат-аніон, який краще гідратований і більш ефективно стабілізований, ніж відповідний залишок в АТФ, що сприяє гідролізу АТФ. |
|||
|
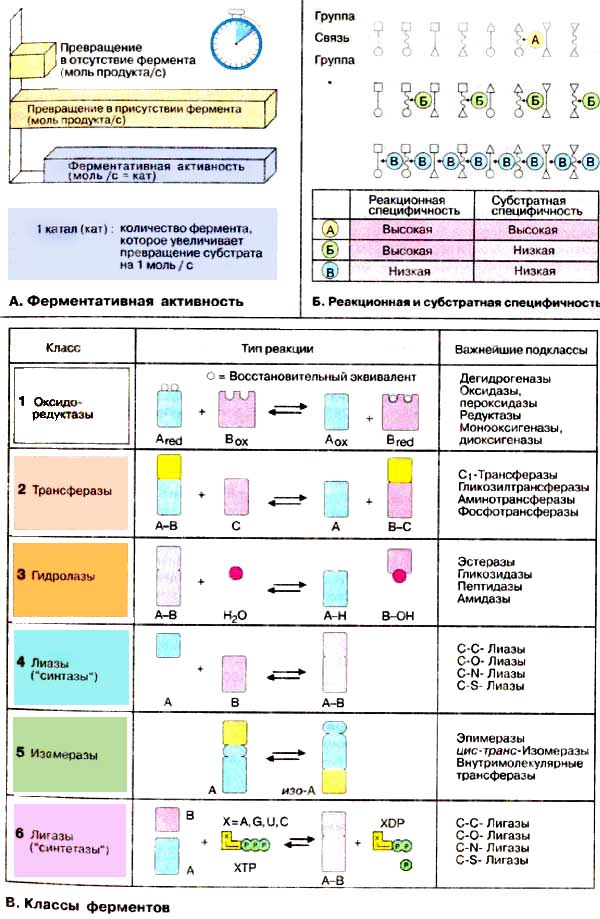
За характером своєї каталітичної дії ферменти поділяють на шість класів:
|
|
|
|
Розроблена система класифікації враховує реакційну та субстратну специфічності ферментів. Всі ферменти вміщені в «Каталог ферментів» під своїм класифікаційним номером (КФ), який складається з чотирьох цифр. Перша цифра вказує на приналежність до одного з шести головних класів. Наступні дві цифри визначають підклас і підпідклас, а остання цифра — номер ферменту в даному підпідкласі. Наприклад, лактатдегідрогеназа має номер КФ 1.1.1.27 (клас 1, оксидоредуктази; підклас 1.1, донор електрона — СН-ОН; підпідклас 1.1.1, акцептор — НАДФ+.)
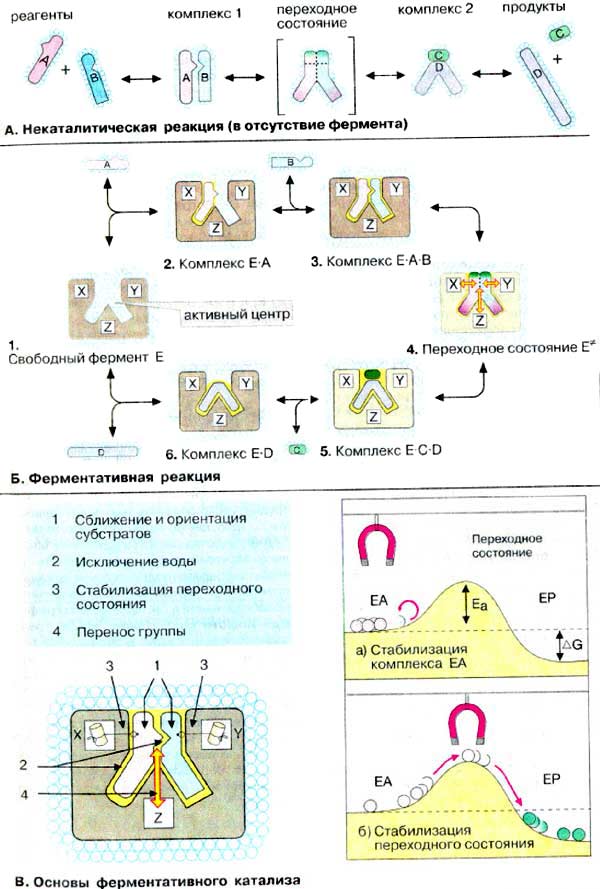
А. Некаталітична реакція (у відсутності ферменту): Реакція типу А + В → С + D.
Речовини A та В у розчині оточені оболонкою з молекул води (гідратною оболонкою) та під дією теплового руху безладно переміщуються. При зіткненні та правильної орієнтації в момент зіткнення утворюється активований комплекс. Для утворення продуктів C + D комплекс A—В, повинен утворити перехідний стан, що потребує значної енергії активації, Ea. Оскільки отримати цю енергію може тільки незначна частина комплексів A—В, досягнення перехідного стану — ще більш рідкий випадок, ніж виникнення комплексу. У розчині більша частина енергії активації витрачається на руйнування гідратних оболонок між речовинами A и В, наближення реагентів та інші хімічні процеси, в яких ці реагенти беруть участь. Отже, у відсутності каталізатора утворення продуктів відбувається рідко і швидкість реакції v незначна, навіть, якщо реакція є термодинамічно можливою, тобто ΔG < 0.
|
|
Б. Ферментативна реакція. Ферментативний каталіз.
Ферменти специфічно зв’язують реагенти (свої субстрати) в активному центрі. При цьому субстрати орієнтуються таким чином, що набувають оптимального положення для утворення перехідного стану (1-3). Зближення та необхідна орієнтація реагентів значно підвищують ймовірність утворення продуктивного комплексу A—B. Крім того, зв’язуванню субстрату в активному центрі спричиняє відокремлення гідратної оболонки субстрату. Внаслідок видалення молекул води в активному центрі ферменту під час каталізу створюються зовсім інші умови, ніж у розчині (3-5).Важливим фактором є стабілізація перехідного стану внаслідок взаємодії між амінокислотними залишками білка та субстратом (4).
Висновки:
Механізм дії ферментів – утворення фермент-субстратних комплексів; обумовлений зниженням енергії активації, що необхідна для перебігу хімічної реакції, спрямовуючи її крізь проміжні реакції, які вимагають значно меншої енергії активації.
Природа каталітичної дії ферментів пояснюється теорією проміжних сполук і адсорбційною теорією.
І етап. Субстрат з’єднується з ферментом за рахунок слабких сил.
ІІ етап. Відбувається активація і видозмінення субстрату з утворенням одного або кількох активованих комплексів, супроводжується розривом і утворенням ковалентних зв’язків.
ІІІ етап. Відокремлення продуктів реакції від ферменту, який змінює молекулу субстрату так, що міцність окремих хімічних зв’язків зменшується, що призводить до зниження енергії активації.
Багато ферментів під час каталізу переносять специфічні групування з субстрату або на субстрат. Особливо часто здійснюється перенесення протонів. Такий ферментативний кислотно-основний каталіз є більш ефективним, ніж обмін ферменту.
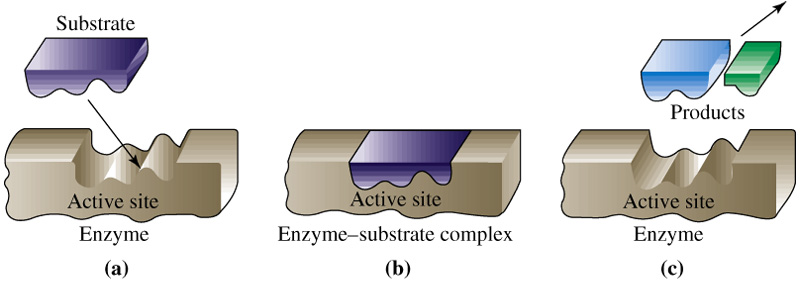
Зв’язування ферменту з субстратом здійснюється через активний центр, який розміщений на поверхні глобул.
|
Загальна схема ферментативного каталізу: Е + S → ЕS → ЕS*→Е+П, де Е – фермент; S – субстрат; ЕS – первинний фермент – субстратний комплекс; ЕS* ‑ активований комплекс; П – продукт реакції. |
Активний центр ферменту складається з функціональних груп, які відповідно зорієнтовані у просторі.