
- •Раздел 12 хтп Производство полимерных материалов
- •Тема 1 Классификация и физико-химические свойства полимеров Лекция 1 Методы синтеза полимеров
- •2 Общие сведения о полимерах, способы, классификация. Значение полимеров для народного хозяйства.
- •Тема 2 Производства полимеров
- •1 Полиэтилен: способы получения. Технологическая схема получения полиэтилена при высоком давлении, условия. Типы реакторов.
- •2 Технологическая схема получения полиэтилена при низком давлении, условия. Типы реакторов. Свойства и применение полиэтилена.
- •3 Полистирол: способы получения. Технологическая схема получения блочного полистирола, условия.
- •4 Технологическая схема получения эмульсионного полистирола, условия. Применение полистирола.
- •5 Полипропилен: свойства, способы получения, условия, применение.
- •6 Фенолальдегидные полимера: свойства, способы получения, условия, применение.
- •Тема 3 Производство синтетических каучуков и волокон
- •1 Каучуки: определение, классификация. Скс(скмс): свойства, получение.
- •2 Каучуки специального назначения: полиизобутиленовый и полихлоропреновый, их свойства, способы получения, условия. Производство синтетических волокон.
- •3 Получение синтетических волокон
- •Раздел 13 Электрохимические процессы в промышленности оос
- •1 Классификация процессов электросинтеза органических веществ
- •2 Методы получения себациновой и других кислот, адипонитрила и других органических веществ.
- •Раздел 14 Методы и принципы системных исследований при разработке хтп
- •Тема 1 Методы и принципы системных исследований
- •1 Хтс: определение, основные понятия, классификация систем.
- •2 Сущность системного подхода. Типовые задачи анализа, синтеза и управления хтс
- •Тема 2 Анализ хтс
- •1 Способы представления структуры хтс, понятие о расчете разомкнутых и замкнутых хтс.
- •2 Алгоритмы структурного анализа хтс, примеры расчета хтс модульным методом.
- •3 Обзор методов синтеза хтс, метод характеристик, синтез систем реакторов, комбинаторные методы с оценочными функциями.
- •Тема 3 Направления совершенствования и оптимизации производства органических веществ
- •Раздел 15 Моделирование хтп
- •1 Моделирование как основной метод решения задач оптимизации и проектирования хтп
- •2 Идентификация параметров установки и установление адекватности моделей
- •3. Оптимизация плазмохимического процесса получения ацетилена из метана
- •Раздел 16 Алгоритмы оценки управления хтп
- •1. Схемы реализации оптимального управления.
- •2. Оценка эффективности систем управления
Раздел 13 Электрохимические процессы в промышленности оос
1 Классификация процессов электросинтеза органических веществ
Электрохимический синтез — это метод получения новых соединений в результате превращения исходных веществ под действием электрического тока на границе электрод — раствор. Общая схема проведения электросинтеза органических соединений в простейшем виде представлена на рисунке 1.1.
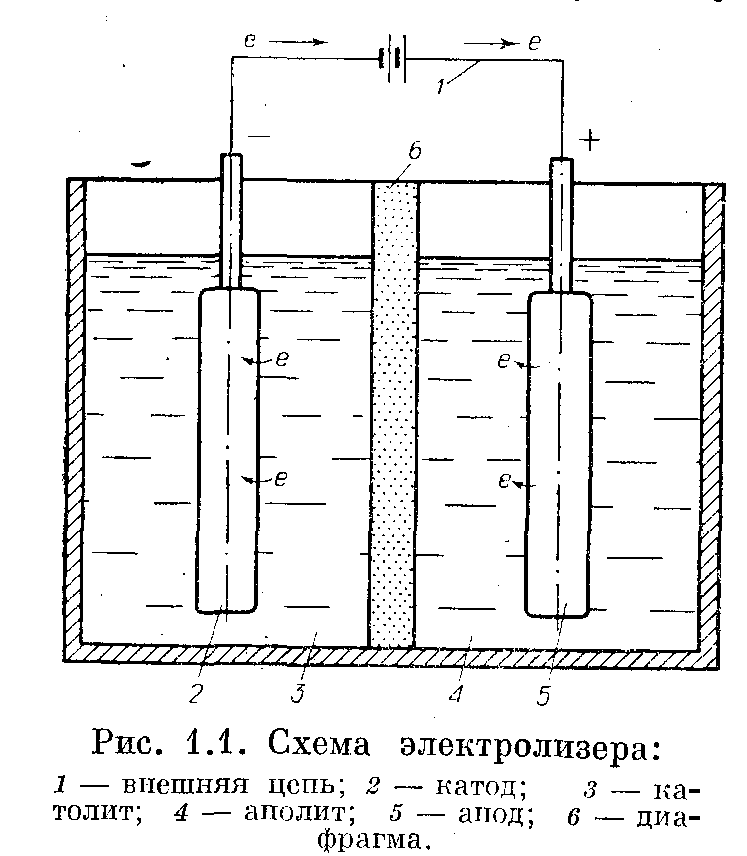
В сосуд, разделенный полупроницаемой перегородкой — диафрагмой, заливают электропроводящий раствор, содержащий органическое вещество, и погружают два электрода, соединенные с источником тока. Под действием электрического поля в растворе протекают следующие процессы. Положительно заряженные ионы мигрируют к отрицательному электроду (катоду), отрицательно заряженные ионы — к положительному электроду (аноду). На электродах происходит переход электронов. Катод посылает электроны в раствор, и при этом в прикатодном пространстве происходят процессы, связанные с присоединением электронов к реагирующим частицам, — восстановление, на противоположном электроде аноднореагирующие вещества отдают электроны, т. е. подвергаются окислению.
Необходимо отметить, что отдавать и присоединять электроны при электродных процессах могут также частицы, которые не принимает участия в переносе заряда. В приэлектродном пространстве реагируют те частицы, которые в данной системе наиболее легко отдают или присоединяют электроны. Реакции электросинтеза органических веществ классифицируются следующим образом:
1. Прямые электрохимические процессы, при которых присутствующее в растворе органическое вещество выступает в качестве акцептора или донора электронов, т. е. принимает прямое участие первичном электрохимическом акте.
2. Электрокаталитические процессы. На катоде вещество реагирует с сорбированным на поверхности электрода атомарным водородом, а на аноде — с сорбированным на поверхности атомарным кислородом. Атомарные водород и кислород образуются в результате электрохимических реакций.
3. Непрямые электрохимические процессы. На электроде генерируются соединения, которые взаимодействуют с органическим веществом. К этому типу относятся реакции, протекающие с катализаторами-переносчиками, восстановление амальгамами и др.
Электрохимические превращения присутствующих в растворе электролита органических веществ включают ряд стадий, таких, как доставка вещества к поверхности раздела электрод — электролит, адсорбция его на электродной поверхности, перенос одного или нескольких электронов, десорбция образовавшихся частиц поверхности электрода с одновременным или последующим превращением их в конечные продукты и отвод этих продуктов от поверхности электрода. Скорость всего многостадийного процесса определяется наиболее медленными стадиями. При осуществлении процессов, протекающих на электродах с участием органических веществ, лимитирующей стадией чаще всего является либо сама электрохимическая реакция, либо доставка вещества к поверхности электрода.
Восстановительные процессы. В тех случаях, когда ни диффузия, ни адсорбция реагирующих частиц не являются лимитирующими, скорость реакции электровосстановления определяется наиболее замедленной электрохимической стадией (или присоединением адсорбированных атомов водорода).
На
катоде электрохимическая реакция
протекает с участием окисленной Ох и
восстановленной Red
форм вещества по схеме:
![]()
Окислительные процессы. Рассмотрение кинетики процессов окисления органических веществ осложняется тем, что этим процессам в зависимости от природы электрода и раствора электролита сопутствует анодное растворение металла или образование на электродной поверхности окислов переменного состава. В результате характерная для многих катодных материалов прямолинейная зависимость потенциала или перенапряжения от логарифма плотности она при анодном выделении кислорода в широком интервале плотностей тока обычно не сохраняется . Однако, для области потенциалов, при которых не происходит образования окислов и в то же время осуществляется процесс окисления органических веществ за счет прямого отрыва электронов, кинетические зависимости получаются несложными.
Рассмотрим
реакцию:
![]() в которой стадия отрыва электронов
является определяющей.
в которой стадия отрыва электронов
является определяющей.
Предполагается, что на аноде образуются соединения различной устойчивости: а) радикалы ОН, адсорбированные на поверхности анода (механизм IУ); б) поверхностные окислы металла анода Ме—О, МеО—-ОН (механизмы 1, II, IУ, У); в) перекись водорода Н—О—О—Н (механизм III).
Когда замедленной стадией является не стадия отрыва электрона от окисляемой молекулы, а рассмотренные выше процессы взаимодействия этой молекулы с кислородсодержащими частицами по аналогии с восстановительными процессами, могут быть получены кинетические уравнения, в которых потенциал электрода зависит от рН раствора. Однако, как уже отмечалось выше, изменение с потенциалом состава окисных поверхностных слоев существенно искажает картину. Для области потенциалов, где окисных слоев не имеется, механизм анодных реакций довольно прост.
Рациональный подбор электродных материалов является необходимым условием осуществления селективных электрохимических процессов. Материал электрода должен удовлетворять ряду требовании:
1) устойчивость в выбранном для электросинтеза растворе электролита
2) устойчивость в электродных реакциях и к веществам, в них участвующим;
3) каталитическая активность в реакции, протекающей на электроде;
4) сохранение перечисленных свойств во времени.
Лабораторное оборудование:
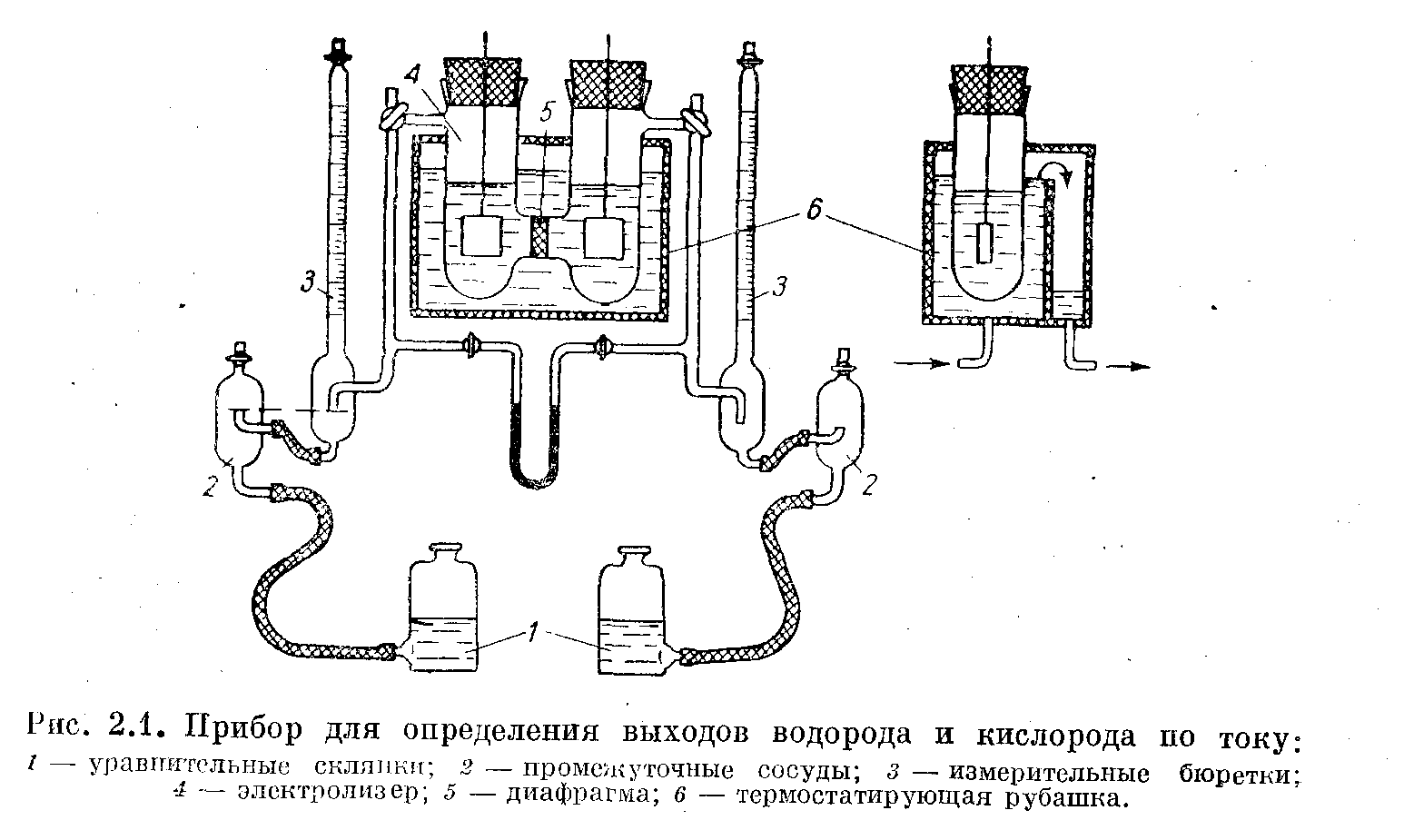
1.Электролизер представляет собой Н-образный сосуд, состоящий из двух пробирок. Имеющих отводы для газов и соединенных между собой трубкой, внутри которой находится диафрагма. диафрагмой может служить пористое стекло или полиэтилен. Стеклянные фильтры обычно впаивают, полиэтиленовые диафрагмы крепят и уплотняют с помощью кольца из микропористой резины. Одна из пробирок образует катодное пространство, другая — анодное. Пробирки закрывают резиновыми пробками, в которых укреплены электроды. Электролизер термостатируют рубашкой из органического стекла. Система для замера количества газов включает измерительную бюретку 3, промежуточный сосуд 2 и уравнительную склянку соответственно для каждого отделения.
Газ поступает в измерительную бюретку через ввод в нижней ее части, при этом соответствующее количество воды через промежуточный сосуд выдавливается в уравнительную склянку.
Конструкция электролизера, предназначенного для проведения электросинтеза, определяется в значительной степени свойствами веществ, подвергаемых электролизу и образующихся в процессе. Существенно зависит конструкция электролизера от наличия диафрагмы. Бездиафрагменные электролизеры конструктивно значительно проще, но во многих случаях без диафрагмы обойтись нельзя. Конструкция электролизера определяется также токовой нагрузкой. Практика показывает, что лабораторные электролизеры нагрузке можно разделить на малые (0,1—2 А), средние (4— : А) и большие (до 100 А и выше).
Диафрагменные электролизеры. Диафрагменные электролизеры на малые и средние нагрузки целесообразно делать цилиндрическими. Электродный процесс проводится в наружной камере. Корпусом электролизера служит стеклянная пробирка 1, закрытая резиновой пробкой. В пробке закрепляется цилиндрическая диафрагма 2.
Для малых электролизеров лучше всего в качестве диафрагмы применять целлофан. Каркасом диафрагмы служит полиэтиленовая перфорированная трубка с диаметром перфораций 4—5 мм и шагом 6—9 мм. Целлофановая пленка навивается на поверхность трубки в 3—4 слоя. Шов заклеивается полихлорвиниловой смолой. Можно использовать и керамические диафрагмы, по при малых размерах электролизера применение керамики нежелательно, так как в ней может адсорбироваться значительное количество органического вещества. В нижней части диафрагма закрывается резиновой пробкой 3 со стеклянной трубкой 4 для создания гидравлического затвора, через которую проходит ось мешалки 5. Частота вращении мешалки должна быть не менее 500 об/мин.
Анодом 6 служит платиновая проволока, навитая на стеклянную трубку 4, а катодом— цилиндр 7, который по верхней кромке имеет 4—5 отверстий для циркуляции раствора под действием мешалки. Катод имеет два токоподводящих штыря параметром 1,5—2 мм, которые укрепляются в клеммах, расположенных в верхней пробке. Такая нагрузку позволяет легко производить замену катода. Для обеспечения достаточно интенсивной циркуляции раствора зазор между электродом и диафрагмой должен быть не менее 5мм.
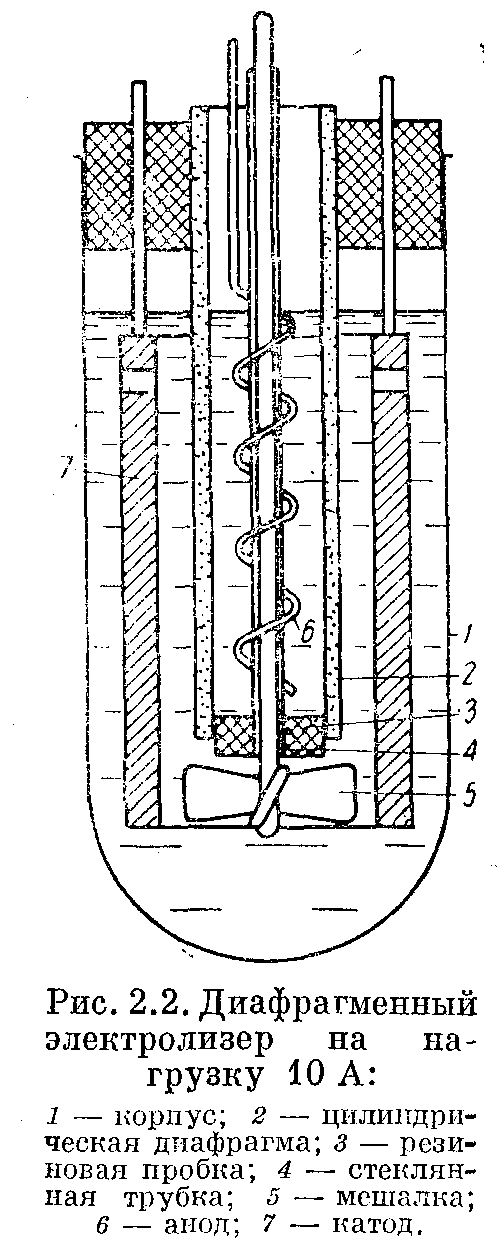
Для поддержания требуемой температуры электролизер погружают в водяную баню или криостат. Если для охлаждения достаточна температура водопроводной воды, электролизер снабжают водяной рубашкой. Можно впаять кран нижнего слива, что позволяет сливать электролит без разборки электролизера.
Применение электролизеров с цилиндрическими диафрагмами ограничивается тем, что по мере роста нагрузки электролизера возникает необходимость увеличения поверхности диафрагмы, однако с увеличением диаметра диафрагмы резко повышается ее внутренний объем. На практике установлено, что диаметр диафрагм лабораторного электролизера не должен превышать 70 мм, а это лимитирует предельную нагрузку на такой электролизер до 20 А.
Бездиафрагменные электролизеры. Бездиафрагменные электролизеры применяют для осуществления синтеза Кольбе, электрофторирования, метоксилирования, при электровосстановлении алифатических кетонов и во многих других процессах. Отсутствие диафрагмы существенно облегчает конструирование электролизера, позволяет сделать его более компактным.
Только для ячеек малой мощности на нагрузку 1—2 А электролизер без диафрагмы целесообразно выполнять цилиндрическим, снабжая его двумя концентрически расположенными электродами без перфорации. Межэлектродное расстояние, а также расстояние между наружным электродом и корпусом электролизера должно быть не менее 8 мм, уменьшение этих размеров существенно ухудшает циркуляцию раствора в процессе электролиза. В случае небольшой нагрузки одним из электродов может служить корпус электролизёра .
При конструировании более мощных электролизеров целесообразно применять плоские электродом
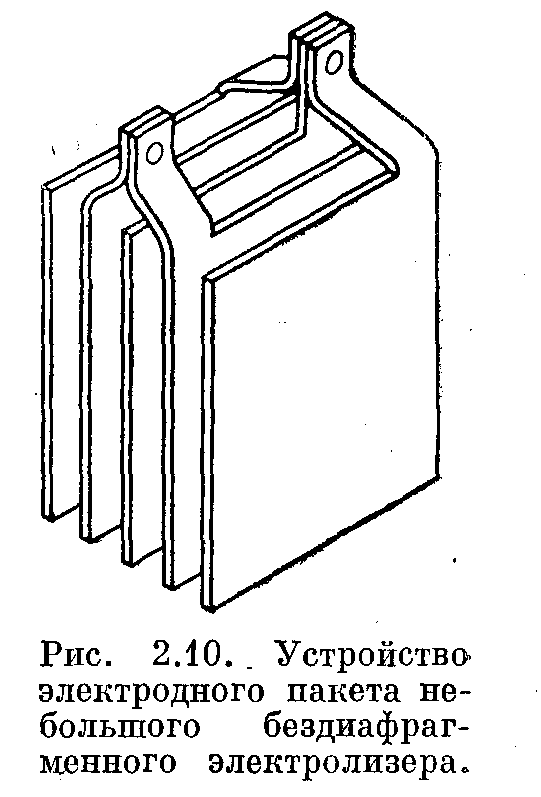
Чередующиеся электроды (аноды или катоды) могут быть выполнены в виде полых охлаждаемых коробок. При сборке электродного пакета межэлектродное расстояние должно быть 5—8 мм для электролизеров высотой 50— 100 мм. Более высокие электролизеры требуют большего межэлектродного расстояния.
Конструкция электродного пакета с охлаждаемыми катодами
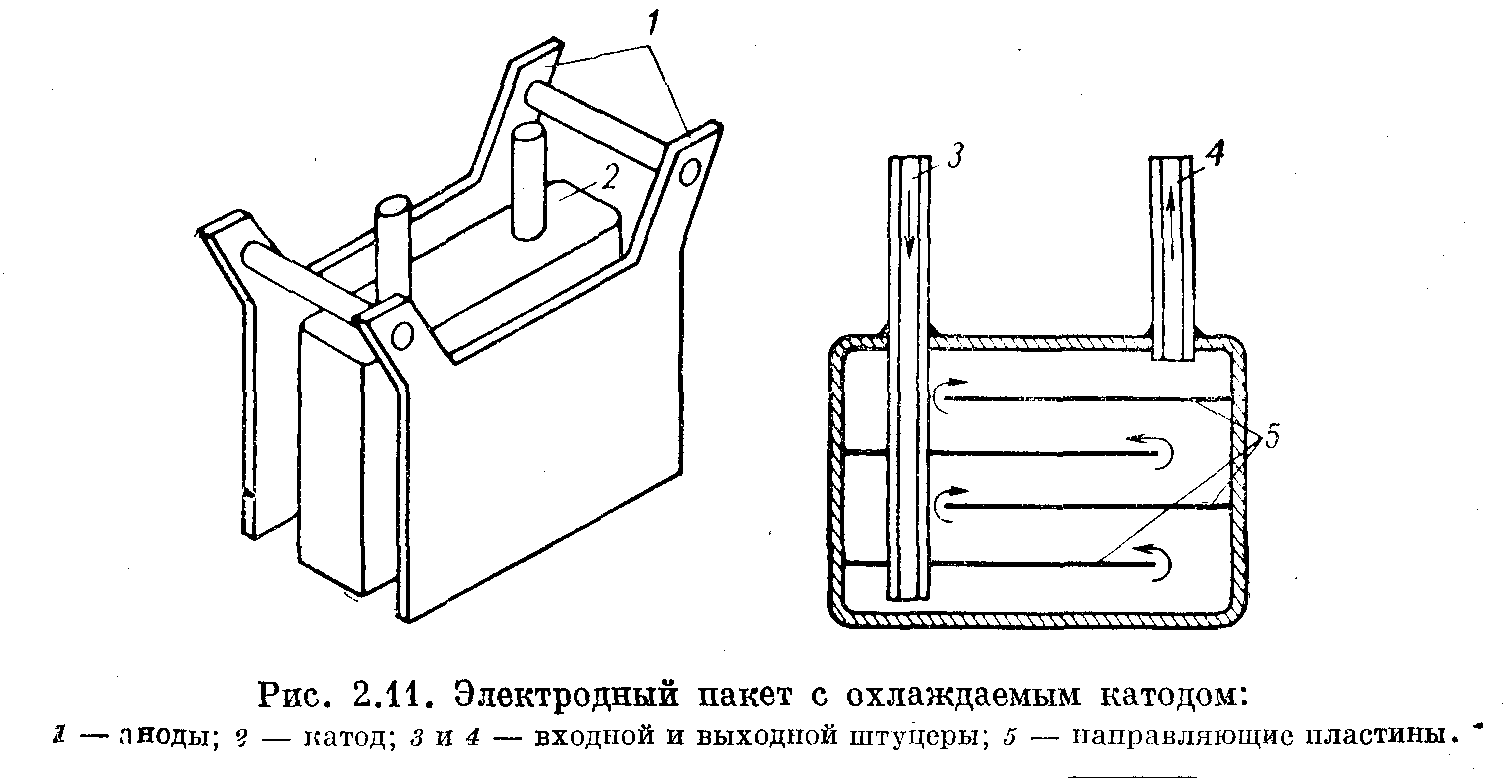
Аноды 1 Выполнены в форме перфорированных пластин. Катод 2 представляет собой полую охлаждаемую коробку. Токоподводы анодов разводятся немного в стороны, что позволяет вынимать катодную коробку вверх без разборки анодного пакета: Это существенно облегчает обслуживание электролизера. Катодная коробка (см. рис. 2.11 справа) имеет два штуцера. Входной штуцер 3 — длинный, он доходит почти до дна катода, выходной штуцер 4 — короткий. К стенкам катода перед сборкой приварены направляющие пластины 5, которые, с одной стороны, улучшают условия циркуляции воды (ход хладагента в катоде указан стрелками), а с другой стороны, увеличивают жесткость конструкции, устраняя возможное раздувание коробок под давлением хладагента.
Промышленные электролизёры. По сравнению с электролизом неорганических соединений электрохимические процессы для органических веществ имеют специфические особенности, которые необходимо учитывать при конструировании электролизеров. К ним относятся необходимость съема большого количества тепла, применение гетерогенных сред, включая введение в реакцию газообразных продуктов, работа с малоэлектропроводящими растворами и т. п.
В случае получения небольших количеств органических веществ применяют универсальный электролизер, который представляет собой прямоугольную пластмассовую коробку 1, футерованную изнутри свинцом или оловом 2. Эта футеровка и служит катодом. Внутри электролизера па крышке крепятся пористая диафрагма 3 и анод 4. Для поддержания требуемой температуры в электролизере имеются змеевики 5, по которым циркулирует хладагент. Для обеспечения циркуляции раствора в катодной камере электролизер снабжается мешалкой. Он имеет серьезные недостатки: приспособлен для проведения электролиза гомогенных растворов хорошо восстанавливающихся веществ.
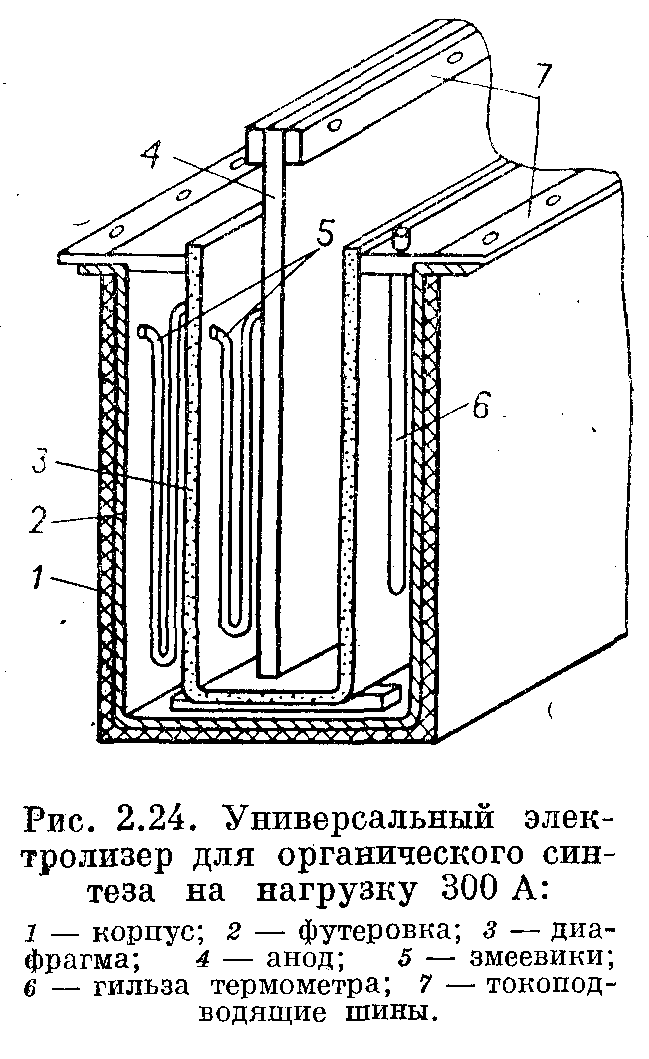
Применяемые в нем растворы должны обладать хорошей электропроводностью, так как съем тепла с помощью змеевиков, расположенных в анодном и катодном пространствах, весьма ограничен. Кроме того, такой электролизер обладает сравнительно низкой производительностью процесса.
В случае употребления электролизеров без диафрагм большая поверхность электродов в небольшом объеме может быть достигнута за счет уменьшения межэлектродного расстояния. Например, в электролизерах для электрохимического фторирования межэлектродное расстояние может быть доведено до 5 мм, что позволяет сконструировать достаточно высокопроизводительный и в то же время компактный электролизер. Электродный пакет состоит из чередующихся и разделенных изоляторами
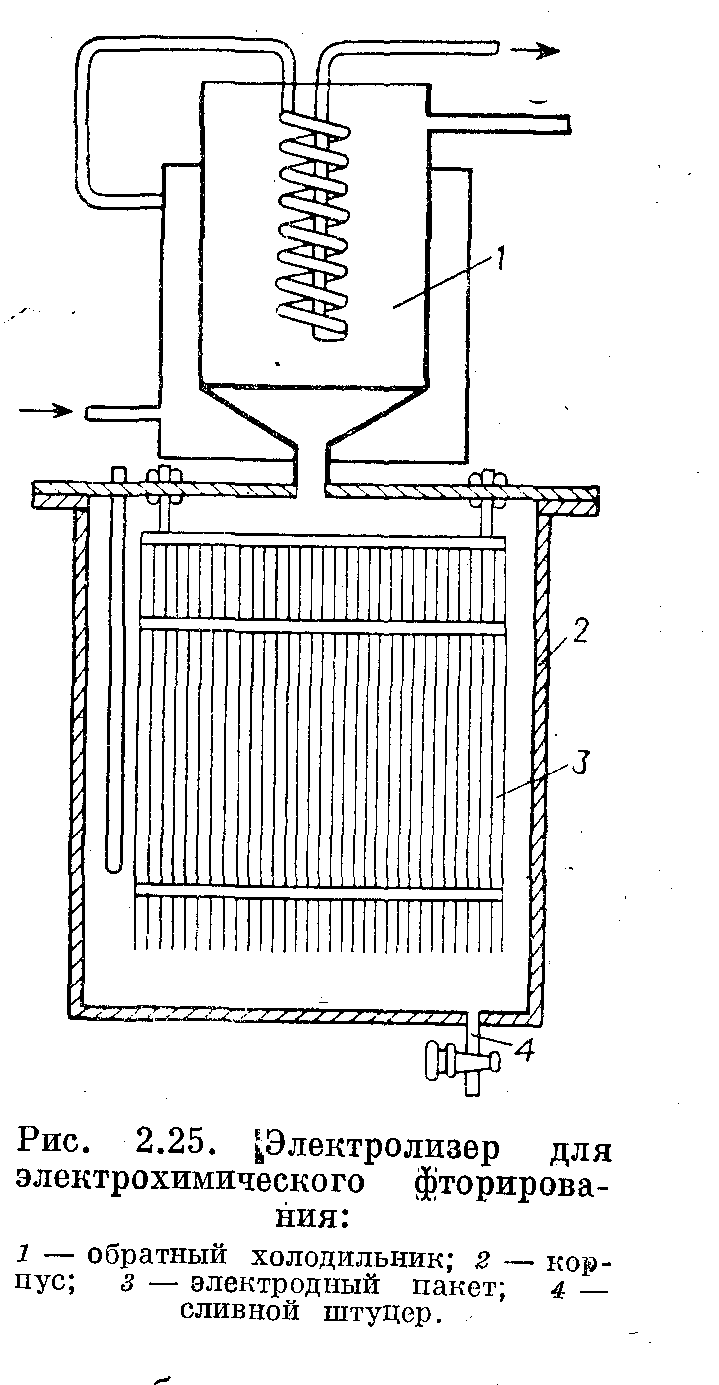
анодных и катодных пластин. Пакет крепится на крышке электролизера. Электролизеры аналогичной конструкции могут использоваться в некоторых других процессах, не требующих разделения анодного и катодного процесса диафрагмой.
Существует электролизер с конструкцией электрода с активным слоем катализатора, который удерживается на поверхности электрода с помощью магнитного поля. Этот метод применим для ферромагнитных катализаторов.
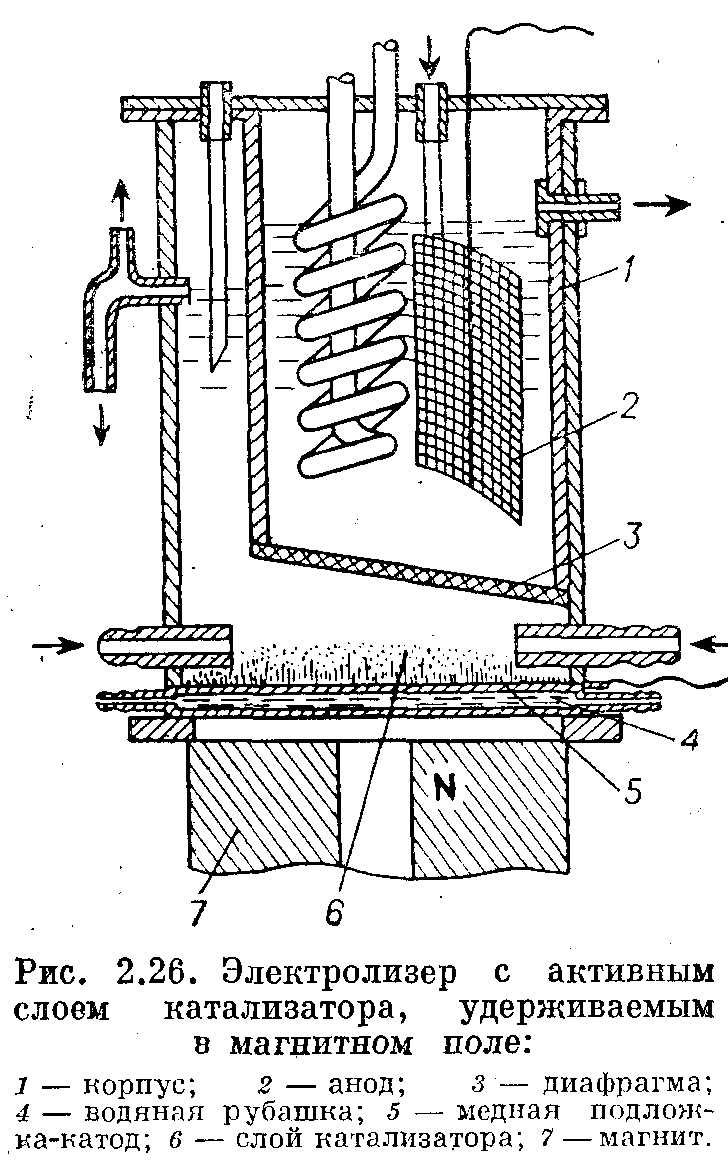
Предлагаемая конструкция электрода позволяет очень легко производить замену катализатора. По устранении магнитного поля катализатор легко суспендируется и удаляется вместе с раствором; вместо него загружается суспензия свежего катализатора.
Условия проведения электролиза обычно выбирают так, чтобы проходящий через раствор ток определялся главным образом скоростью электродного процесса, протекающего на том электроде, на котором образуется основной целевой продукт.
Электродный процесс состоит из нескольких стадий. В простейшем случае этими стадиями являются подача реагирующего потока (деполяризатора) к поверхности электрода, собственно электрохимическая реакция (перенос электронов) и отвод продуктов реакции от электродной поверхности. Электродные процессы с участием органических соединений часто включают химические стадии (химическое превращение веществ у электродной поверхности непосредственно до или после переноса электронов); на прочие отдельных стадий электродного процесса сильное влияние оказывают адсорбционные явления на границе раствор — электрод.
Наиболее важным условием, необходимым для успешного электросинтеза, является правильный выбор материала электрода.
В качестве катодов принципиально можно использовать любые материалы, обладающие достаточной электропроводностью. Одним из главных показателей, характеризующих электрохимическую активность катодного материала, является перенапряжение водорода. По величине перенапряжения водорода большинство электродных материалов можно разделить на две группы: обладающие низким (металлы первой группы) и высоким (металлы второй группы) перенапряжением водорода.
Выбор материалов, которые можно использовать в качестве анодов, чрезвычайно мал, так как большинство металлов при анодной поляризации корродируют.
При работе в кислых растворах наиболее целесообразно применение платинового анода. Значительная коррозия платинового анода в процессах электросинтеза потребовала проведения многочисленных исследований для подбора более доступных анодных материалов, стойких в условиях электролиза. Основное внимание исследователей направлено на изучение свойств окисных электродов. Среди последних наибольшего внимания заслуживают электроды из двуокиси свинца, магнетита и двуокиси марганца.
При электролизе в щелочных растворах в качестве анодов можно применять никель, а в некоторых случаях даже железо. Так как никель и железо характеризуются низким перенапряжением кислорода, на них почти не окисляются многие органические соединения, что позволяет осуществить ряд катодных процессов в электролизерах без диафрагмы.
