
- •Оглавление
- •Лейкемоидные реакции
- •Список принятых сокращения
- •Предисловие
- •Занятие 1
- •Продолжительность занятия – 2 часа.
- •План и организация
- •3. Учебные цели занятия
- •Эритропоэз
- •Лейкопоэз
- •Занятие 2
- •Продолжительность занятия – 2 часа.
- •План и организация
- •3. Учебные цели занятия
- •Эритроциты
- •Патологические формы эритроцитов
- •Гемоглобин
- •Аномальные гемоглобины
- •Цветовой показатель
- •Гематокрит
- •Занятие 3
- •Продолжительность занятия – 2 часа.
- •План и организация
- •3. Учебные цели занятия
- •Классификации анемий
- •Общая характеристика анемий
- •Занятие 4
- •Продолжительность занятия – 2 часа.
- •План и организация
- •3. Учебные цели занятия
- •Лейкоциты
- •Иммунопатология
- •Количественная оценка иммунокомпетентных клеток
- •Патологические формы лейкоцитов
- •Дифференцировка лимфоцитов на кластеры дифференциации по поверхностным cd-маркерам
- •Анализ функциональной активности т- и в-лимфоцитов
- •Оценка фагоцитарной активности лейкоцитов
- •Лейкемоидные реакции встречаются не очень часто, однако встречаясь, они создают диагностические сложности, так как могут симулировать различные заболевания системы крови.
- •Занятие 5
- •Продолжительность занятия – 2 часа.
- •План и организация
- •3. Учебные цели занятия
- •Лейкозы
- •Классификация лейкозов
- •Патогенез лейкозов
- •Острый лейкоз
- •Список литературы:
- •Алгоритм выполнения манипуляций
- •З. Окраска на гликоген с контролем амилазой
- •И. Выявление липидов суданом черным
- •К. Реакция на пероксидазу с бензидином
- •Л. Неспецифическая эстераза по Хейхо
- •М. Выявление щелочной фосфатазы по Хейхо
- •Н. Кислая фосфатаза по Барку
Список литературы:
Васильев В. Н. Краткий курс лекций по нормальной физиологии. Физиология системы крови. Учебно-методическое пособие / В. Н. Васильев // Томск. - 2003. - 25 с.
Гольдберг Е.Д. Справочник по гематологии с атласом микрофотограмм / Е.Д.Гольдберг // Томск, Издательство ТГУ. - 1989. - 372 с.
Козлов, В. А. Практические аспекты диагностики и лечения иммунных нарушений: руководство для врачей / В.А. Козлов, А.Г. Борисов, С.В. Смирнова, А.А. Савченко. – Новосибирск: Наука, 2009. – 274с. – ISBN 978-02-023237-2.
Медицинская микробиология. Часть первая: учебное пособие / Под. ред. А.М. Королюка и В.Б. Сбойчакова. – СПб.: ЭЛБИ-СПб, 2002. – 267с.
Н.В. Канская, Т.В. Жаворонок, Н.В. Рязанцева, Г.И. Цыров, Т.Н. Бодрова, Ф.Ф. Тетенев, В.Ю. Серебров, Г.Э. Черногорюк, А.Н. Байков, И.А. Позднякова. Интрепретация результатов основных лабораторных методов исследования в клинической практике / Учебное пособие по клинической биохимии для студентов медицинских вузов: Издание 2-е, переработанное и дополненное. – Томск, 2004. – 159 с.
Новицкий В.В. Руководство к практическим занятиям по гематологии / В.В. Новицкий, О.М. Евтушенко. - Томск, 1999. - 160 с.
Практикум по физиологии./ Под ред. акад. РАМН М.А. Медведева, Томск, 2006.
Руководство к практическим занятиям по медицинской микробиологии / Под. Ред. Проф. Е.П. Красноженова. – 2-е изд. – Томск: изд-во Том. Ун-та, 2003. – 260с.
Руководство к практическим занятиям по медицинской микробиологии, вирусологии, иммунологии / Под. Ред. В.В. Теца. – изд. 2-е, перераб. и доп. – М.: Медицина, 2002. – 352с.
Руководство к практическим занятиям по нормальной физиологии / Под ред. К.В.Судакова, А.В.Котова, Т.Н.Лосевой.- М, Медицина, 2002.
Современные технологии лабораторной медицины: Учебное пособие / Н.В. Рязанцева, В.В. Новицкий, О.Б. Жукова, О.И. Уразова и др. // Томск: Изд-во «Печатная мануфактура», 2008. – 360 с.
Физиология человека / Под ред. В.М. Покровского и Г.Ф. Коротько. М.: Медицина, , 2003.
Физиология человека / Под ред. В.М. Смирнова, М.: Медицина, 2001.
Филимонов В.И. Руководство по общей и клинической физиологии: Учеб. пособие. / В.И. Филимонов. – М.: Мед. инф. агентство, 2002.
Приложение 1
Алгоритм выполнения манипуляций
а. Забор крови из пальца
Кровь для общего клинического анализа берут обычно из мякоти IV пальца руки, получая так называемую капиллярную кровь. Исследование проводят утром, желательно натощак, чтобы избежать пищеварительного лейкоцитоза, хотя это правило не является строго обязательным.
В момент взятия крови из пальца пациент должен сидеть или лежать. Кожу мякоти ногтевой фаланги IV пальца левой руки протирают ватным шариком, смоченным спиртом и прокалывают индивидуальным стерильным скарификатором. Укол следует делать быстрым коротким движением до упора, одновременно фиксируя пальцами левой руки концевую фалангу IV пальца пациента и слегка надавливая кожу. Первую каплю крови вытирают сухим ватным шариком.
Оптимальной является следующая последовательность взятия крови для исследования:
1. кровь для определения СОЭ;
2. кровь для определения концентрации гемоглобина;
3. кровь для подсчета эритроцитов;
4. кровь для подсчета общего количества лейкоцитов;
5. кровь для приготовления мазка и исследования лейкоцитарной формулы.
б. Подсчет количества лейкоцитов в счетной камере Горяева
Камера Горяева представляет собой толстую стеклянную пластину (предметное стекло) с углублением в центре, равным 0,1 мм. На дне камеры нанесены 2 сетки Горяева, разграниченные поперечной канавкой. Сбоку от сеток расположены стеклянные прямоугольные пластины, к которым притирается шлифованное покровное стекло. Каждая сетка Горяева состоит из 225 больших квадратов, 25 из которых разделены еще на 16 малых квадратов каждый. Сторона большого квадрата равна 0,2 мм, сторона малого квадрата — 0,05 мм. Площадь большого квадрата составляет 0,04 мм2, малого квадрата — 0,0025 мм2.
Для подсчета лейкоцитов берут 0,02 мл крови, разведенной в 200 раз в 4,0мл 0,85% раствора NaCl. Подсчет форменных элементов проводят под микроскопом в строго определенном количестве квадратов камеры Горяева, после чего делают пересчет числа лейкоцитов на 1 мкл и 1 л крови с учетом объема квадратов и разведения крови.
Перед заполнением кровью счетную камеру и покровное стекло тщательно протирают и высушивают. Мякотью больших пальцев покровное стекло плотно прижимают к боковым пластинам камеры и слегка передвигают его вверх и вниз до тех пор, пока не появятся радужные полосы («ньютоновые кольца»).
Пипеткой набирают небольшой объем взвеси крови и выпускают 1-2 капли на фильтровальную бумагу. После этого подносят каплю разведенной крови к краю покровного стекла, следя за тем, чтобы кровь равномерно заполняла всю поверхность камеры с сеткой, не затекая в боковые бороздки. Если это случится, взвесь крови удаляют фильтровальной бумагой. После заполнения камеры ее оставляют на 1-2 минуты в горизонтальном положении для оседания лейкоцитов.
Подсчет лейкоцитов проводят при малом увеличении микроскопа (например, объектив х 8, окуляр х 10), в несколько затемненном поле зрения (при прикрытой диафрагме и опущенном конденсоре). Для этого под микроскопом находят верхний левый квадрат сетки (разделенный на 16 малых) и подсчитывают число лейкоцитов в нем. При этом целесообразно придерживаться определенной последовательности подсчета лейкоцитов: передвигаться из одного малого квадрата в другой по горизонтали, например, один ряд справа налево, другой ряд слева направо и т. д. В каждом малом квадрате подсчитывают лейкоциты, находящиеся внутри него, а также расположенные, например, на левой и верхней границе квадрата, пропуская лейкоциты, лежащие на нижней и правой границе.
Количество лейкоцитов в 1 мкл (1 мм3) крови рассчитывают по следующей формуле:
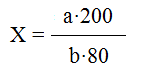
где X — число лейкоцитов в 1 мкл крови, а — число сосчитанных лейкоцитов, b — объем малого квадрата (2,5x·14 мкл), 200 — разведение крови, 80 — число малых квадратов, в которых производился счет.
в. Методика приготовления мазков
Каплю крови наносят на сухое предметное стекло. Шлифованное стекло устанавливают под углом 45° к предметному стеклу. Кровь при соприкосновении со шлифованным стеклом растекается по его краю. После этого быстрым движением шлифованное стекло продвигают вперед и немного вверх. Хорошо приготовленный мазок крови выглядит на просвет желтоватым, равномерным и прозрачным. В этом случае форменные элементы крови располагаются в нем в один слой.
г. Получение лимфоцитов
Полученную кровь, смешанную с ЭДТА в соотношении 4:1, инкубируют 45-60 мин при 37оС. Образовавшийся над эритроцитами слой плазмы собирают при помощи пастеровской пипетки и переносят в стерильную пробирку. Затем центрифугируют в течение 10 мин при 1000 об/мин. Надосадочную жидкость удаляют, осадок используют для дальнейшего исследования.
Мононуклеарные лейкоциты выделяют из крови путем центрифугирования на слое фиколл-верографина, состоящей из 12-ти частей 9% фиколла и 3-х частей 33,9% верографина (r=1,077), в соотношении 1:4. Центрифугируют 30-40 мин при 1500 об/мин. Слой лимфоцитов в виде полосы белого цвета над сепарирующим раствором собирают пипеткой и трижды отмывали средой Хенкса по 10 мин при 1000 об/мин.
д. Определение субпопуляционного состава лимфоцитов крови
Тестирование субпопуляций лимфоцитов крови по CD-маркерам (СD3+, СD4+, СD8+) проводят методом проточной цитофлюориметрии с применением моноклональных антител.
Выделенные клетки культивируют в полной питательной среде в стерильном планшете, можно использовать планшет для ИФА, в количестве 2х106 на объем лунки (250 мкл). После культивирования клетки собирают в пластиковые пробирки для проточного цитофлюориметра, отмывают фосфатным буфером (рН=7,2) и окрашивают стандартными атнителами, меченными FITC, в объеме 20 мкл. Затем клетки собрают в пробирку, отмывают в 500 мкл ФСБ, центрифугируют 5 мин при 1,5 тыс. об/мин; супернатант удаляют аспирацией. После добавления 5 мкл меченых антител и 500 мкл ФСБ; пробы встряхивают на вортексе для смешивания антител с клетками.
Анализ проводят с использованием цитофлюориметра на основе определения малого углового светорассеяния (FSC), характеризующего размер клетки, и бокового светорассеяния (SSC), характеризующего цитоплазматические, а также мембранные особенности клетки. Анализируют параметры зеленой (FITC – 530 нм) флюоресценции на FL1-канале. Параметры напряжения для регистрации показателей на проточном цитометре задают согласно указаниям в инструкции к набору. Результаты выражают в относительных (%) и абсолютных (тыс/мкл) значениях.
е. Оценка фагоцитарной активности лимфоцитов по методу Н.В.Пучкова.
В стерильную центрифужную пробирку вносят 0,6мл 2% раствора цитрата натрия, 0,3мл образца крови (стерильно взятой из локтевой вены), 0,2мл взвеси микроорганизмов. Смесь взбалтывают 5 минут и инкубируют в термостате при 370С в течение 30 минут, затем центрифугируют при 1500об/мин в течение 5-6 минут. Стерильной пастеровской пипеткой убирают слой плазмы в отдельную пробирку. Далее пастеровской пипеткой собирают лейковзвесь, готовят из нее 5-6 мазков. Фиксируют смесью Никифорова 5 минут, окрашивают по Романовскому-Гимзе в течение 15-20 минут. Микроскопируют с иммерсионной системой. При хорошем освещении поля зрения, подсчет фагоцитированных микробных клеток ведут в 200 нейтрофилах (50 моноцитах). Рассчитывают показатель фагоцитарной активности (процент фагоцитировавших клеток из числа сосчитанных нейтрофилов) и фагоцитарный индекс (среднее число микроорганизмов, поглощенных одним активным нейтрофилом). Сравнивают полученные значения с нормой
ж. Оценка завершенности фагоцитоза по методу В.М. Бермана и Е.М.Славской.
В центрифужную пробирку с 5-10мл оксалата натрия и 0.5-1мл крови добавляют взвесь микроорганизмов и помещают в термостат при 370С на 30 минут. Затем несколько капель взвеси наносят в чашку Петри на подсушенный 2% питательный агар, втирают в поверхность агара стерильным шпателем и термостатируют при 370С (время инкубации устанавливают экспериментально). Затем готовят мазки-отпечатки, фиксируют смесью Никифорова и окрашивают по Романовскому-Гимзе. Считают показатель завершенного фагоцитоза (процент клеток с завершенным фагоцитозом на 100 просмотренных нейтрофилов).
