- •Лабораторна робота 1 Тема: Якісний аналіз органічних сполук
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Лабораторна робота 2 Тема: Методи добування та хімічні властивості алканів
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання до самостійної роботи
- •Лабораторна робота 3 Тема: Методи добування та властивості ненасичених вуглеводнів
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання до самостійної роботи
- •Лабораторна робота 4 Тема: Добування та хімічні властивості ацетиленових вуглеводнів
- •Теоретична частина
- •Експериментальна частина
- •Ацетилен пропускають через амонійний розчин монохлориду міді.
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання до самостійної роботи
- •Лабораторна робота 5 Тема: Хімічні властивості алкілгалогенідів Мета роботи: Вивчити хімічні властивості алкілгалогенідів, провести відповідні хімічні досліди.
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання до самостійної роботи
- •Лабораторна робота 6 Тема: Хімічні властивості спиртів
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання до самостійної роботи
- •Лабораторна робота 7 Тема: Методи добування та хімічні властивості альдегідів і кетонів
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання для самостійної роботи
- •Лабораторна робота 8 Тема роботи: Методи добування та хімічні властивості карбонових кислот
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання до самостійної роботи
- •Лабораторна робота 9 Тема: Методи добування та властивості амінів та α-амінокислот
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання до самостійної роботи
- •Лабораторна робота 10 Тема: Властивості вуглеводів Мета роботи: Вивчити хімічні властивості вуглеводів.
- •Теоретична частина
- •Експериментальна частина
- •Техніка безпеки
- •Контрольні запитання та завдання
- •Завдання до самостійної роботи
- •Література
Вступ
Методичні вказівки до лабораторних робіт з органічної хімії кредитного модуля «Ациклічні сполуки» містять опис дослідів з основних методів добування та хімічних властивостей органічних сполук різних класів. Проведення цих дослідів дає змогу студентам краще засвоїти теоре-тичний матеріал з органічної хімії, вивчити якісні реакції на відповідні функціональні групи, оволодіти прийомами роботи з органічними речовинами, формулювати висновки за результатами проведених дослідів, вивчити правила безпечної роботи в лабораторії. Методичні вказівки міс-тять також завдання для організації систематичної самостійної роботи студентів з певних розділів органічної хімії, що відповідають темам лабо-раторних робіт.
Під час підготовки до виконання лабораторної роботи студенти повинні опрацювати відповідні розділи теоретичного курсу з органічної хімії, підготувати протокол роботи, написати рівняння реакцій, дати відповіді на контрольні завдання та запитання, а також виконати завдання для самостійної підготовки.
Перед виконанням лабораторної роботи проводиться усне опитуван-ня студентів з загальних положень теоретичного курсу, з методики вико-нання дослідів та правил техніки безпеки. При виконанні дослідів студенти вносять до протоколу спостереження, у висновку узагальнюють результати проведених досліджень.
Після виконання дослідів захистом лабораторної роботи є написання контрольної роботи з відповідної теми. Контрольні роботи виконують не тільки контрольну функцію систематичного засвоєння знань, але є ета-пами підготовки студентів до модульних контрольних робіт з органічної хімії.
Лабораторна робота 1 Тема: Якісний аналіз органічних сполук
Мета роботи: Провести якісний аналіз запропонованих органічних сполук і довести наявність у цих сполуках атомів С, Н, N, S та галогенів.
Тривалість виконання: 4 год.
Теоретична частина
До складу органічних сполук входять атоми карбону, гідрогену, оксигену (найбільш поширені), а також атоми елементів N, S, Р , галогенів та ін.
Визначення елементного складу (якісного складу) сполуки грунтує-ться на її розкладі і подальшому аналізі продуктів руйнування. З цією метою найчастіше використовують реакцію повного окиснення або розклад органічної речовини до найпростіших сполук (часто неорганічних) при сплавленні з лужними металами. Отримані неорганічні сполуки ідентифікуються відповідними якісними реакціями. Для відкриття карбону та гідрогену органічну речовину спалюють у спеціальному приладі в присутності окисника, частіше за все оксиду міді (ІІ). Карбон органічної сполуки окиснюється до оксиду карбону (ІV), а гідроген – до води. Одержані продукти реакції – СО2 та Н2О – визначають якісними реакціями. Найпоширенішим методом відкриття нітрогену та сірки є прожарювання досліджуваної речовини з металічним натрієм. За цих умов речовина руйнується, присутній в ній нітроген реагує з карбоном і натрієм з утворенням NaCN, а сірка утворює Na2S. Аніони CN- та S-2 в розчині визначаються відповідними якісними реакціями.
Експериментальна частина
Дослід 1. Відкриття карбону та гідрогену
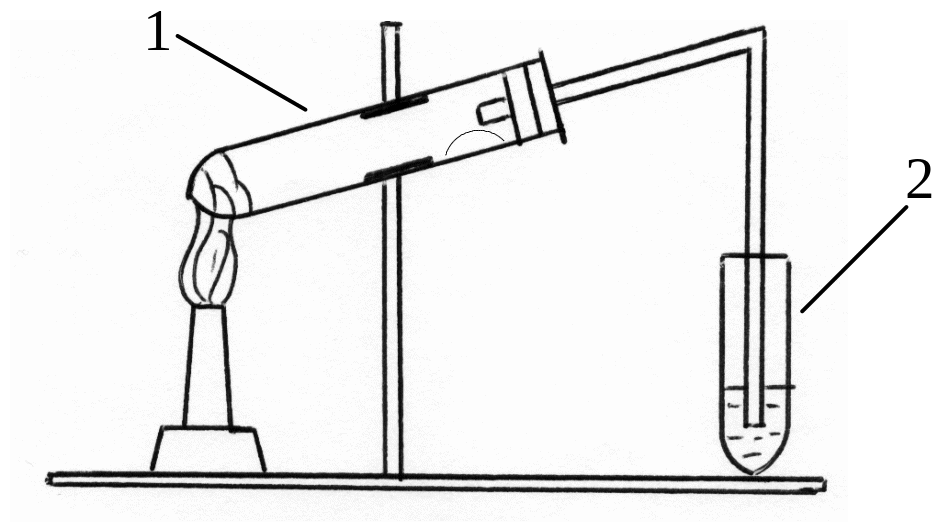
Для проведення досліду збирають прилад, який зображений на рис.1. В пробірку 1 поміщають суміш, що складається із 2 г оксиду міді (ІІ) (по-
Рис.1. |
рошок) та приблизно 0,25 г органічної речовини сахарози. Пробірку закріплюють у штативі дещо похило і вносять 0,25 г безводного сульфату міді (ІІ), розміщуючи йо-го недалеко від отвору. Пробірку щільно закривають пробкою з газовідвідною труб-кою, кінець якої занурюють в пробірку 2 |
з 2-3 мл баритової води (водного розчину Ва(ОН)2 ).Суміш у пробірці 1 нагрівають полум’ям газового пальника. При нагріванні органічна речо-вина (сахароза) руйнується, повністю згораючи. Реакція описується рівнянням:
С12Н22О12
+ 24 СuО![]() 12
СО2
+
11Н2О
+ 24 Сu.
12
СО2
+
11Н2О
+ 24 Сu.
Поява крапель води на стінках пробірки 1 та посиніння сульфату міді (утворюється кристалогідрат CuSO4.5Н2О) свідчить про наявність гідрогену в сахарозі. У пробірці 2 спостерігається поява каламуті.
Спостереження:
Рівняння реакції:
Дослід 2. Відкриття нітрогену реакцією Ласеня
(Дослід проводять у витяжній шафі в захисних окулярах.)
До сухої пробірки засипають 0,2-0,3 г досліджуваної речовини, на-приклад, альбуміну та додають невеликий шматочок металічного натрію, висушеного фільтровальним папером та очищеного від оксидної плівки. Пробірку нагрівають у полум’ї пальника до червоного жару, тримаючи дерев’яним затискачем. Досліджувана речовина розкладається, нітроген і сірка утворюють ціанід та сульфід натрію. У порцелянову чашку нали-вають 10 мл дистильованої води і занурюють розжарений кінець пробірки у воду. Пробірка розтріскується, вміст її розчиняється у воді. Утворений розчин фільтрують від шматочків скла та вугілля. Фільтрат розливають рівними частинами у три пробірки. У першій пробірці визначають нітроген, додавши кілька кристаликів сульфату заліза (ІІ) FeSO4, потім кілька крапель розчину хлориду заліза (ІІІ) FeCl3 та 1 %-ої соляної кислоти до слабкокислої реакції. Утворюється синій осад берлінської блакиті, розчин забарвлюється у блакитний або синьо-зелений колір, що свідчить про наявність нітрогену в досліджуваній речовині. Якісну реакцію можна описати рівняннями:
Na + C + N = NaCN
6 NaCN + FeSO4 = Na4[Fe(CN)6] + Na2SO4
3 Na4[Fe(CN)6] + FeCl3 = Fe4[Fe(CN)6]3 + 12 NaCl
Дослід 3. Відкриття сірки
У двох частинах фільтрату, що залишились від досліду 2, від-кривають сірку.
а) До другої частини фільтрату з досліду 2 додають кілька крапель 1 %-го свіжоприготованого розчину нітропрусиду натрію. З’являється червоно-фіалкове забарвлення, яке свідчить про наявність у розчині сульфід-аніона. Забарвлення зумовлене утворенням комплексної солі:
Na2[Fe(CN)5NO] + Na2S = Na4[Fe(CN)5(NO)S]
б) До третьої частини фільтрату з досліду 2 додають 1 мл 5 %-го розчину ацетату свинцю та підкислюють розведеною оцтовою кислотою. Утворюється осад сульфіду свинцю.
Спостереження:
Рівняння реакції:
Дослід 4. Відкриття галоїдів. Проба Бельштейна
Для відкриття галоїдів часто використовують пробу на забарвлення полум’я, запропоновану Ф.Бельштейном. Реакцію можна застосовувати для всіх класів галогеновмісних органічних сполук.
Мідну спіраль, що зроблено з тонкого дроту, прожарюють в полум’ї пальника до зникнення забарвленя полум’я та утворення на її поверхні оксидної плівки. Після охолодження спіраль змочують невеликою кіль-кістю досліджуваної речовини, що містить галоген, наприклад, хлоро-формом, і знову вносять в полум’я пальника. Спочатку хлороформ згорає, полум’я стає кіптявим, а далі забарвлюється в яскраво-зелений або синювато-зелений колір парами галоїдних сполук міді, що утворилися.
Спостереження:
Висновок :