
- •Часть I
- •1. Введение
- •1.1. Углерод
- •1.2. Органические соединения
- •1.3.Значение органической химии
- •Иллюстрация
- •1.4. Контрольные вопросы
- •2. Основы теории строения
- •2.1. Основные положения теории химического строения а.М.Бутлерова
- •2.1.1. Формулы строения
- •2.1.2. Понятие о изомерии
- •2.1.2.1. Структурные изомеры
- •2.1.2.2. Стереоизомеры
- •2.2. Электронные представления в органической химии
- •2.2.1. Свойства электрона
- •2.2.2. Атомные орбитали
- •2.2.3. Форма и энергия атомных орбиталей
- •2.2.4. Заполнение атомных орбиталей электронами
- •2.3. Контрольные вопросы
- •1. Какое из положений теории а.М. Бутлерова объясняет различие в реакциях соединений одинакового состава:
- •2. Изомерами называются . . .
- •3.1. Электроотрицательность элементов
- •3.2. Основные типы химических связей
- •3.2.1. Ионная связь
- •3.2.2. Ковалентная связь
- •3.2.2.1. Свойства ковалентной связи
- •3.2.2.2. Характеристики ковалентной связи
- •3.2.2.3. Неполярная ковалентная связь
- •3.2.2.4. Полярная ковалентная связь
- •3.3. Контрольные вопросы
- •2. Как изменяется электроотрицательность элементов в Периодической системе?
- •4. Природа кoвалентной связи
- •4.1. Как взаимодействуют атомные орбитали при образовании молекул?
- •4.2. Молекулярные орбитали
- •4.2.1. Энергия молекулярных орбиталей
- •Влияние несвязывающих молекулярных орбиталей (нсмо) на форму молекул
- •4.2.2.Форма молекулярных орбиталей. - и -мо
- •4.3. Гибридизация атомных орбиталей
- •Vrml-модель (109 822 байт).
- •Vrml-модель (2 камеры, 109 300 байт).
- •Vrml-модель (108 646 байт).
- •4.3.4. Энергия гибридных атомных орбиталей
- •4.4. Моделирование атомных и молекулярных орбиталей с использованием прикладных программ
- •4.5. Механизмы образования ковалентной связи
- •4.6. Донорно-акцепторные связи
- •4.7. Кратные связи
- •4.8. Электронные формулы молекул
- •4.9. Атомно-орбитальные модели
- •4.10. Делокализованные -связи. Сопряжение
- •4.11. Водородные связи (н-связи)
- •Почему связи типа водородных не образуют атомы других элементов?
- •4.11.2. Влияние водородных связей на свойства веществ
- •4.12. Контрольные вопросы
- •9. Укажите тип гибридизации атомов углерода в молекуле:
- •5.1. Классификация соединений по строению углеродной цепи
- •5.2. Классификация соединений по функциональным группам
- •5.3. Контрольные вопросы
- •6. Типы органических реакций
- •6.1. Основные понятия. Химическая реакция
- •6.1.1. Скорость реакции
- •6.1.2. Энергия активации
- •6.1.3. Тепловой эффект реакции
- •6.1.4. Химическое равновесие
- •6.1.5. Катализ
- •6.2. Отличительные особенности органических реакций
- •6.3. Понятие о механизме химической реакции
- •6.4. Классификация органических реакций
- •6.4.1. Классификация реакций по конечному результату
- •6.4.2. Классификация реакций по числу частиц, участвующих в элементарной стадии
- •6.4.3. Классификация реакций по механизму разрыва связей
- •Примеры нуклеофильных реакций
- •Является . . .
- •Панели управления Cosmo Player Панель 1 Панель 2
2. Основы теории строения
Основой современной органической химии является ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, созданная на базе теории химического строения А.М. Бутлерова и электронных (квантовохимических) представлений о строении атома и природе химической связи.
Современная теория строения позволяет предсказывать основные химические и физические свойства органических соединений, исходя из их химического, пространственного и электронного строения.
Теория строения играет ключевую роль в изучении и систематизации огромного фактического материала органической химии.
2.1. Основные положения теории химического строения а.М.Бутлерова
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
Свойства веществ зависят от их химического строения.
По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
2.1.1. Формулы строения
Формула строения (структурная формула) описывает порядок соединения атомов в молекуле, т.е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывается (такие формулы называются сокращенными структурными). Например, полная и сокращенная структурные формулы изо-бутана C4H10 имеют вид:
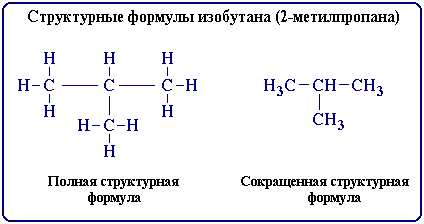
Структурные формулы отличаются от молекулярных (брутто) формул, которые показывают только, какие элементы и в каком соотношении входят в состав вещества (т.е. качественный и количественный элементный состав), но не отражают порядка связывания атомов. Например, н-бутан и изобутан имеют одну молекулярную формулу C4H10, но разную последовательность связей . Таким образом, различие веществ обусловлено не только разным качественным и количественным элементным составом, но и разным химическим строением, которое можно отразить лишь структурными формулами.
2.1.2. Понятие о изомерии
Еще до создания теории строения были известны вещества одинакового элементного состава, но c разными свойствами. Такие вещества были названы изомерами, а само это явление - изомерией.
В основе изомерии, как показал А.М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов. Таким образом,
изомерия - это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства.
Например, при содержании в молекуле 4-х атомов углерода и 10-ти атомов водорода возможно существование 2-х изомерных соединений:
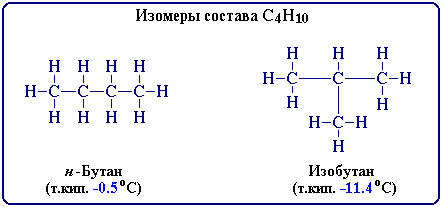
В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию.
