
- •Часть I
- •1. Введение
- •1.1. Углерод
- •1.2. Органические соединения
- •1.3.Значение органической химии
- •Иллюстрация
- •1.4. Контрольные вопросы
- •2. Основы теории строения
- •2.1. Основные положения теории химического строения а.М.Бутлерова
- •2.1.1. Формулы строения
- •2.1.2. Понятие о изомерии
- •2.1.2.1. Структурные изомеры
- •2.1.2.2. Стереоизомеры
- •2.2. Электронные представления в органической химии
- •2.2.1. Свойства электрона
- •2.2.2. Атомные орбитали
- •2.2.3. Форма и энергия атомных орбиталей
- •2.2.4. Заполнение атомных орбиталей электронами
- •2.3. Контрольные вопросы
- •1. Какое из положений теории а.М. Бутлерова объясняет различие в реакциях соединений одинакового состава:
- •2. Изомерами называются . . .
- •3.1. Электроотрицательность элементов
- •3.2. Основные типы химических связей
- •3.2.1. Ионная связь
- •3.2.2. Ковалентная связь
- •3.2.2.1. Свойства ковалентной связи
- •3.2.2.2. Характеристики ковалентной связи
- •3.2.2.3. Неполярная ковалентная связь
- •3.2.2.4. Полярная ковалентная связь
- •3.3. Контрольные вопросы
- •2. Как изменяется электроотрицательность элементов в Периодической системе?
- •4. Природа кoвалентной связи
- •4.1. Как взаимодействуют атомные орбитали при образовании молекул?
- •4.2. Молекулярные орбитали
- •4.2.1. Энергия молекулярных орбиталей
- •Влияние несвязывающих молекулярных орбиталей (нсмо) на форму молекул
- •4.2.2.Форма молекулярных орбиталей. - и -мо
- •4.3. Гибридизация атомных орбиталей
- •Vrml-модель (109 822 байт).
- •Vrml-модель (2 камеры, 109 300 байт).
- •Vrml-модель (108 646 байт).
- •4.3.4. Энергия гибридных атомных орбиталей
- •4.4. Моделирование атомных и молекулярных орбиталей с использованием прикладных программ
- •4.5. Механизмы образования ковалентной связи
- •4.6. Донорно-акцепторные связи
- •4.7. Кратные связи
- •4.8. Электронные формулы молекул
- •4.9. Атомно-орбитальные модели
- •4.10. Делокализованные -связи. Сопряжение
- •4.11. Водородные связи (н-связи)
- •Почему связи типа водородных не образуют атомы других элементов?
- •4.11.2. Влияние водородных связей на свойства веществ
- •4.12. Контрольные вопросы
- •9. Укажите тип гибридизации атомов углерода в молекуле:
- •5.1. Классификация соединений по строению углеродной цепи
- •5.2. Классификация соединений по функциональным группам
- •5.3. Контрольные вопросы
- •6. Типы органических реакций
- •6.1. Основные понятия. Химическая реакция
- •6.1.1. Скорость реакции
- •6.1.2. Энергия активации
- •6.1.3. Тепловой эффект реакции
- •6.1.4. Химическое равновесие
- •6.1.5. Катализ
- •6.2. Отличительные особенности органических реакций
- •6.3. Понятие о механизме химической реакции
- •6.4. Классификация органических реакций
- •6.4.1. Классификация реакций по конечному результату
- •6.4.2. Классификация реакций по числу частиц, участвующих в элементарной стадии
- •6.4.3. Классификация реакций по механизму разрыва связей
- •Примеры нуклеофильных реакций
- •Является . . .
- •Панели управления Cosmo Player Панель 1 Панель 2
4.10. Делокализованные -связи. Сопряжение
Ковалентная связь считается локализованной, если ее электронная пара находится в поле двух ядер и связывает только два атома. Делокализованная связь - связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов (подобие металлической связи). Такая делокализация (рассредоточение) электронов характерна для сопряженных -связей, т.е. кратных связей, чередующихся с одинарными.
Сопряженная система: |
|
Несопряженная система: |
CH2=CHCH=CH2 |
|
CH2=CHСН2CH=CH2 |
делокализованные -связи |
|
локализованные -связи |
Рассредоточение электронов - энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы. Необходимым условием делокализации -электронов является -перекрывание р-АО соседних sp2- или sp-атомов, лежащих в одной плоскости. С помощью атомно-орбитальной модели можно показать, как происходит делокализация -связей в молекуле бутадиена:

Делокализация -электронов приводит к тому, что в сопряженной системе связи становятся нецелочисленными (дробными), т.е. ни двойными или тройными, ни одинарными. Иначе говоря, связи имеют нецелочисленный порядок (см. раздел 4.7).
Примеры соединений с делокализованными связями: бензол (анимация, 33 175 байт), другие органические соединения:

Система сопряжeния может быть открытой или замкнутой (рисунок) и содержать атом (C, N, O, S, Cl и т.д.) с неподеленной электронной парой (I, II), с неспаренным электроном (III) или с вакантной р-АО (IV):

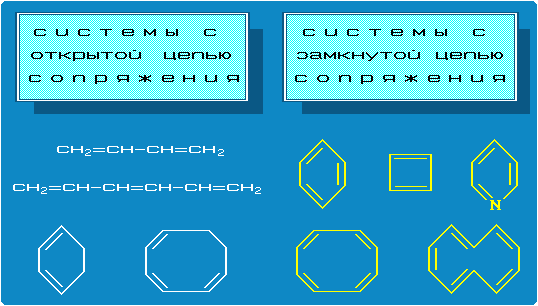
 Аним.
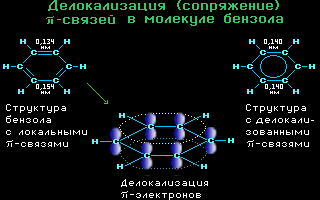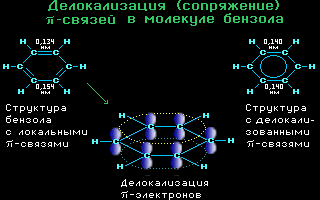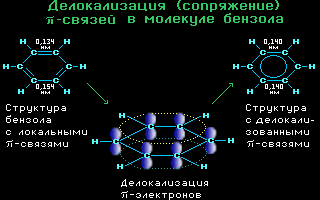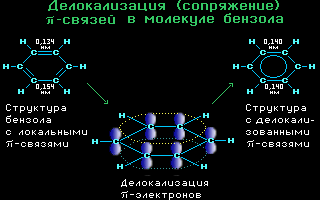
4.10. Делокализация -связей
в молекуле бензола C6H6
Аним.
4.10. Делокализация -связей
в молекуле бензола C6H6
4.11. Водородные связи (н-связи)
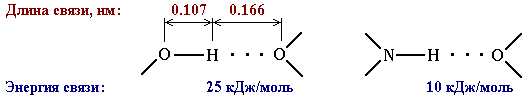
Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), испытывает недостаток электронов и поэтому способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома этой же или другой молекулы. В результате возникает водородная связь, которая графически обозначается тремя точками:
![]()
Эта связь значительно слабее других химических связей (энергия ее образования 10-40 кДж/моль) и в основном определяется электростатическим и донорно-акцепторным взаимодействиями.
Н-связи влияют на физические и химические свойства вещества.
Почему связи типа водородных не образуют атомы других элементов?
Это объясняется тем, силы электростатического притяжения разноименных концов диполей полярных связей (О-Н, N-H и т.п.) довольно слабы и действуют лишь на малых расстояниях. Водород, обладая наименьшим атомным радиусом, позволяет сблизиться таким диполям настолько, что силы притяжения становятся заметными. Никакой другой элемент с большим атомным радиусом не способен к образованию подобных связей.
4.11.1. Образование водородных связей (на примере спиртов)
В молекуле спирта R-O-H химическая связь между атомом водорода и более электроотрицательным атомом кислорода весьма полярна. Водород имеет частичный положительный заряд (+), а кислород - частичный отрицательный (-):
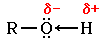
R - углеводородный радикал (CH3, C2H5 и т.п.)
Следовательно, возможно образование водородных связей между молекулами спирта:
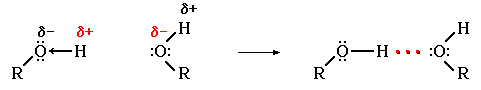
Это приводит к ассоциации молекул и объясняет относительно высокую т.кип. спиртов.

В присутствии воды возникают водородные связи между молекулами спирта и воды:

Поэтому низшие спирты хорошо растворимы в воде.
