
ЧАСТЬ А
1). Аминокислоты – это органические соединения, в молекуле которых одно¬временно присутствуют основная ами¬ногруппа (NH2) и кислая карбок¬сильная группа (СООН). К настоя¬щему времени описано около 200 при¬родных аминокислот, выделенных из животного и растительного материала. Все природные амино-кислоты делят на две группы: п р о т е и н о г е н н ы е, или белко-вые (обнаружены только в белках) и н е п р о т е и н о г е н н ы е, или небелковые ( в белках не обнару¬жены). 1. Протеиногенные аминокис¬лоты. Аминокислоты, обнаруженные в белках, можно классифицировать по разным признакам. По строению боко¬вой цепи (R-группы) различают алифа¬тические, ароматические и гетероцик¬лические аминокислоты, по числу аминных и кар-боксильных групп - мо¬ноаминомонокарбоновые (одна NH2-группа и одна СООН-группа), диами¬номонокарбоновые (две NH2 -группы и одна СООН-группа), моноаминодикар¬боновые (одна NH2 -группа и две СООН-группы), по положению изо-электрической точки - нейтральные, основные и кислые. Аминокислоты, содержащие в радикалах ОН - группы, называют гидроксиаминокислотами, а содержащие серу - серосодержащими кислотами. По способности к синтезу в животном организме биохимики делят аминокислоты на заменимые и незаме¬нимые. Аминокислоты, содержащие NH-группы вместо NH2 - групп, назы¬вают иминокислотами.По полярности R-групп, т.е. способно¬сти R-групп к взаимодей-ствию с водой при соответствующих внутриклеточных условиях рН (рН вблизи 7,0) , амино¬кислоты делят на четыре группы: с не-полярными или гидрофобными R-груп¬пами, полярными, но не заряженными R-группами, отрицательно заряжен¬ными R-группами и положительно за¬ряженными R-группами. Рассмотрим строение аминокислот этих групп. Рас¬тения и некоторые микроорганизмы могут синтезировать все аминокислоты, нужные им для построения клеточных белков. Животный организм способен синтезировать только около половины аминокислот, необходимых ему для построения белков своего тела. Эти аминокислоты получили название з а м е н и м ы е. Остальные десять протеиногенных аминокислот живот¬ные организмы синтезировать не могут и должны получать их с пищей. Эти аминокислоты называют н е з а м е н и м ы м и или о б я з а т е л ь н ы м и. К ним принадлежат: валин, изолейцин, метионин, лейцин, лизин, треонин, триптофан, фенилаланин, аргинин и гистидин. Отсутствие или недостаток в пище каких-либо незаменимых амино¬кислот приводит к угрожающим жизни явлениям (задержка роста, расстройство биосинтеза белков, возникновение за¬болеваний и т.п.).Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.Данную особенность «живых» аминокислот весьма трудно объяснить, так как в реакциях между оптически неактивными веществами L и D-формы образуются в одинаковых количествах. Возможно, выбор одной из форм (L или D) — просто результат случайного стечения обстоятельств: первые молекулы, с которых смог начаться матричный синтез, обладали определенной формой, и именно к ним «приспособились» соответствующие ферменты.Физические свойства аминокислот: Растворимы в воде (лучше растворимы положительно- и отрицательно заряженные аминокислоты, затем гидрофиль-ные, хуже – гидрофобные).Имеют высокую точку плавления (обусловлено тем, что в кристаллическом виде находятся в виде биполярных ионов). Обладают оптической активностью, которая обусловлена наличием асимметрического атома углерода (за исключением гли). В связи с этим аминокислоты:существуют в виде L- и D-стереоизомеров, но в состав белков высших животных входят в основном аминокислоты L-ряда; количество стереоизомеров зависит от количества асимметрических атомов углерода и рассчитывается по формуле 2n, где n – кол-во асимметрических атомов С;способны вращать плоскость поляризованного света вправо или влево; величина удельного вращения у разных аминокислот варьирует от 10 до 30о. Амфотерные свойства (аминокислоты, кроме гли, при физиологических значениях рН и в кристаллическом виде находятся в виде биполярных ионов). Величина рН, при которой суммарный заряд аминокислоты равен 0, называется изоэлектрической точкой. Для моноаминомонокарбоновых аминокислот она лежит в интервале 5,5-6,3, диаминомоно-карбоновых – больше 7, для дикарбоновых меньше 7.Химические свойства:кислотные свойства, обусловленные наличием карбок-сильной группы, основные свойства, обусловленные наличием амино-группы,свойства, обусловленные взаимодействием аминогруппы и карбоксильной между собой, свойства, обусловленные наличием функциональных групп в боковой цепи.
2) Кислотно-основные свойства аминокислот связаны с наличием в их структуре двух ионизируемых групп-карбоксильной и аминогруппы, поэтому амнокислоты могут проявлять свойства как кислот, так и оснований, т.е. они являются амфотерными соединениями. В кристаллическом состоянии и в водных растворах a-аминокислоты существуют в виде биполярных ионов, называемых также цвиттерионами. Ионное строение обуславливает некоторые особенности свойств a-аминокислот: высокую температуру плавления (200-300°С), нелетучесть, растворимость в воде и нерастворимость в неполярных органических растворителях. С растворимостью аминокислот в воде связана их всасываемость и транспорт в организме. Ионизация молекул аминокислот зависит от рН раствора. Для моноаминомонокарбоновых кислот процесс диссоциации имеет следующий вид:
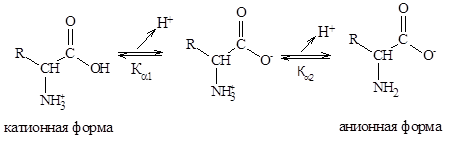
При значении рН, превышающем изоэлектрическую точку, аминокислота заряжается отрицательно, а при значении рН ниже рI аминокислота несет суммарный положительный заряд. Например, при рН = 1,0 все молекулы аланина существуют в форме ионовс суммарным зарядом +1. При рН = 2,34, когда имеется смесь равных количеств ионов суммарный заряд = +0,5. Аналогичным образом можно предсказать знак и величину суммарного заряда для любой другой аминокислоты при любом значении рН.Аминокислоты с ионизируемой группой в радикале имеют более сложные кривые титрования, складывающиеся из 3-ох участков, соответствующих трем возможным стадиям ионизации, и, следовательно, они имеют три значения рК (рКa1, рКa2 и рКR). Кислотно-основные свойства аминокислот используются для разделения и последующей идентификации аминокислот методами электрофореза и ионообменной хроматографии. Оба эти метода основаны на различиях в знаке и величине суммарного электрического заряда при данном значении рН.
3) Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е. являются амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония: H2N–CH2–COOH + HCl ® Cl- [H3N–CH2–COOH]+.Как карбоновые кислоты они образуют функциональные производные:
а) соли
H2N–CH2–COOH + NaOH ® H2N–CH2–COO- Na+ + H2O
б) сложные эфиры
Амфотерные свойства аминокислот обусловливают то, что в растворах аминокислоты могут действовать как кислотно-основные буферные системы, компенсирующие изменения кислотности (щёлочности) раствора, характеризуемой pH. При добавлении в раствор аминокислот щёлочи, то есть при повышении pH аминокислоты являются донорами катионов, например H+, (и/или акцепторами анионов и/или электронов). При этом аминокислоты отдают катионы водорода, приобретают отрицательный заряд. В электрическом поле такая заряженная аминокислота будет перемещаться к положительному электроду (аноду). При добавлении в раствор кислоты, то есть при понижении pH аминокислоты являются акцепторами катионов, например H+, (и/или донорами анионов и/или электронов). При этом аминокислоты присоединяют катионы водорода, приобретают положительный заряд. В электрическом поле такая заряженная аминокислота будет перемещаться к отрицательному электроду (катоду). В результате при любом изменении кислотности (щелочности) буферного раствора аминокислота восстанавливает исходный уровень pH, компенсируя внешнее влияние на раствор щелочи или кислоты. Её суммарный заряд опять становится нейтральным.
|
Группа аминокислот |
Функциональные группы |
Аминокислоты | |||
|
Гидрофильные, полярные | |||||
|
Кислые (отрицательно заряженные при рН≈7,4)
|
Карбоксильная группа |
-СОО- |
Аспарагиновая Глутаминовая |
Asp Glu | |
|
Основные (положительно заряженные при рН≈7,4)
|
Аминогруппа |
-NH3+ |
Лизин Аргинин Гистидин |
Lys Arg His | |
|
Нейтральные |
Тиольная группа
|
-SH |
Цистеин |
Cys | |
|
|
Гидроксильная группа |
-ОН |
Серин Треонин Тирозин |
Ser Thr Tyr | |
|
|
Амиды |
-CONH2 |
Аспарагин Глутамин |
Asn Gln | |
|
Гидрофобные, неполярные | |||||
|
Алифатические |
-CH2- |
Аланин Валин Лейцин Изолейцин Метионин |
Ala Val Leu Ile Met | ||
|
Ароматические |
-C6H5- |
Фенилаланин Триптофан *(Тирозин |
Phe Trp Tyr) | ||
|
Другие |
Иминокислота |
Пролин Глицин |
Pro Gly | ||
4)Гомоциклические (ароматические) аминокислоты
К числу гомоциклических аминокислот принадлежат две кислоты: тирозин (параоксифенилаланин) и фенилаланин. Эти кислоты играют важную роль в организме.
ГЕТЕРОЦИКЛИЧЕСКИЕ АМИНОКИСЛОТЫ
В ряду гетероциклических аминокислот встречаются следующие: пролин, оксипролин, гистидин, триптофан. Пролин и оксипролин содержат в своем составе гетероцикл — пир-ролидин, гистидин — имидазол, а триптофан - индол. Пролин и оксипролин встречаются в больших количествах в белках соединительной ткани — коллагенах. Гистидин и триптофан встречаются в небольших количествах в белках как животного, так и растительного происхождения, придавая им полноценность, так как эти аминокислоты весьма необходимы для организма.Мы рассмотрели строение аминокислот, которые получаются в результате гидролиза белковых веществ. Некоторые из этих аминокислот считаются незаменимыми, так как они не могут синтезироваться в организме человека и должны быть обязательно доставлены с пищей. К числу незаменимых аминокислот относятся триптофан, фенилаланин, треонин, метионин, лизин, валин, лейцин, изолейцин.В растениях имеются значительно больше аминокислот, они разделяются на протеиногенные и непротеиногенные, не встречающиеся в белках. К числу таких аминокислот относятся B-аланин, а-аминомасляная, а-аминовалериановая (норвалин), а-аминокап-роновая (норлейцин) и др.Аминокислоты, входящие в состав белков, можно выявить при помощи универсальной цветной реакции с нингидрином. В присутствии этого соединения все аминокислоты дают синее окрашивание, чем и пользуются для проявления аминокислот при хроматографическом анализе. Кроме того, имеются цветные реакции на отдельные аминокислоты: реактив Миллона на тирозин (смесь солей окиси и закиси ртути), реактив Адамкевича на триптофан (смесь глиоксиловой и серной кислот), реактив Фоля на цистеин (уксуснокислый свинец в щелочной среде), реактив Паули на гистидин (сульфоновая и азотная кислоты) и др. К важнейшим из них относятся: биуретовая реакция (пептид¬ные связи), ксантопротеиновая реакция (ароматические ядра остатковтирозина, триптофана, фенилаланина), Адамке¬вича реакция (индольное кольцо трип¬тофана), Миллона реакция (фенольный радикал тирозина), Паули реакция (имидазольное кольцо гистидина), Са¬кагучи реакция (гуанидиновая группа аргинина) и нингидриновая реакция (аминограппа).
5) Свойства пептидов
Пептиды постоянно синтезируются во всех живых организмах для регулирования физиологических процессов. Свойства пептидов зависят, главным образом, от их первичной структуры — последовательности аминокислот, а также от строения молекулы и её конфигурации в пространстве (вторичная структура).
Классификация пептидов и строение пептидной цепочки
Молекула пептида — это последовательность аминокислот: два и более аминокислотных остатка, соединённых между собой амидной связью, составляют пептид. Количество аминокислот в пептиде может сильно варьировать. И в соответствии с их количеством различают:
- олигопептиды — молекулы, содержащие до десяти аминокислотных остатков; иногда в их названии упоминается количество входящих в их состав аминокислот, например, дипептид, трипептид, пентапептид и др.;
-полипептиды — молекулы, в состав которых входит более десяти аминокислот.
Соединения, содержащие более ста аминокислотных остатков, обычно называются белками. Однако это деление условно, некоторые молекулы, например, гормон глюкагон, содержащий лишь двадцать девять аминокислот, называют белковым гормоном. По качественному составу различают:
- гомомерные пептиды — соединения, состоящие только из аминокислотных остатков;
- гетеромерные пептиды — вещества, в состав которых входят также небелковые компоненты.
Пептиды также делятся по способу связи аминокислот между собой:
- гомодетные — пептиды, аминокислотные остатки которых соединены только пептидными связями;
- гетеродетные пептиды — те соединения, в которых помимо пептидных связей встречаются ещё и дисульфидные, эфирные и тиоэфирные связи.
Цепочка повторяющихся атомов называется пептидным остовом: (—NH—CH—OC—). Участок (—CH—) с аминокислотным радикалом образует соединение (—NH—C(R1)H—OC—), называемое аминокислотным остатком. N-концевой аминокислотный остаток имеет свободную α-аминогруппу (—NH), в то время как у C-концевого аминокислотного остатка свободной является α-карбоксильная группа (OC—). Пептиды различаются не только по аминокислотному составу, но и по количеству, а также расположению и соединению аминокислотных остатков в полипептидную цепочку. Пример: Про-Сер-Про-Ала-Гис и Гис-Ала-Про-Сер-Про Несмотря на одинаковый количественный и качественный состав, эти пептиды имеют совершенно разные свойства.
Пептидная связь
Пептидная (амидная) связь — это вид химической связи, которая возникает вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты. Амидная связь очень прочная, и в нормальных клеточных условиях (37 °C, нейтральный ph) самопроизвольно не разрывается. Пептидная связь разрушается при действии на неё специальных протеолитических ферментов (протеаз, пептидгидролаз).
Значение
Пептидные гормоны и нейропептиды, например, регулируют большинство процессов организма человека, в том числе, и принимают участие в процессах регенерации клеток. Пептиды иммунологического действия защищают организм от попавших в него токсинов. Для правильной работы клеток и тканей необходимо адекватное количество пептидов. Однако с возрастом и при патологии возникает дефицит пептидов, который существенно ускоряет износ тканей, что приводит к старению всего организма. Сегодня проблему недостаточности пептидов в организме научились решать. Пептидный пул клетки восполняют синтезированными в лабораторных условиях короткими пептидами.
OOO

Нконец-Н2N-CH-C-NH-CH-C-NH-CH-C-OH-КонецС
пептидная связь
(CH2)2
CH3(CH2)5
C=0
NH2
NH2
6),7)Структура белка.
Последовательность расположения аминокислотных остатков в полипептидной цепи белковой молекулы получила название первичной структуры белка. Многократно повторяющаяся пептидная связь (-СО-NH) является типичной ковалентной связью, которая определяет первичную структуру белка. Первичная структура белка, помимо большого числа пептидных связей, обычно содержит также небольшое число дисульфидных (-S-S-) связей. Пространственная конфигурация полипептидной цепи, точнее тип полипептидной спирали, определяет вторичную структуру белка, она представлена в основном α-спиралью, которая фиксирована водородными связями. Однако оказалось, что в растворах белка спирализованная полипептидная цепочка может принимать ту или иную конфигурацию. Эта конфигурация полипептидной спирали в пространстве определяет ее третичную структуру. Другими словами, третичная структура показывает, как полипептидная цепь, свернутая целиком или частично в спираль, расположена или упакована в пространстве (в глобуле). Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальность конформации для каждого белка определяется его первичной структурой. В белках различают два уровня конформации пептидной цепи - вторичную и третичную структуру. Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: C=O....HN. Пептид стремится принять конформацию с максимумом водородных связей. Однако возможность их образования ограничивается тем, что пептидная связь имеет частично двойной характер, поэтому вращение вокруг нее затруднено. Пептидная цепь приобретает не произвольную, а строго определенную конформацию, фиксируемую водородными связями.Известны несколько способов укладки полипептидной цепи: a -спираль - образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и CO-группой четвертого от нее остатка; b -структура (складчатый лист) - образуется межцепочечными водородными связями или связями между участками одной полипептидной цепи изогнутой в обратном направлении; беспорядочный клубок - это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также строго обусловлена аминокислотной последовательностью. Содержание a -спиралей и b -структур в разных белках различно: у фибриллярных белков - только a -спираль или только b -складчатый лист; а у глобулярных белков - отдельные фрагменты полипептидной цепи: либо a -спираль, либо b -складчатый лист, либо беспорядочный клубок. Известная стабильность третичной структуры белка обеспечивается за счет водородных связей, межмолекулярных ван-дер-ваальсовых сил, электростатического взаимодействия заряженных групп и т д. Молекулы некоторых белков (например, гемоглобина) состоят из нескольких симметрично построенных частиц (одинаковых полипептидных цепей), обладающих одинаковой первичной, вторичной и третичной структурой. Совокупность таких одинаковых частиц (субъединиц), представляющая единое молекулярное образование в структурном и функциональном отношении, получила название четвертичной структуры белка. Успехи в изучении вторичной и третичной структуры белковой молекулы были достигнуты в результате применения физико-химических и особенно физических методов исследования, в частности рентгеноструктурного анализа, с использованием аппаратуры с высокой разрешающей силой и электронных счетно-решающих устройств. На основании этих данных были построено пространственные модели ряда белков, например миоглобина.Аминокислоты соединяются между собой пептидной связью с образованием пептидов и белков (n≥50).Характеристика пептидной связи. Пептидная связь плоская (копланарная). Связь С–N напоминает двойную связь (вращение невозможно) из-за сопряжение
свободной пары электронов атома азота с электронами двойной связи С=О. Пептидная связь определяет остов (хребет) первичной структуры белковой молекулы ипридает ему жесткость.
Методы изучения
Седиментационный анализ (центрифугирование) позволяет делить белки по размерам, различая белки по значению их константы седиментации, измеряемой в сведбергах и обозначаемых большой буквой S.
Методы количественного определения белков
Для определения количества белка в образце используется ряд методик:
Биуретовый метод
Микробиуретовый метод
Метод Бредфорда
Метод Лоури
Спектрофотометрический метод
8) Первичная структура белков – это последовательность аминокислот (число
которых может достигать несколько сотен и даже тысяч) в полипептидной
цепочке каждого белка.
Первичная структура стабилизируется ковалентными связями: пептидной, а в
некоторых пептидах и дисульфидной. Разрушение ковалентных связей первичной
структуры – гидролиз: 1) кислотный – в 6 н НС1, 100-110°С, 24 ч; 2) ферментатив-
ный – с помощью протеолитических ферментов в желудке при рН 1,5-5,0, в двена-
дцатиперстной кишке при рН 8,6. • Первичная структура белка является основной для формирования последующих структур белка за счет взаимодействия радикалов аминокислотных остатков полипептидной цепи. • Замена аминокислоты L-ряда на аминокислоту D-ряда или замена даже одной L-аминокислоты на другую может привести к полному исчезновению биологической активности пептида.
Вторичная структура представляет собой способ упаковки аминокислотной
цепочки в более компактную структуру. Вторичная структура получается в ре-
зультате образования водородных мостиков внутри макромолекулы или между
различными макромолекулами. Различают ά-спираль, β-структуру и неупорядочен-
ную конформацию (клубок).
9)Третичная структура – конформация полипептидной цепи в целом (т.е. располо-
жение в трехмерном пространстве). Третичную структуру стабилизируют связи
взаимодействия между радикалами аминокислотных остатков полипептидной цепи:
ковалентная – дисульфидная связь, а также водородная, ионная связи и гидрофобное
взаимодействие. Третичная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
-ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
-ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
-водородные связи;
-гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул. Четвертичная структура белков — способ укладки в пространстве нескольких по-
липептидных цепей, обладающих первичной, вторичной и третичной структурами, с
формированием единого макромолекулярного образования для выполнения опреде-
ленной функции. Четвертичной структурой обладают белки с молекулярной массой бо-
лее 50 000.
фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура). Нативная структура белка. Многие белки в третичной структуре имеют спирализованные, складчатые и неупорядоченные сегменты. При этом в функциональном и
структурном отношениях важно взаимное расположение аминокислотных радикалов.
Для выполнения функции белок должен иметь определенную и часто единственную
третичную структуру (конформацию) – нативную структуру. Механизм сворачивания белков до конца не изучен. Экспериментальное определение трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная последовательность белка обычно известна. Поэтому учёные пытаются использовать различные биофизические методы, чтобы предсказать пространственную структуру белка из его первичной аминокислотной последовательности.
10) Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул. Четвертичная структура белков — способ укладки в пространстве нескольких полипептидных цепей, обладающих первичной, вторичной и третичной структурами, с
формированием единого макромолекулярного образования для выполнения опреде-
ленной функции. Четвертичной структурой обладают белки с молекулярной массой бо-
лее 50 000.
Многие белки имеют в своем составе несколько полипептидных цепей. Такие белки называют олигомерными, а отдельные цепи — протомерами.
Протомеры в олигомерном белке соединены множеством слабых, нековалентных связей (гидрофобных, ионных, водородных).Взаимодействие протомеров осуществляется благодаря комплементарности их контактирующих поверхностей. Гемоглобин — олигомерный белок, функция которого регулируется различными лигандами.Также олигомерные ферменты:лактатдегидрогеназа,фосфорилаза.
надмолекулярные белковые комплексы: Белковые цепи, которые входят в состав белка с четвертичной структурой, лишь после окончания синтеза образуют надмолекулярную структуру. Сложную молекулу, где полипептидные цепи соединены дисульфидными мостиками. Надмолекулярные белковые комплексы могут состоять из десятков молекул. Многие комплексы сравнимы с рибосомами по размеру. Крупные надмолекулярные белковые комплексы являются самоорганизующимися системами. Характерный пример такого рода - система синтеза жирных кислот ( из дрожжей), состоящая из 7 различных ферментов. Каждый из этих ферментов, в свою очередь, построен из 3 - х, по-видимому, идентичных субъединиц.
11)Физико-химические св-ва белков
1 Наиболее характерными физико-химическими свойствами белков являются: высокая вязкость растворов,
незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению Уф-лучей при 280 нм (это последнее свойство, обусловленное наличием в белках ароматических аминокислот, используется для количественного определения белков).
Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2-и СООН-групп и характеризуются соответственно всеми св-вами кислот и оснований.
Белки обладают явно выраженными гидрофильными свойствами. Их растворы обладают очень низким осмотическим давлением, высокой вязкостью и незначительной способностью к диффузии. Белки способны к набуханию в очень больших пределах.
С коллоидным состоянием белков связан рад характерных свойств, в частности явление светорассеяния, лежащее в основе количественного определения белков методом нефелометрии. Этот эффект используется, кроме того, в современных методах, микроскопии биологических объектов. Молекулы белка не способны проходить через, полупроницаемые искусственные мембраны (целлофан, пергамент, коллодий), а также биомембраны растительных и животных тканей, хотя при органических поражениях, например почек, капсула почечного клубочка (Шумлянского -Боумена) становится проницаемой для альбуминов сыворотки крови, и они появляются в моче.
Денатурация белка под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства. Таким образом, под денатурацией следует понимать нарушение общего плана - уникальной структуры нативной молекулы белка, приводящее к потере характерных для нее свойств (рас-творимости, злектрофоретической подвижности, биологической активности и т. д.). Большинство белков денатурируют при нагревании их раствором выше 50-60о С. Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению коли¬чества свободных функциональных SH-rpyпп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической антигенной или гормональной) При денатурации разрушаются в основном нековалентные (в частности, водородные) связи и дисульфидные мостики и не затрагиваются пептидные связи самого остова полипептидной цепи При этом развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры.
Денатурация
Белковая молекула имеет нативную (функциональную) конформацию благодаря наличию большого числа слабых связей и быстро денатурирует при изменении условий среды, от которых эти силы зависят. Изменение температуры, ионной силы, рН, а также обработка органическими или некоторыми дестабилизирующими агентами может привести к нарушению нативной конформации, что и называется денатурацией. Денатурирующие вещества образуют связи с аминогруппами или карбонильными группами пептидного остова или некоторыми боковыми остатками аминокислот, подменяя собственные внутримолекулярные связи в белке, вследствие чего вторичная и третичная структуры изменяются. Эти изменения не затрагивают первичную структуру, при этом биологическая активность белка утрачивается.
Ренатурация
Ренатурация (высаливание) — процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима. При определенных условиях денатурированный белок может быть ренативирован. Это происходит при удалении денатурирующего или дестабилизирующего фактора. Например, при удалении мочевины диализом полипептиды самопроизвольно восстанавливают свою нативную конформацию. То же происходит при медленном охлаждении денатурированного нагреванием белка.
12) Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apr и Гис.
Степень ионизации функциональных групп этих радикалов зависит от рН среды. При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. В щелочной среде связывание избытка ОН" с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков:-NH3+ +ОН- → -NH2 + H2O.
Значение рН, при котором белок приобретает суммарный нулевой заряд, называют "изоэлектрическая точка" и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии.
Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина.
Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (- ). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным.
При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
13)Все белки принято делить на про¬стые белки ,или протеины, и сложные белки , или протеиды (комплексы бел-ков с небелковыми соедине¬ниями).Простые белки являются поли¬мерами только аминокислот; сложные, помимо остатков аминокислот, содер¬жат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической груп-пы.ФосфопротеиныИмеют в каче¬стве небелкового компонента фосфор¬ную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Метал-лопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молиб¬ден, реже марганец, никель. Гликопро¬теиныПростетическая группа представ¬лена углеводами и их производными. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Бел¬ковая часть представлена в основном гистонами и протаминами. Липопро¬теиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов.К белкам этого класса относятся казеиноген мо¬лока, в котором содержание фосфорной кислоты достигает 1%; и др. Большое количество фосфопротеинов содер-жится в клетках ЦНС. Характерной особенностью структуры фосфопротеи¬нов является то, что фосфорная кислота ока-зывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиамино¬кислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата. Фосфопротеины со¬держат органически связанный, лабиль¬ный фосфат, абсолютно необходимый для выполнения клеткой ряда биологи¬ческих функ-ций. Кроме того, они явля¬ются ценным источником энергетиче-ского и пластического материала в про¬цессе эмбриогенеза и дальнейшего по¬стна-тального роста и развития орга¬низма.
Липопротеи́ны (липопротеиды) — класс сложных белков, простетическая группа которых представлена каким-либо липидом. Так, в составе липопротеинов могут быть свободные жирные кислоты, нейтральные жиры, фосфолипиды, холестериды.
Липопротеины представляют собой комплексы, состоящие из белков (аполипопротеинов; сокращенно — апо-ЛП) и липидов, связь между которыми осуществляется посредством гидрофобных и электростатических взаимодействий.
Липопротеины подразделяют на свободные, или растворимые в воде (липопротеины плазмы крови, молока и др.), и нерастворимые, т. н. структурные (липопротеины мембран клетки, миелиновой оболочки нервных волокон, хлоропластов растений).
Среди свободных липопротеинов (они занимают ключевое положение в транспорте и метаболизме липидов) наиболее изучены липопротеины плазмы крови, которые классифицируют по их плотности. Чем выше содержание в них липидов, тем ниже плотность липопротеинов. Различают липопротеины очень низкой плотности (ЛПОНП), низкой плотности (ЛПНП), высокой плотности (ЛПВП) и хиломикроны. Каждая группа липопротеинов очень неоднородна по размерам частиц (наиболее крупные — хиломикроны) и содержанию в ней апо-липопротеинов. Все группы липопротеинов плазмы содержат полярные и неполярные липиды в разных соотношениях.Нековалентная связь в липопротеинах между белками и липидами имеет важное биологическое значение. Она обусловливает возможность свободного обмена липидов и модуляцию свойств липопротеинов в организме.
Липопротеины являются:
-структурными элементами мембран клеток животных организмов;
-транспортными белками, транспортирующими холестерин и другие стероиды, фосфолипиды и др.
14) Все белки принято делить на про¬стые белки ,или протеины, и сложные белки , или протеиды (комплексы бел-ков с небелковыми соедине¬ниями).Простые белки являются поли¬мерами только аминокислот; сложные, помимо остатков аминокислот, содер¬жат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической груп-пы.ФосфопротеиныИмеют в каче¬стве небелкового компонента фосфор¬ную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Метал-лопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молиб¬ден, реже марганец, никель. Гликопро¬теиныПростетическая группа представ¬лена углеводами и их производными. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Бел¬ковая часть представлена в основном гистонами и протаминами. Липопро¬теиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов.К белкам этого класса относятся казеиноген мо¬лока, в котором содержание фосфорной кислоты достигает 1%; и др. Большое количество фосфопротеинов содер-жится в клетках ЦНС. Характерной особенностью структуры фосфопротеи¬нов является то, что фосфорная кислота ока-зывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиамино¬кислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата. Фосфопротеины со¬держат органически связанный, лабиль¬ный фосфат, абсолютно необходимый для выполнения клеткой ряда биологи¬ческих функ-ций. Кроме того, они явля¬ются ценным источником энергетиче-ского и пластического материала в про¬цессе эмбриогенеза и дальнейшего по¬стна-тального роста и развития орга¬низма.
Хромопротеины (от греч. chroma – краска) состоят из простого белка и свя¬занного с ним окрашенного небелко¬вого компонента. Различают гемопро¬теины (содержат в качестве простетиче¬ской группы железо), маг-нийпорфи¬рины и флавопротеины (содержат про¬изводные изоаллоксазина). Хромопро¬теины наделены рядом уникальных биологических функций: они участвуют в таких фундаментальных процессах жизнедеятельности, как фо-тосинтез, дыхание клеток и целостного орга¬низма, транспорт кислорода и диоксида углерода, окислительно-восстанови-тельные реакции, свето-и цветовос¬приятие и др. Таким образом, хромо¬протеины играют исключительно важ¬ную роль в процессах жизнедеятельно¬сти. Например, подавление дыхатель¬ной функции гемоглобина путем введе¬ния оксида углерода (СО) либо утили-зации (потребление) кислорода в тканях путем введения синильной кислоты или ее солей (цианидов), ингибирующих ферментные системы клеточного дыха¬ния, моментально приводит к смерти организма. Хромопротеины являются непременными и активными участни¬ками аккумулирования энергии, начи¬ная от фиксации солнечной энергии в зеленых растениях и утилизации ее до превращений в организме животных и человека. Хлорофилл (магнийпорфи¬рин) вместе с белком обеспечивает фо-тосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород (поглоще-нием солнечной энергии). ГЕМОГЛО¬БИН осн. белок дыхат. цикла, участ¬вующий в переносе О2 от органов ды¬хания к тканям, а в обратном направле¬нии - СО2. Содержится в эритроцитах крови почти всех позвоночных и гемо¬лимфе большинства беспозвоночных животных. Гемоглобин взрослого че¬ловека (НbА) имеет мол.м. 6,49*104 и принадлежит к числу наиб. изученных белков. Его форма в р-ре близка к эл¬липсоиду с осями 6,4, 5,5 и 5,0 нм; изо¬электрич. точка 6,9. Тетрамер НЬА со¬стоит из двух и двухсубъединиц, их по¬липептидные цепи содержат соотв. 141 и 146 аминокислотных остатков. Из¬вестны первичная структура обеих це¬пей, а также пространств.структура оксигенированной, дезоксигенирован¬ной, ряда лигандированных, а также окисленной формы (содержит Fe3 +) НbА. Пространств. структура субъеди¬ниц (рис. 1) характеризуется наличием восьмиспиральных участков, вклю¬чающих около 80% аминокислотных остатков, и внутр. полости -гемового кармана. Фиксирование тема в субъе¬динице осуществляется в результате гидрофобных взаимод. пиррольных и винильных групп тема с алифатич. и ароматич. боковыми радикалами ами¬нокислот, выстилающими полость кар¬мана, а также благодаря координацион¬ной связи (направлена перпендикулярно к плоскости кольца тема) Fe2+ с акси¬альным лигандом-имидазольной груп¬пой гистидина.
15) Все белки принято делить на про¬стые белки ,или протеины, и сложные белки , или протеиды (комплексы бел-ков с небелковыми соедине¬ниями).Простые белки являются поли¬мерами только аминокислот; сложные, помимо остатков аминокислот, содер¬жат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической груп-пы.ФосфопротеиныИмеют в каче¬стве небелкового компонента фосфор¬ную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Метал-лопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молиб¬ден, реже марганец, никель. Гликопро¬теиныПростетическая группа представ¬лена углеводами и их производными. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Бел¬ковая часть представлена в основном гистонами и протаминами. Липопро¬теиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов.К белкам этого класса относятся казеиноген мо¬лока, в котором содержание фосфорной кислоты достигает 1%; и др. Большое количество фосфопротеинов содер-жится в клетках ЦНС. Характерной особенностью структуры фосфопротеи¬нов является то, что фосфорная кислота ока-зывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиамино¬кислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата. Фосфопротеины со¬держат органически связанный, лабиль¬ный фосфат, абсолютно необходимый для выполнения клеткой ряда биологи¬ческих функ-ций. Кроме того, они явля¬ются ценным источником энергетиче-ского и пластического материала в про¬цессе эмбриогенеза и дальнейшего по¬стна-тального роста и развития орга¬низма.
ликопротеи́ны (устар. гликопротеиды) — это сложные белки, в которых белковая (пептидная) часть молекулы ковалентно соединена с одной или несколькими группами гетероолигосахаридов. Кроме гликопротеинов существуют также протеогликаны и гликозаминогликаны
Моносахариды, связанные с конкретным белком, могут быть разными: это может быть глюкоза, фукоза, манноза, глюкозамин, галактозамин, ксилоза, сиаловая кислота, галактоза и др.
Те или иные моносахариды, связанные с белком, изменяют биохимические и иммунологические свойства белка, его пространственную конфигурацию и др. Важным частным случаем является связывание белков с сиаловой кислотой, приводящее к формированию сиалогликопротеинов. В типичных случаях именно связывание с сиаловой кислотой предопределяет увеличение T1/2 белка в плазме крови.Гликопротеины являются важным структурным компонентом клеточных мембран животных и растительных организмов. К гликопротеинам относятся большинство белковых гормонов. Гликопротеины мембран эритроцитов, специфически гликозилированные теми или иными углеводными остатками, но имеющие гомологичную белковую часть, предопределяют группу крови у человека. Также гликопротеинами являются все антитела, интерфероны, компоненты комплемента, белки плазмы крови, молока, рецепторные белки и др.
16) Все белки принято делить на про¬стые белки ,или протеины, и сложные белки , или протеиды (комплексы бел-ков с небелковыми соедине¬ниями).Простые белки являются поли¬мерами только аминокислот; сложные, помимо остатков аминокислот, содер¬жат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической груп-пы.ФосфопротеиныИмеют в каче¬стве небелкового компонента фосфор¬ную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Метал-лопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молиб¬ден, реже марганец, никель. Гликопро¬теиныПростетическая группа представ¬лена углеводами и их производными. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Бел¬ковая часть представлена в основном гистонами и протаминами. Липопро¬теиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов.К белкам этого класса относятся казеиноген мо¬лока, в котором содержание фосфорной кислоты достигает 1%; и др. Большое количество фосфопротеинов содер-жится в клетках ЦНС. Характерной особенностью структуры фосфопротеи¬нов является то, что фосфорная кислота ока-зывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиамино¬кислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата. Фосфопротеины со¬держат органически связанный, лабиль¬ный фосфат, абсолютно необходимый для выполнения клеткой ряда биологи¬ческих функ-ций. Кроме того, они явля¬ются ценным источником энергетиче-ского и пластического материала в про¬цессе эмбриогенеза и дальнейшего по¬стна-тального роста и развития орга¬низма.
Нуклеопротеиды — комплексы нуклеиновых кислот с белками.К нуклеопротеидам относятся устойчивые комплексы нуклеиновых кислот с белками, длительное время существующие в клетке в составе органелл или структурных элементов клетки в отличие от разнообразных короткоживущих промежуточных комплексов белок — нуклеиновая кислота (комплексы нуклеиновых кислот с ферментами — синтетазами и гидролазами — при синтезе и деградации нуклеиновых кислот, комплексы нуклеиновых кислот с регуляторными белками и т. п.).
В зависимости от типа входящих в состав нуклеопротеидных комплексов нуклеиновых кислот различают рибонуклеопротеиды и дезоксирибонуклеопротеиды.Устойчивость нуклеопротеидных комплексов обеспечивается нековалентным взаимодействием. У различных нуклеопротеидов в обеспечение стабильности комплекса вносят вклад различные типы взаимодействий, при этом нуклеиново-белковые взаимодействия могут быть специфичными и неспецифичными. В случае специфичного взаимодействия определённый участок белка связан со специфичной (комплементарной участку) нуклеотидной последовательностью, в этом случае вклад водородных связей, образующихся между нуклеотидными и аминокислотными остатками благодаря пространственному взаимному соответствию фрагментов, максимален. В случае неспецифичного взаимодействия основной вклад в стабильность комплекса вносит электростатическое взаимодействие отрицательно заряженных фосфатных групп полианиона нуклеиновой кислоты с положительно заряженными аминокислотными остатками белка.Примером специфичного взаимодействия могут служить нуклеопротеидные комплексы рРНК — субъединицы рибосом; неспецифичное электростатическое взаимодействие характерно для хромосомных комплексов ДНК — хроматина и комплексов ДНК-протамины головок сперматозоидов некоторых животных.
Нуклеопротеиды диссоциируют на белки и нуклеиновые кислоты при воздействии агентов, разрушающих или ослабляющих нековалентные связи:-повышенные концентрации солей или мочевины, увеличивающих ионную силу раствора,-ионогенные поверхностно-активные вещества,
-некоторые полярные органические соединения (формамид и диметилформамид, фенол и т. п.).
Некоторые нуклеопротеиды (рибосомные субчастицы, нуклеокапсиды вирусов) обладают способностью к самосборке, то есть к образованию, при соответствующих условиях, нуклеопротеидов in vitro без участия клеточных структур или агентов; такая самосборка возможна в случае специфичных нуклеиново-белковых взаимодействий (нуклеиново-белковым узнавании). В любом случае, при образовании нуклеопротеидов происходят существенные конформационные изменения нуклеиновых кислот и, в некоторых случаях, белков, образующих нуклеопротеидный комплекс. Дезоксирибонуклеопротеиды-хроматин, Рибонуклеопротеиды
17),18) После достижения полной экстракции белков, т.е. перевода белков в растворенное состояние, приступают к разделению – фракционированию смеси белков на индивидуальные белки. Для этого применяют разнообразные методы: высаливание, тепловую денатурацию, осаждение органическими растворителями, хроматографию, электрофорез, распределение в двухфазных системах, кристаллизацию и др.
Хроматография. Принцип хроматографии, разработанный в 1903 г. русским ученым М. С. Цветом, основан на способности пигментов (или любых других окрашенных и неокрашенных веществ) специфически адсорбироваться на адсорбенте, заключенном в колонке.
В результате происходит разделение анализируемых веществ и их концентрирование в строго определенном слое адсорбента. Затем через колонку пропускают подходящие элюенты, которые ослабляют силы адсорбции и выносят с током раствора индивидуальные вещества. Последние последовательно собирают в коллекторе фракций (принцип сорбции-десорбции).
Чрезвычайно эффективным средством фракционирования белков из смеси оказалась колоночная хроматография с гидроксилапатитом, различными ионообменными смолами и производными целллюлозы в качестве носителей. При выделении и очистке белков используют четыре основных типа хроматографии: адсорбционную, распределительную, ионообменную и аффинную (хроматография по сродству) – в соответствии с разными физическими и химическими механизмами, лежащими в основе каждого из них. Хроматография широко применяется не только для выделения белков, но и для разделения множества других органических и неорганических веществ, входящих в состав живых организмов.так же есть хромотография на бумаге,распределительная,адсорбционная,афинная.
Электрофорез. Метод свободного электрофореза, детально разработанный лауреатом Нобелевской премии А. Тизелиусом, основан на различии в скорости движения (подвижности) белков в электрическом поле, которая определяется величиной заряда белка при определенных значениях рН и ионной силы раствора. В последнее время более широкое распространение получили методы зонального электрофореза белков на различных носителях, в частности на твердых поддерживающих средах: гелях крахмала и полиакриламида, целлюлозе. Преимущества их по сравнению с методом свободного электрофореза состоят в том, что исключается размывание границы белок-растворитель в результате диффузии и конвекции, не требуется налаживания сложной аппаратуры для определения положения границы, а для анализа необходимо небольшое количество белка.
Методы очистки белков
Наиболее трудоёмкий этап получения индивидуальных белков - их очистка от других белков, находящихся в растворе, полученном из данной ткани. Часто изучаемый белок присутствует в небольших количествах, составляющих доли процента от всех белков раствора.Так как белки обладают конформационной лабильностью, при работе с белками следует избегать денатурирующих воздействий, поэтому выделение и очистка белков происходят при низких температурах.На первых стадиях очистки белков целесообразно использовать методы, учитывающие какую-либо характерную особенность данного белка, например термостабильность или устойчивость в кислых растворах. Первыми методами очистки необходимо удалить из раствора основную массу балластных белков, которые значительно отличаются от выделяемого белка физико-химическими свойствами. Впоследствии применяют всё более тонкие методы очистки белка. Очистка белков избирательной денатурацией:Большинство белков денатурирует и выпадает в осадок уже при кратковременном нагревании раствора до 50-70 °С или подкислении раствора до рН 5. Если выделяемый белок выдерживает эти условия, то с помощью избирательной денатурации можно удалить большую часть посторонних белков, отфильтровав выпавшие в осадок-белки, или осадить их центрифугированием.Высаливание:Метод очистки белков, основанный на различиях в их растворимости при разной концентрации соли в растворе. Соли щелочных и щёлочно-земельных металлов вызывают обратимое осаждение белков, т.е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства.Чаще всего для разделения белков методом высаливания используют разные концентрации солей сульфата аммония - (NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима дляего высаливания.
19) ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ (биокатализ), ускорение биохим. р-ций при участии белковых макромолекул, называемых ферментами (энзимами). Ферментативный катализ- разновидность катализа, хотя термин "ферментация" (брожение)известен с давних времен, когда еще не было понятия хим. катализа.
Первое исследование ферментативного катализа как хим. процесса было выполнено К. Кирхгофом, к-рый в 1814 продемонстрировал фер-ментативную конверсию крахмала в растворимые углеводы.
Заметный вклад в представление о природе ферментативного катализа внесли работы И. Берцелиуса и Э. Мичерлиха, к-рые включили ферментативные р-ции в категорию хим. каталитич. процессов. В кон. 19 в. Э. Фишер высказал гипотезу о специфичности ферментативных р-ций и тесном стерич. соответствии между субстратом и активным центром фермента. Основы кинетики ферментативных р-ций были заложены в работах Л. Михаэ-лиса (1913).
В 20 в. происходит интенсивное изучение хим. основ ферментативного катализа, получение ферментов в кристаллич. состоянии, изучение структуры белковых молекул и их активных центров, исследование большого числа конкретных ферментативных р-ций и ферментов.
В простейшем случае ур-ние р-ции с участием фермента имеет вид:
где E - фермент, S - субстрат, ES - фермент-субстратный комплекс (т. наз. комплекс Михаэлиса), P- продукт р-ции.
Превращение субстрата в продукт происходит в комплексе Михаэлиса. Часто субстрат образует ковалентные связи с функц. группами активного центра, в т. ч. и с группами кофермента (см. Коферменты). Большое значение в механизмах ферментативных р-ций имеет основной и кислотный катализ, реализуемый благодаря наличию имидазольных групп остатков гистидина и карбоксильных групп дикарбоно-вых аминокислот.
Важнейшие особенности ферментативного катализа - эффективность, специфичность и чувствительность к регуляторным воздействиям. Ферменты увеличивают скорость хим. превращения субстрата по сравнению с неферментативной р-цией в 109-1012 раз. Столь высокая эффективность обусловлена особенностями строения активного центра. Принято считать, что активный центр комплементарен (см. Комплементарность)переходному состоянию субстрата при превращении его в продукт. Благодаря этому стабилизируется переходное состояние и понижается активац. барьер р-ции.
Большинство ферментов обладает высокой субстратной специфичностью, т. е. способностью катализировать превращение только одного или неск. близких по структуре в-в. Специфичность определяется топографией связывающего субстрат участка активного центра.
Активность ферментов регулируется в процессе их биосинтеза (в т.ч. благодаря образованию изоферментов, к-рые катализируют идентичные р-ции, но отличаются строением и каталитич. св-вами), а также условиями среды (рН, т-ра, ионная сила р-ра) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты р-ции, а также конечные продукты в цепи последоват. превращений в-ва (см. Регуляторы ферментов).
Ферментативные р-ции чувствительны к внеш. условиям, в частности к ионной силе р-ра и рН среды. Влияние т-ры на скорость ферментативной р-ции описывается кривой с максимумом, восходящая ветвь к-рой отражает обычную для хим. р-ций зависимость, выраженную ур-нием Аррениуса. Нисходящая ветвь связана с тепловой денатурацией фермента. Максимум кривой соответствует оптимальной т-ре Tопт, значение к-рой для большинства ферментов лежит в пределах 40-50 0C. Для нек-рых ферментов, особенно ферментов термофильных микроорганизмов, Tопт 80-90 0C. Подробнее о кинетике ферментативных р-ций см. Ферментативных реакций кинетика.
Осн. направления совр. исследований ферментативного катализа- выяснение механизма, обусловливающего высокие скорости процессов, высокую селективность (специфичность действия ферментов), изучение механизмов контроля и регуляции активности ферментов. Оказалось, в частности, что р-ции ферментативного катализа включают большое число стадий с участием лабильных промежут. соед., времена жизни к-рых изменяются в нано- и миллисекундном диапазонах. На активных центрах ферментов протекают быстрые (нелимитирующие) стадии, в результате чего понижается энергетич. барьер для наиб.трудной, лимитирующей стадии.
Установлен механизм регулирования ферментативной активности путем действия ингибитора (или активатора) на специфичный центр белковой молекулы с опосредованной передачей воздействия на активный центр фермента через белок. Обнаружены эффекты кооперативного взаимод. неск. молекул субстрата на белковой матрице. Найден способ "жесткого" выведения фермента из процесса посредством индуцированной субстратом необратимой инактивации.
Ферментативный катализ- основа мн. современных хим. технологий, в частности крупномасштабных процессов получения глюкозы и фруктозы, антибиотиков, аминокислот, витаминов и регуляторов, а также тонкого орг. синтеза. Разработаны методы, позволяющие проводить ферментативные р-ции в орг. р-ри-телях, обращенных мицеллах (см. Мицеллообразование). С ферментативным катализом связаны перспективы развития иммуноферментного и биолюминесцентного анализа, применения биосенсоров. Созданы методы, позволившие придать каталитич. активность антителам, обнаружена каталитич. активность у рибонуклеи-новой к-ты (абзимы, рибозимы соотв.).
Механизмы катализа
Доноры Акцепторы
-СООН-СОО-
-NH3+ -NH2
-SH -S-
1. Кислотно-основной катализ – в активном центре фермента находятся группы специфичных аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов. Такие группы представляют собой мощные катализаторы многих органических реакций.
2. Ковалентный катализ – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
20) Изучение ферментов показало, что они обладают св-ми белков. Какие св-ва характерны для ферментов?
1) они являются амфотерными
2)осаждаются сульфатом аммония т.е. высаливаются
3) инактивируются при нагревании под действием концентрированных кислот и щелочей
4) неспособны проходить через полупроницаемые мембраны.
Абсолютным доказательством белковой природы ферментов - это синтез их из отдельных аминокислот. Сегодня синтезированы из отдельных аминокислот несколько ферментов. Первыми ферментами синтезированные рибонуклеазы (ферменты расщепляющие РНК) и пепсин (основной фермент желудочного сока). Причем синтезированный рибонуклеаза и пепсин ничем не отличались по свойствам по каталитической активности от выделенных из естественных тканей. По хим. составу ферменты как и белки могут быть двух видов - простые и сложные (протеины и протеиды). Несколько слов о протеинах. Они могут состоять из одной полипептидной цепи (рибонуклеаза содержащая 124 ам. ксл. отатка, пепсин, трипсин) В то же время ряд ферментов состоят из нескольких полипептидных цепей т.е. являются олигомернымн белками. Например альдолаза - фермент гликолиза, РНК-полимераза и др. К первой группе относятся обычно класс гидролиз, практически все гадролитические ферменты состоят только из аминокислот т.е. являются простыми белками. Кроме того, некоторые лиазы, а вот все остальные классы ферментов в основном явл. сложными белками т.е. для каталитической активности многих ферментов кроме белковой части необходим второй компонент получивший название кофактор. Есть каталитически активный фермент вместе с кофактором получил название холофермент. Это каталитически активный фермент состоящий из белковой и небелковой части кофактора. Белковая часть холофермента получила название апофермент. Характерной особенностью холофермента или сложных ферментов протеидов является, то, что ни белковая часть апофермента, ни кофактор в отдельности не обладают заметной каталитической активностью.
Функциональные центры - участки поверхности молекулы фермента ответственное за взаимодействие с др белками, причем белками или обладающими каталитической активностью (ферментами) или белками, не обладающими каталитической активностью
Подобного рода взаимодействия встречаются при формировании надмолекулярных мультиферментных комплексах. Те комплексы о которых мы говорили (пируватдегдрогеназные, альфакетоглюторатгидрогеназные) синтетазы высших жирных кислот) включают несколько ферментов. Дело в том, что включение нескольких ферментов в этом комплексе достаточно в заметной степени сказывается на каталитической активности других ферментов этого комплекса.
Почему? Дело в том, что пространственная структура свободного фермента и фермента включенного в комплекс меняется, а значит, меняется и каталитическая активность. Субстраты в превращении которых участвуют ферменты по сравнению с самим ферментом очень часто очень мелкие молекулы, понятно, что в образовании энз-субс. комплекса участвует не вся мол-ла фермента, а только какой-то ее участок, какая-то часть ее поверхности. Этот участок пов-ти фермента ответственный за связывание и превращение субстрата и получил название активного центраВ структуру актив, центра входят: в его образование принимают участие не более 10-15 ам.к. остатков определенных образом ориентированных в пространстве по отношению друг к другу. Эти остатки могут далеко располагаться в полипептидной цепи, могут сближаться при формировании третичной структуры.Хемотрипсин принимают участие 4 ам.к. остатка : 2 остатка гистидина (57,40), серин (195), аспартат (102). Составн. элем, актив, центра часто относится участок остова полипептидной цепи удержив. ам.к. радик. в определенном положении друг к др.
В активный центр фермента входят кофакторы (исключ. некот. ионов металлов). В активном центре условно выделяют 2 участка: а) субстратный - отвечает за связывание субстрата
б) каталитический центр - участок осуществляющий катализ связав.субстрата. Сюда входит кофактор. Кофактору и функ гр. присуща большая роль.В составе многих ферментов так же кроме активных центров имеются регуляторные центры.а) Аллостерический центр б) Центр ковалентной модификации в) Центр связывания с белками и регуляторами.Аллостер. центр - центр, находящийся в другом месте от активного центра - участок на пов-ти фермента образованный определенным образом ориентированных ам.к. радикалов. Его 3 мерная структура комплементарна низкомолекулярным лнгандам - кот.выступают в качестве регуляторов. цАМФ, АТФ. Присоединение аллост. модуляторов к аллост. центру приводит к изменению конформации белка, что сопровождается изменением пространственной структуры ферм, и изменен, к катализу. 1. Если присоединение модулятора повышает активность - аллостерич. активатор 2. Если понижает - аллостер ингибитор. Связыв. модул, с актив, центром - обратима. Никогда не возникает ковалентная связь. Активность определяется концентрацией модуляторов. Аллостер ферм, имеют как правило 4 структуру. Один и тот же фермент имеет 2 и более актив, центра кот комплемент, разный модуляторам.Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому какого-то низкомолекулярного вещества изменяется третичная структура белковой молекулы фермента, что влечет за собой изменение его активности. Аллостерический центр является регуляторным центром фермента.
21) Все Ферменты разделяются на две большие группы: однокомпонентные, состоящие исключительно из белка, и двухкомпонентные, состоящие из белка, называемого апоферментом, и небелковой части, называемой простетической группой. Апофермент двухкомпонентных Ферменты называют также белковым носителем, а простетическую группу – активной группой. Благодаря работам О. Варбурга, А. Теорелля, Ферменты Линена, Ферменты Липмана и Л. Лелуара установлено, что простетические группы многих Ферменты представляют собой производные витаминов или нуклеотидов. Т. о. была открыта важнейшая функциональная связь междуФерменты, витаминами и нуклеотидами, являющимися строительными «кирпичиками» нуклеиновых кислот.
Простетическая группа — небелковый (и не производный от аминокислот) компонент, связанный с белком, который выполняет важную роль в биологической активности соответствующего белка. Простетические группы могут быть органическими (витамины, углеводы, липиды) или неорганическими (например, ионы металлов).Простетические группы прочно связаны с белками и даже могут быть присоединены ковалентными связями. Часто играют важную роль в функционировании ферментов. Белок без простетической группы называется «апобелок», а белок с присоединенной группой — «холобелок» (или, соответственно, в случае ферментов — апофермент и холофермент).Примером может являться гем, который является простетической группой в молекуле гемоглобина.Простетические группы — это подкласс кофакторов. Они отличаются от коферментов тем, что простетические группы постоянно связаны с ферментами, в то время как коферменты связаны с ферментами непостоянно.
Коферменты — это органические вещества, как правило, аминокислотной природы, непосредственно участвующие в катализе в составе фермента. Простые, относятся обычно к классу гидролаз, практически все гидролитические ферменты состоят только из
аминокислот, т.е. являются простыми белками. Кроме того, некоторые лиазы, а вот все остальные классы ферментов в основном явл. сложными белками, т.е. для каталитической активности многих ферментов кроме белковой части необходим второй компонент получивший название кофактор. Есть каталитически активный фермент вместе скофактором получил название холофермент. Это каталитически активный фермент, состоящий из белковой и небелковой части кофактора. Белковая часть холофермента получила название апофермент.Характерной особенностью холофермента или сложных ферментов протеидов является, то, что ни белковая часть апофермента, ни кофактор в отдельности не обладают заметной каталитической активностью. Какую же роль выполняют тот и другой?Оказывается апофермент резко повышает каталитическую активность кофактора, а кофактор в свою очередь стабилизирует белковую часть, делает ее более устойчивой и менее уязвимой к денатурирующим агентам. Поэтому встает вопрос, что и какие вещества явл. кофакторами?Роль кофакторов, как выяснилось, играют большинство витаминов или соединений построенных с их участием, но не только витамины выступают в роли кофакторов. Кроме того, это некоторые полипептиды, группы нуклеотидов и их производные и, наконец, ионы некоторых металлов. Последние годы в соответствии с химической природой кофакторов появилась классификация: 1) Кофакторы жирного ряда (глютатион, липоевая кислота, долихол фосфат). 2 Кофакторы алифатического ряда (убихинон или коэнзим Q). 3) Кофакторы гетероциклического ряда а) содержащие витамины (B1) тиоминлирофосфат (В6) перидоксальфосфат (В7) биоцетин (В9) тетрогидрофолат содержащий фоливую кислоту (фолиум - лист) 6) не содержащие витаминов геминовые кофакторы. Основой этих кофакторов является гемовое железо 4 Кофакторы-нуклеотиды а) содержащие витамины содержащие витамин В2 (флавинмононуклеотид) (фляос - желтый) (флавинадениндинуклеотид) НАД, НАДФ (РР или В5) HSKoA (пантотеновая кислота ВЗ) Кобамидные коферменты (В 12) содержат кобальт б) нуклеотиды не витамины АТФ,
уридиндифосфорноглюкуроновая кислота (УДФК), фосфоаденозинфосфосульфат (ФАФС) - активная фосфорная кислота, (ЦТФ) цитидинтрифосфорная кислота. Ф-ции: АТФ участвует в переносе адениловой и фосфорной кислоты, участвует в реакциях аденилирования и фосфолирирования ФАФС участвует в переносе сульфогрупп УДФК участвует в переносе глюкуроновой кислоты ЦТФ участвует в активации холина и фосфотидной кислоты. Процессы идущие при биосинтезе фосфолипидов. 5 Кофакторы ионов металлов Fe, Mn, Zn, К, Na, Mg, Ca, Сu.
22),23) . Важным фактором, от которого за¬висит скорость фермента-тивной реак¬ции (равно каталитическая активность фермента) является температура, видно, что с повышением тем¬пературы до определенной величины скорость реакции увеличивается. Это можно объяснить тем, что с повыше¬нием температуры движение молекул ускоряется и у молекул реагирующих веществ оказывается больше возможно¬сти столкнуться друг с другом. Это увели-чивает вероятность того, что ре¬акция между ними произойдет. Темпе¬ратура, обеспечивающая наибольшую скорость реакции, называется о п т и м а л ь н о й температурой. Каждый фер¬мент имеет свою оптимальную темпера¬туру. В общем для ферментов живот¬ного происхождения она лежит между 37 и 40ОС, а растительного - между 40 и 50ОС. Однако есть и исключения: -амилаза из проросшего зерна имеет оп¬тимальную температуру при 60ОС, а каталаза - в пределах 0 - 10ОС. При по¬вышении температуры сверх оптималь¬ной скорость ферментативной реакции снижается, хотя частота столкновений молекул увели-чивается. Происходит это вследствие денатурации, т.е. потери ферментом нативного состояния. При температуре выше 80ОС большинство ферментов полностью теряют свою ка-талитическую активность.Снижение скорости ферментативной реакции при температурах, превышаю¬щих оптимальную, зависит от денату¬рации фермента. Поэтому важным по¬казателем, характеризующим отноше¬ние фермента к температуре, является его термолабильность, т.е. скорость инактивации самого фермента при по¬вышении темпера-туры.При низких температурах (0 ОС и ниже) каталитическая актив-ность ферментов падает почти до нуля, но денатурация при этом не происходит. С повышением температуры их каталитическая актив¬ность вновь восстанавливается. Важ¬ным фактором, оказывающим большое влияние на скорость ферментативной реакции, является рН среды. Для каж¬дого фермента существует оптимальное значение рН, т.е. такая величина рН, или зона рН, при которой катализируе¬мая ферментом реакция протекает с наибольшей скоростью. При высокой концентрации субстрата и при постоянстве других факторов, таких, например, как температура и рН, скорость ферментативной реакции пропорциональна концентрации фермента.
Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.. Факторы, влияющие на скорость биохимических процессов
Кинетика биохимических процессов зависит от ряда факторов: химической природы реагирующих веществ, концентраций фермента и субстрата, температуры и рН среды, наличия активаторов и ингибиторов.Скорость биохимических процессов зависит от природы субстрата и его атакуемости. Под атакуемостъю понимают его податливость действию фермента, которая зависит от структуры субстрата. Например, атакуемость амилазами крахмала, полученного из зерна различных культур или из разных частей одного и того же зерна, неодинакова. Она увеличивается с уменьшением размера крахмальных зерен, т.е. с увеличением их относительной поверхности, а также при механическом воздействии на структуру зерен крахмала, например, при длительном помоле зерна. Однако действие амилаз на неизмененный крахмал или на механически поврежденный весьма незначительно по сравнению с их действием на клейстеризованный крахмал. Поэтому в тех отраслях пищевой промышленности, где крахмал служит источником образования сахаров за счет расщепления его амилолитическими ферментами, для увеличения степени осахаривания чаще всего его клейстеризуют путем заваривания муки. Подобная обработка субстрата применяется в спиртовой, хлебопекарной (при производстве заварного хлеба, для улучшения качества пшеничной муки, при получении питательной среды для жидких дрожжей), в паточной промышленности.Атакуемость белка протеиназами зависит от строения белковой молекулы: чем плотнее и прочнее структура белка, тем ниже его атакуемость ферментами. Количество в молекуле определенных химических групп, например, сульфгидрильных, аминных и др., влияет на атакуемость белка. Если эти группы каким-то образом блокировать, то меняется атакуемость субстрата ферментами. При восстановлении дисульфидных групп белка пшеницы в сульфгидрильные увеличивается атакуемость белка и возрастает скорость его расщепления.
Скорость биохимических процессов зависит от концентраций самого фермента и реагирующих веществ. При избытке субстрата скорость реакции определяется прежде всего концентрацией фермента: чем она выше, тем быстрее идут реакции.При невысоких концентрациях субстрата зависимость скорости реакции от концентрации участвующих в реакции веществ носит линейный характер, т.е. с увеличением концентрации субстрата она возрастает. Однако по мере увеличения концентрации реагирующих веществ скорость реакции замедляется, достигает максимального значения и в дальнейшем остается постоянной. В то же время большие концентрации субстрата могут выполнять роль ингибитора. В итоге скорость реакции падает.Наиболее существенное влияние на активность ферментов и скорость биохимических процессов оказывают температура и реакция среды. С повышением температуры активность ферментов возрастает, достигает максимума, а затем снижается. Оптимальной для действия фермента является та температура, при которой его активность наибольшая. Температурный оптимум для ферментов растительного происхождения составляет около 40-500С. Снижение активности фермента при высоких температурах связано с процессами денатурации белка. Полное прекращение деятельности фермента происходит при температурах, близких к 1000С, однако это не относится к термофильным ферментам, которые выдерживают кратковременное нагревание при температуре выше 1000С.Каждый фермент проявляет свое действие в узких пределах значений рН. В определенной зоне активность фермента наибольшая, эта зона называется оптимальной зоной рН. Разные ферменты сильно отличаются по оптимальным для их действия значениям рН. Одни из них имеют наибольшую активность в кислой среде, другие - в нейтральной, третьи - в щелочной. Пепсин желудочного сока имеет оптимум действия при рН 2,0, солодовая α-амилаза - при рН 4,7-5,2. Оптимальное значение рН для действия ферментов зависит в основном от субстрата. Например, при действии папаина на желатин оптимальное значение рН 5,0, а при действии на денатурированный яичный альбумин - 7,5.Скорость биохимических процессов может быть увеличена в присутствии активаторов. Многие ферменты активизируются под действием соединений восстанавливающего действия, в частности, веществами, содержащими сульфгидрильные группы: цистеином, глютатионом. Последний может быть представлен в двух формах: окисленной и восстановленной, активатором является восстановленная форма. Активизирующее действие этих соединений основано на том, что они восстанавливают дисульфидные связи фермента в сульфгидрильные, необходимые для проявления ферментом своей каталитической активности, а сами при этом окисляются за счет превращения сульфгидрильных связей в дисульфидные.Существуют и ингибиторы ферментов, подавляющие их активность. Действие ингибиторов основано на блокировании сульфгидрильных связей фермента и превращении их в дисульфидные группы. Ингибирование фермента может происходить под действием так называемых белковых осадителей - веществ, образующих с белками нерастворимые осадки. Такими веществами являются соли тяжелых металлов (свинца, ртути, вольфрама), трихлоруксусная кислота и др. Эти соединения не являются специфическими, и любое из них может быть использовано для осаждения фермента и полного прекращения его действия. Однако существуют специфические ингибиторы. Оксид углерода СО, например, ингибирует ряд окислительно-восстановительных ферментов, в состав которых входит железо или медь.
24)Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
Модель «ключ-замок»В 1890 г. Эмиль Фишер предположил, что специфичность ферментов определяется точным соответствием формы фермента и субстрата[9]. Такое предположение называется моделью «ключ-замок». Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса. Однако, хотя эта модель объясняет высокую специфичность ферментов, она не объясняет явления стабилизации переходного состояния, которое наблюдается на практике.
Модель индуцированного соответствияВ 1958 г. Дениел Кошланд предложил модификацию модели «ключ-замок»[10]. Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка».
25) Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности и/или подобны по пространственной конфигурации. Особенно консервативны в сохранении строения активные центры молекул изоферментов. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам.Примером фермента, имеющего изоферменты, является гексокиназа, имеющая четыре изотипа, обозначаемых римскими цифрами от I до IV. При этом один из изотипов гексокиназы, а именно гексокиназа IV, экспрессируется почти исключительно в печени и обладает особыми физиологическими свойствами, в частности её активность не угнетается продуктом её реакции глюкозо-6-фосфатом.Ещё одним примером фермента, имеющего изоферменты, является амилаза — панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов. Это послужило основой для разработки и применения более надёжного метода диагностики острого панкреатита путём определения не общей амилазы плазмы крови, а именно панкреатической изоамилазы.Третьим примером фермента, имеющего изоферменты, является креатинфосфокиназа — изотип этого фермента, экспрессируемый в сердце, отличается по аминокислотной последовательности от креатинфосфокиназы скелетных мышц. Это позволяет дифференцировать повреждения миокарда (например, при инфаркте миокарда) от других причин повышения активности КФК, определяя миокардиальный изотип КФК в крови. Однако по ряду свойств изоферменты могут различаться, например по молекулярной активности, по кинетике реакции, по способам регуляции, по стабильности. В основе особенностей изо-ферментов лежат генетически обусловленные различия их первичной структуры, обычно небольшие. Формы ферментов, образующиеся в результате модификации их молекул уже после синтеза, не называют изоферментами. Например, не являются изоферментами фосфорилированная и дефосфорилированная липазы жировой ткани.
26) . Современная классификация и номенклатура ферментов.
1) тривиальная номенклатура 2) рабочая номенклатура З) систематическая номенклатура, т.е. обычно для названия одного и того же фермента очень часто используют несколько названий, поэтому в следствии все возрастающего числа вновь открываемых ферментов было принято международное соглашение о систематической номенклатуре ферментов. В соответствии с этой системой все ферменты в зависимости от типа катализируемой реакции, я еще раз подчеркиваю что в основу положен тип катализируемых реакций, делят на 6 больших классов. В каждом классе выделяют подкласс. В подклассе выделяют под подкласс, а уже там соответственно название конкретного фермента. Шифр фермента для того что бы было понятно о каком ферменте говорит китаец если его читает русский. Например 4 буквенное обозначение 1 -ая класс, 1 подкласс, 1 под подкласс и первый порядковый номер в этом под подклассе, т.е. шифр фермента всегда включает 4-ех цифровое обозначение.Какие же классы по международному соглашению 1961 г. выделяют? а). Оксидоредуктазы - ферменты катализирующие окислительно-восстановительные реакции в организме человека б). Трансферазы - ферменты катализирующие реакции с переносом групп между различными веществами. Например переносящие метильную группу - метилтрансферазы, аминогруппу переносящие - аминотрансферазы и т.д. в). Гидролазы - ферменты катализирующие реакции гидролиза (гидролиз - расщепление с присоединением воды Гидролитических ферментов достаточно много. С пищей мы получаем полимеры, для того чтобы они всасывались их нужно расщепить до мономеров. г). Лиазы -1. ферменты катализирующие присоединение групп по двойной связи (имеется ввидупо месту разрыва двойной связи). 2. Разрыв углерод - углеродной связи, водородными иегидролитическим путем. Например, фермент декарбоксилаза, отщепляющая карбоксильную группу от аминокислоты, как раз относится к лиазам. д). Изомеразы - ферменты катализируют реакции изомеризации. В основном это перенос групп внутри молекул с образованием изомерных форм. Например превращение глюкозы 1- фосфат в глюкозу 6 -фосфат, т.е перенос фосфорильного остатка от первого.е). Лигазы или синтетазы - ферменты которые катализируют образование связи С-С, C-S, C-N, С-О за счет реакции конденсации сопряженных с использованием АТФ, т.е это реакции эндоорганические,требующие притока энергии/ В настоящее время идентифицировано более 2000 различ. ферментов, причем 200 из них получены и используются достаточно хорошо в кристаллическом виде. В наше время ферменты используются не только в медицине, но и в пищевой и хим. промышленности, в народном хоз-ве, для получения особо чистых препаратов (лекарств). Ферменты -специализированные белки обладающие каталитической активностью, т.е. способны ускорять течение химической реакции в организме человека. Ферменты, будучи биокатализаторами, отличаются от обычных катализаторов. Каково значение ферментов в организме человека? Ферменты по праву считают рабочим аппаратом ген. Дело в том, что как реализуют этот фермент? Все зависит от того насколько активны у вас ферменты полученные. Не секрет что сидящие здесь имеют одни и те же ферменты, но ферменты работают у каждого индивидуально. У каждого из нас поддерживается 1. Определенная концентрация ферментов. 2. Поддерживается еще и за счет синтеза активность определенных ферментов, поэтому метаболизм наш в целом очень различается.Ферменты по праву считают функциональными единицами клеточного метаболизма, поскольку большинство реакций протекающих в наших клетках (ежесекундно в наших клетках протекает десятки тысяч разнообразных химических превращений) идут с участием ферментов, за редким исключением. Только в том случае если в ходе реакции образуется какое-то неустойчивое соединение его стабилизация происходит самопроизвольно т.е. не ферментативным путем. Поэтому изучение ферментов имеет огромное значение для понимания метаболизма, для понимания патологий которые могут развиться у человека. Ферменты осуществляют превращение таким образом огромного кол-ва вещ-в, причем в-в поступающих из внешней среды и в-в образующихся в ходе метаболизма, т.е. непосредственно внутри организма.Некоторые болезни человека особенно генетически обусловленные заболевания связаны с недостаточностью или полным отсутствием того или иного фермента.Энзимопатии - патология, причем она может быть наследственная и врожденная поскольку вообще энзимопатии делятся на первичные и вторичные. Первичные - врожденные, наследуемые. Энзимопатия это патология связанная с нарушением синтеза, т.е. синтез прежде всего ферментов недостаточно активных или полным блоком синтеза какого-то фермента Пример врожденной энзимопатии - фенилкетонурия (правильней - фенилпировиноградноолигоприния) т.е. олигос фреиус в переводе на русский - слабоумие связанное с нарушением превращения фенилаланина, дело в том, что и фенилаланина синтезируются гормоны такие как йодированный тиронин, адреналин, хлорадреналин, поэтому те нарушения которые возникают при нарушении оксидинации фенилаланина.С другой стороны патологические состояния, с которыми мы встречаемся, могут быть вызваны избыточной активностью того или иного фермента. В таких случаях удается подобрать препарат ингибирующий активность фермента тем самым помочь больному. Ингибиторы ферменты используются достаточно широко, в том числе и в стоматологии. Очень часто многие лекарственные препарата реализуют свои эффекты воздействуя на ферменты. Измерение активности ферментов плазмы крови, биопсированных тканей имеет огромное значение при диагностики заболевания, а так же контроля за эффективностью проводимого лечения. Часть ферментов используется в качестве лечебных препаратов.
27) Трансферазы. К классу трансфераз относятся рассмотренные выше аминотрансферазы и ацилтрансферазы, а также метилтрансферазы, гликозилтрансферазы, фосфотрансферазы и др. В подкласс фосфотрансфераз входят группа ферментов, называемых киназами: они используют аденозинтрифосфорную кислоту (АТФ) в качестве донора фосфатного остатка.Киназы катализируют перенос у-фосфатного остатка на другие вешества; АТФ при этом превращается в АДФ. Например, глицеринкиназа катализирует фосфорилирование глицерина но а-гидроксильной группе: В результате действия разных киназ в организме синтезируются многочисленные фосфорилированные соединения. В частности, сложные белки фосфопротеины образуются при участии протеинкиназ, остатки фосфорной кислоты присоединяются к гидроксильным группам серина, треонина и тирозина пептидной цепи:Все киназы для проявления максимальной активности нуждаются в ионах Mg2+ или Мn2+.
28)Оксидоредуктазы.
Класс оксидоредуктаз включает ферменты, катализирующие окислительно-восстановительные реакции разных типов. В частности, в него входят НАД-зависимые и флавиновые дегидрогеназы, рассмотренные выше.Другой тип оксидоредуктаз — оксидазы. Эти ферменты катализируют окисление субстратов путем присоединения кислорода. Так, аминоксидазы окисляют амины с образованием альдегидов и аммиака.Образующийся в таких реакциях пероксид водорода разлагается тоже оксидоредуктазой — каталазой (гемопротеин): 2Н202 → 02+2Н20
29) Гидролазы. Эти ферменты катализируют реакции расщепления разнообразных связей с присоединением воды по месту расщепления:К классу гидролаз относятся эстеразы, расщепляющие сложноэфирные связи (например, липаза, холинэстераза); пептидазы, или пептидгидролазы (пепсин, трипсин, карбоксипептидаза и до.) гликозидазы, гидролизующие гликозидные связи, и т д.
a)
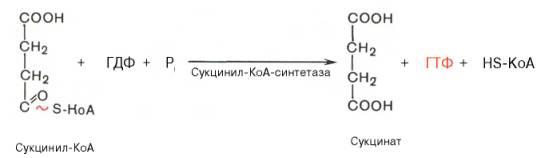
Б)
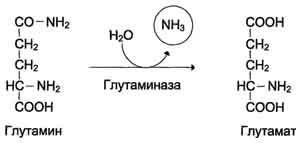
30)Изомеразы – ферменты, катализирующие изомерные превращения в пределах одной молекулы. Изомеразы – сложные ферменты. К их коферментам относятся пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов (глюкозо-1,6-дифосфат) и др.
Выделяют 6 подклассов изомераз в зависимости от типа реакции. Например, в первый подкласс выделяют рацемазы (обратимое превращение L- и D-стереоизомеров) и эпимеразы (превращения изомеров, имеющих более одного центра асимметрии, например, α-D-глюкозу в β-D-глюкозу).
А) фермента аланин-рацемазы
