
Авитаминозы Причины
наследственность;
применение антибиотиков и сульфаниламидных препаратов угнетает здоровую микрофлору кишечника, синтезирующую биотин;
злоупотребление диетами, которые ограничивают нормальное питание;
нарушения пищеварения, обусловленные атрофией слизистой оболочки желудка и тонкого кишечника (синдром мальабсорбции после резекции тонкого кишечника);
регулярное употребление сахарина, который негативно влияет на усвоение и метаболизм биотина, а также угнетает микрофлору кишечника, синтезирующую биотин;
употребление сырых яиц, белок которых содержит гликопротеид авидин, взаимодействующий с биотином;
употребление продуктов, содержащих сернистые соединения в качестве консервантов (E221 — E228) (сернистый ангидрид, образующийся при нагревании таких продуктов, а также при контакте их с воздухом, разрушает биотин);
злоупотребление алкоголем (алкогольные напитки мешают нормальному усвоению биотина).
Проявления
При недостатке биотина наблюдаются:
поражения кожи рук и ног
сухость и нездоровый оттенок кожи
бледный гладкий язык
сонливость, депрессия
болезненность и слабость мышц
гипотония
высокий уровень холестерина и сахара в крови
анемия
потеря аппетита и тошнота
ухудшение состояния волос
замедляется рост.
Биотин в живом организме концентрируется в печени, почках.
41) Аскорби́новая кислота́ — органическое соединение, родственное глюкозе, является одним из основных веществ в человеческом рационе, которое необходимо для нормального функционирования соединительной и костной ткани. Выполняет биологические функции восстановителя и кофермента некоторых метаболических процессов, является антиоксидантом. Биологически активен только один из изомеров — L-аскорбиновая кислота, который называют витамином C. В природе аскорбиновая кислота содержится во многих фруктах и овощах.
По физическим свойствам аскорбиновая кислота представляет собой белый кристаллический порошок кислого вкуса. Легко растворим в воде, растворим в спирте.
Из-за наличия двух асимметрических атомов существуют четыре диастереомера аскорбиновой кислоты. Две условно именуемые L- и D- формы хиральны относительно атома углерода в фурановом кольце, а изо- форма является D-изомером по атому углерода в боковой этиловой цепи.
L-изоаскорбиновая, или эриторбовая, кислота используется в качестве пищевой добавки E315.
Синтетически получают из глюкозы.
Синтезируется растениями из различных гексоз (глюкозы, галактозы)] и большинством животных (из галактозы), за исключением приматов и некоторых других животных (например, морских свинок), которые получают её с пищей.
Биологическая роль
Образование коллагена, серотонина из триптофана, образование катехоламинов, синтез кортикостероидов. Аскорбиновая кислота также участвует в превращении холестерина в желчные кислоты.
Витамин С необходим для детоксикации в гепатоцитах при участии цитохрома P450. Витамин С сам нейтрализует супероксид-анион радикал до перекиси водорода.
Восстанавливает убихинон и витамин Е. Стимулирует синтез интерферона, следовательно, участвует в иммуномодулировании. Переводит трёхвалентное железо в двухвалентное, тем самым способствует его всасыванию.
Тормозит гликозилирование гемоглобина, тормозит превращение глюкозы в сорбит.
42) Коферменты ФМН и ФАД
Флавиновые коферменты ФМН и ФАД найдены в дегидрогеназах, оксидазах и монооксигеназах. Обычно оба соединения ковалентно связаны с ферментами. Активной группой обоих коферментов является флавин , имеющий сопряженную систему из трех колец, которая может при восстановлении принимать два электрона и два протона. В ФМН к флавину присоединен фосфорилированный полиол рибит. ФАД состоит из ФМН, связанного с АМФ. Восстановление флавиновых коф-тов осуществляется через ряд промежут. стадий, включающих обр-ние радикалов. Главная ф-ция флавиновых коф-тов - перенос электронов (водорода) в окислит.-восстановит. цепи от НАДН и янтарной к-ты к цитохромам. Флавопротеиды катализируют также многочисл. р-ции, механизм к-рых включает стадию одноэлектронного переноса; окисление восстановл. формы амида липоевой к-ты, синтез кобамидного коф-та из АТФ и вит-а В12, окислениеглюкозы и др.
43) Важнейшие коферменты НАД и НАДФ.
Никотинамидные коферменты - коферментная форма витамина ниацина. К этой группе коферментов, универсальных по распространению и биол. роли, относятся НАД и НАДФ, а также восстановленные (по пиридиновому кольцу) формы этих соед. (соотв. НАДН и НАДФН); наиб.важная биохим. функция этих коферментов - их участие в переносе электронов и водорода от окисляющихся субстратов к кислороду в клеточном дыхании. При участии НАД или НАДФ, связанных прочно или легко диссоциирующих, ферменты дегидрогеназы катализируют обратимое превращ. спиртов, гидроксикислот и нек-рых аминокислот в соответствующие альдегиды, кетоны или кетокислоты.
44)коА
КоА, кофермент ацетилирования (или ацилирования), важнейший из коферментов, принимающий участие в реакциях переноса ацильных групп.
С КоА связан обширный круг биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза липидов, окислительных превращений продуктов распада углеводов и т. д. Во всех случаях КоА действует как промежуточное соединение, связывающее (акцептирующее) и переносящее кислотные остатки на др. вещества. При этом кислотные остатки либо подвергаются в составе соединения с КоА тем или иным превращениям, либо передаются без изменений на определённые метаболиты. «Активную» форму органических кислот представляют ацильные остатки, присоединённые к сульфгидрильной (SH) группе КоА макроэргической ацилтиоэфирной связью. Пантотеноваяк-тав виде КоА участвует в УГном и жировом обмене, в синтезеацетилхолина, в коре надпочечников стимулирует обр-ниекортикостероидов.
Карбоксилазныереакции:
CH3–CO–S-KoA + CO2 + АТФ<=> HOOC–CH2–CO–KoA + АДФ
метилмалонил-оксалоацетат-транскарбоксилазная реакция, катализ.обратимое превраще-ние пировиноградной и щавелевоуксусной кислот:

Метилмалонил-КоА Пируват Пропионил-КоА Оксалоацетат
В организме человека изуказанных процессов открыта только реакция изомеризации метилмалонил-КоА в сукцинил-КоА.

L-метилмалонил-КоА Сукцинил-КоА
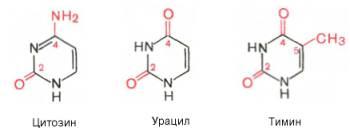
45) Азо́тистые основа́ния — гетероциклические органические соединения, производные пиримидина и пурина, входящие в состав нуклеиновых кислот. Для сокращенного обозначения пользуются большими латинскими буквами. К азотистым основаниям относят аденин (A), гуанин (G), цитозин (C), которые входят в состав как ДНК, так и РНК. Тимин (T) входит в состав только ДНК, а урацил (U) встречается только в РНК.
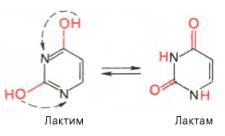
Пиримидиновые основания – производные пиримидина, входящие в состав нуклеиновых кислот: урацил, тимин, цитозин. Для оснований, содержащих группу –ОН, характерно подвижное равновесие структурных изомеров, обусловленное переносом протона от кислорода к азоту и наоборот:
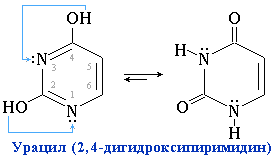
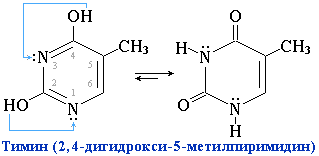

Подобное динамическое равновесие структурных изомеров называют "таутомерией".
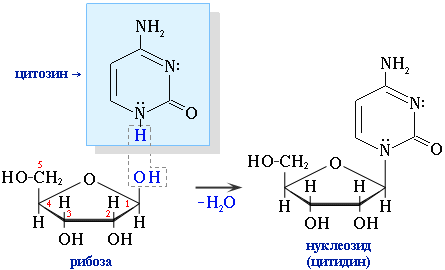
Пиримидиновые основания входят в состав нуклеозидов — структурных компонентов нуклеиновых кислот. Нуклеозиды образуются за счет отщепления водорода от N–H-связи в молекуле азотистого основания и гидроксила при С1 в молекуле углевода рибозы (или 2-дезоксирибозы).Здесь проявляются нуклеофильные свойства амина (группа :N–H в азотистом гетероцикле) и способность к нуклеофильному замещению полуацетальногогидрокисила (при С1) в молекуле углевода.
46,47) Мажорные-минорные осн, пуриновые-пиримидиновые
НК (ДНК и РНК) относятся к сложным высокомол соед, сост из небольшого числа индивид хим компонентов более простого строения. Так, при полном гидролизе НК (нагревание в присутствии хлорной кислоты) в гидролизате обнаруживают пуриновые и пиримидиновые основания, углеводы (рибоза и дезоксирибоза) и фосфорную кислоту. В мол-леДНКуглевод представлен дезоксирибозой, а в молекулеРНК – рибозой, отсюда их названия: дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК) кислоты. Кроме того, они содержат фосфорную кислоту, по два пуриновых и по два пиримидиновых основания; различия только в пиримидиновых основаниях: в ДНК содержится тимин, а в РНК – урацил. В составе ДНК и РНК открыты так называемые минорные (экзотические) азотистые основания .Углеводы (рибоза и дезоксирибоза) в молекулахДНК и РНК находятся в β-D-рибофуранозной форме:

Основу стр-ры пуриновых и пиримидиновых оснований составляют два ароматических гетероциклических соединения – пиримидин и пурин :

Мол-лапуринасост из 2 конденсированных колец: пиримидина и имидазола.
В составе нуклеиновых кислот встречаются три главных пиримидиновых основания: цитозин, урацил и тимин.
Помимо главных пиримидиновых оснований, в составе нуклеиновых кислот открыты минорные пиримидиновые основания, 5-метил- и 5-окси-метилцитозин, дигидроурацил, псевдоурацил, 1-метилурацил, оротовая кислота, 5-карбоксиурацил, 4-тиоурацил и др. только для тРНК список минорных оснований приближается к 50. На долю минорных оснований приходится до 10% всех нуклеотидовтРНК, что имеет, очевидно, важный физиологический смысл (защита молекулыРНК от действия гидролитических ферментов). Стр-рные формулы ряда минорных пиримидиновых оснований представлены в форме нуклеозидов – соединений с углеводным компонентом:
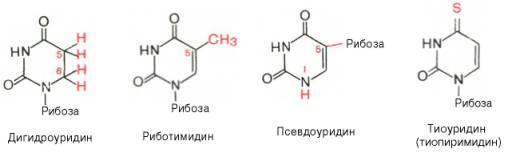
Два пуриновых основания, постоянно встречающихся в гидролизатах нуклеиновых кислот, имеют следующее строение:

К минорным нуклеозидам пуринового ряда, обнаруживаемым в составе ДНК и РНК, относятся инозин, N6-метиладенозин, N2-метилгуанозин, ксантин, гипоксантин, 7-метилгуанозин и др.
48) Таутомерные превращения азотистых оснований
Одним из важных св-в свободных АО (содержащих оксигруппы) явл возм-сть их сущ-ния в 2 таутомерных формах, явление таутомерии заключается в том, что вещество определенного состава и молекулярного веса существует в виде равновесной смеси двух или нескольких изомеров, легко переходящих друг в друга, в частности лактим- и лактамной формах, в завис от знач рН среды: при рН 7,0 они представл в лактамной форме, при снижении велич рН – в лактимной форме. Таутомерные превращения можно представить на примереурацила.
49, 50) Нуклеоти́ды—фосфорные эфиры нуклеозидов, нуклеозидфосфаты. Свободные нуклеотиды, в частности АТФ, цАМФ, АДФ, служат в клетках переносчиками энергии, а также являются составляющими частями нуклеиновых кислот и многих коферментов (органические соединения небелковой природы – компонент некоторых ферментов) и других биологически активных веществ.Молекула каждого нуклеотида (мононуклеотида) состоит из трёх химически различных частей. Во-первых, это пятиуглеродный сахар (пентоза) – рибоза (в этом случае нуклеотиды называются рибонуклеотидами и входят в состав рибонуклеиновых кислот, или РНК) или дезоксирибоза (нуклеотиды называются дезоксирибонуклеотидами и входят в состав дезоксирибонуклеиновых кислот, или ДНК). Во-вторых, это пуриновое или пиримидиновое азотистое основание. Связанное с углеродным атомом сахара, оно образует соединение, называемое нуклеозидом. И наконец, один, два или три остатка фосфорной кислоты, присоединённые эфирными связями к углероду сахара, образуют молекулу нуклеотида. Азотистые основания нуклеотидов ДНК – это пурины аденин и гуанин и пиримидины цитозин и тимин. Нуклеотиды РНК содержат те же основания, что и ДНК, но тимин в них заменён близким по химическому строению урацилом. Азотистые основания и, соответственно, включающие их нуклеотиды в биологической литературе принято обозначать начальными буквами (латинскими или русскими) их названий: аденин – А(А), гуанин – G(Г), цитозин – С(Ц), тимин – Т(Т), урацил – U(У). Соединение двух нуклеотидов называется динуклеотидом, нескольких – олинонуклеотидом, множества – полинуклеотидом, или нуклеиновой кислотой. Кроме того что нуклеотиды образуют цепи ДНК и РНК, они являются коферментами, а нуклеотиды, несущие три остатка фосфорной кислоты (нуклеозидтрифосфаты), – источниками химической энергии, заключённой в фосфатных связях. Чрезвычайно велика во всех процессах жизнедеятельности роль такого универсального переносчика энергии, как аденозинтрифосат (АТФ). Особую группу составляют циклические нуклеотиды, опосредующие действие гормонов при регуляции обмена веществ в клетках.В водных растворах нуклеотиды подвергаются таутомерии. Основная таутомерная форма азотистых оснований – лактамная форма.
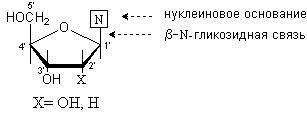
Нуклеозиды и нуклеотиды
Нуклеозиды – это N-гликозиды, образованные нуклеиновыми основаниями и рибозой или дезоксирибозой. Между аномерным атомом углерода моносахарида и атомом азота в положении 1 пиримидинового цикла или атомом азота в положении 9 пуринового цикла образуется b -гликозидная связь.
В зависимости от природы моносахаридного остатка нуклеозиды делят на рибонуклеозиды (содержат остаток рибозы) и дезоксирибонуклеозиды (содержат остаток дезоксирибозы). Названия нуклеозидов строят на основе тривиальных названий нуклеиновых оснований, добавляя окончание –идин для производных пиримидина и -озин для производных пурина. К названиям дезоксирибонуклеозидов добавляют приставку дезокси-. Исключение составляет нуклеозид, образованный тимином и дезоксирибозой, к которому приставка дезокси- не добавляется, так как тимин образует нуклеозиды с рибозой лишь в очень редких случаях.
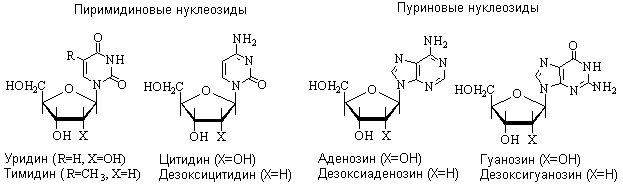
Для обозначения нуклеозидов используются однобуквенные обозначения, входящих в их состав нуклеиновых оснований. К обозначениям дезоксирибонуклеозидов ( за исключением тимидина) добавляется буква ”д”. Наряду с представленными на схеме основными нуклеозидами в составе нуклеиновых кислот встречаются минорные нуклеозиды, содержащие модифицированные нуклеиновые основания.В природе нуклеозиды встречаются также в свободном состоянии, преимущественно в виде нуклеозидных антибиотиков, которые проявляют противоопухолевую активность. Нуклеозиды-антибиотики имеют некоторые отличия от обычных нуклеозидов в строении либо углеводной части, либо гетероциклического основания, что позволяет им выступать в качестве антиметаболитов, чем и объясняется их антибиотическая активность.
нуклеозиды устойчивы к действию щелочей, но расщепляются под действием кислот с образованием свободного моносахарида и нуклеинового основания. Пуриновые нуклеозиды гидролизуются значительно легче пиримидиновых.
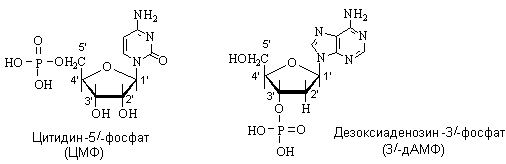
Нуклеотиды.Нуклеотиды – это эфиры нуклеозидов и фосфорной кислоты (нуклеозидфосфаты). Сложноэфирную связь с фосфорной кислотой образует ОН группа в положении 5/ или 3/ моносахарида. В зависимости от природы моносахаридного остатка нуклеотиды делят на рибонуклеотиды (структурные элементы РНК) и дезоксирибонуклеотиды (структурные элементы ДНК). Названия нуклеотидов включают название нуклеозида с указанием положения в нем остатка фосфорной кислоты. Сокращенные обзначения нуклеозидов содержат обозначение нуклеозида, остатка моно-, ди- или трифосфорной кислоты, для 3/-производных указывается также положение фосфатной группы.
Нуклеотиды являются мономерными звеньями, из которых построены полимерные цепи нуклеиновых кислот. Некоторые нуклеотиды выполняют роль коферментов и участвуют в обмене веществ.
51) Циклические аденозинмонофосфаты,стр-ра функции
Циклический аденозинмонофосфат (циклический AMФ, цAMФ, cAMP) — производное АТФ, выполняющее в организме роль вторичного посредника, использующегося для внутриклеточного распространения сигналов некоторых гормонов (например, глюкагона или адреналина), которые не могут проходить через клеточную мембрану; бусцветные крист.

Образуется из АТФ под действием фермента аденилциклазы: фосфатная группа соединена с атомами углерода в 3’- и 5’-положениях рибозы.цAMФ синтезируется аденилатциклазой в ответ на некоторые гормональные стимуляторы; действует как вторичный посредник при клеточном гормональном контроле путем стимуляции протеинкиназ; является аллостерическим эффектором протеинкиназ A и ионных каналов. Синтезируется мембранными аденилатциклазами. Расщепление цАМФ с образованием АМФ катализируется фосфодиэстеразами. Ингибируются цАМФ только при высоких концентрациях метилированных производных ксантина. цAMФ осуществляет функции вторичного внутриклеточного посредника в действии первичных посредников (веществ, имеющих короткий период биодеградации) — например, ряда гормонов и нейромедиаторов; опосредует биологическую функцию гормонов путем активации (инактивации) клеточных протеинкиназ (фосфатаз). Протеинкиназы, в свою очередь, фосфорилируют эффекторные белки и изменяют (увеличивают или уменьшают) их активность.
52) . отличия и сходста ДНК и РНК
ДНК – это полинуклеотиды, полианионы, неразветвленные и нерегулярные, исключит крупные биополимеры. Сущ-ют линейные и замкнутые (кольцевые), одно- и двухцепоч полинуклеотиды. По особенностям хим строения НК делят на ДНК и РНК. Есть несколько типов ДНК: хромосомная (ядерная, нуклеоидная) и внехромосомная (митохондриальная, хлоропластная ДНК, плазмидная ДНК и др.). Все НК роднит принцип сходство стр. В природных олиго- и полинуклеотидах мономеры (нуклеотиды) связаны 3’,5’-фосфодиэфирными связями. При глубоком гидролизе разрушаются не только фосфодиэфирные, но и гликозидные связи, и нуклеиновые кислоты распадаются до азотистых оснований, моносахаридов и фосфорной кислоты. Как известно, в число канонических (основных) азотистых осн в сост ДНК преимущ входят А, Г, Ц т Т, а в сост РНК - А, Г, Ц и У. Реже встречающиеся (минорные) пуриновые и пиримидиновые азотистые основания явлются продуктами О-, С- или N-алкилирования канонических азотистых оснований. В тРНК минорные основания могут составлять до 19 %, а в ДНК проростков злаковых, в молоках рыб – до 8-10 %. У эукариотов ДНК в основном локализована в ядре, а также в митох и хлоропл, где сост несколько процентов от общего кол-ва клет ДНК. У прокариотов ДНК представлена в виде нуклеоида (бактер хромосома), а также в виде внехром-ной плазмидной ДНК. Только хром-ная ДНК эукариот способна обр-вать нуклеопротеины, динамичные комплексы со специфич ДНК-связывающими белками, и формирует видоспецифическую структуру хромосом. У вирусов ДНК весьма плотно упакована в комплексе с белками.
РНК гетерогенна и предст в виде: мРНК – 3-5 %; тРНК – около 10 %; рРНК – около 85 % от общего кол-ва РНК в кл. Молекулы РНК менее крупные, чем ДНК, и всегда одноцепочечные. Все виды РНК представляют собой продукты транскрипции ДНК. У эукариотов РНК локализована в ядре, митох, хлоропластах и цитоплазме. Абсолютное содержание ДНК и РНК, а также их соотношение сильно варьирует в клетках разных видов и в разных клетках одного вида. Следует заметить, что во внеклеточной среде обнаруживаются только следовые количества нуклеиновых кислот, по-видимому, в силу быстрого ферментативного гидролиза активными нуклеазами. Доля ДНК в метаболически активной клетке значительно меньше, чем в метаболически неактивной: например, в сперматозоидах ДНК составляет около 60 % сухого вещества, а в мышцах лишь 0,2%. С другой стороны величина отношения содержания РНК к содержанию ДНК в клетке тем выше, чем выше ее метаболическая активность. Сложность и размеры ДНК увеличиваются с усложнением организации живых организмов, параллельно с усложнением организации, увеличивается доля некодирующей ДНК (многократные повторы, интроны, регуляторные участки).
53) Первичная структура нуклеиновых кислот
Под первичной структурой нуклеиновых кислотпонимают порядок, последовательность расположения мононуклеотидов в полинуклеотидной цепиДНКиРНК. Такая цепь стабилизируется 3',5'-фосфодиэфирными связями. Посколькумолекулярная массануклеиновых кислотколеблется в широких пределах (от 2•104 до 1010–1011), установить первичную структуру всех известных РНКи особенноДНКвесьма сложно. Тем не менее во всехнуклеиновых кислотах(точнее, в одноцепочечнойнуклеиновой кислоте) имеется один и тот же тип связи – 3',5'-фосфодиэфирная связь между соседниминуклеотидами. Эту общую основу структуры можно представить следующим образом:
Установлено, что в образовании межнуклеотидной связи участвуют гидроксильные группы в 3'- и 5'-положениях остатков углевода. К настоящему времени удалось определить первичную структуру почти всех тРНК, ряда молекул 5S рРНК, 16S рРНК E.coli, вирусных РНК, в состав которых входят сотни и тысячи нуклеотидных остатков.
Полинуклеотидная цепь молекулыРНК имеет на одном конце почти всегда свободный монофосфорный эфир, который принято обозначать как 5'-конец; на противоположном конце цепи такой фосфат отсутствует, а содержится нуклеотид со свободными 2'- и 3'-гидроксильными группами. Если подвергнуть щелочному гидролизумолекулуРНК, то в качестве концевого нуклеотида будут обнаружены ЦМФ со свободным фосфатом у 5'-конца и свободныйаденозин в виде свободного нуклеозида у 3'-конца полинуклеотидной цепи.
В выяснении первичной структуры РНК решающую роль сыграли методы ступенчатого гидролиза, осуществленного в основном экзонуклеа-зами и заключающегося в последовательном отщеплении по одному мононуклеотиду с одного конца молекулынуклеиновой кислоты.
Следует особо указать на две существенные особенности первичной структуры всех тРНК. Первая из них заключается в том, что 5'-концом всегда является гуаниловая (редко цитидиловая) кислота, несущая свободный остаток фосфата у С-5'. Вторая особенность – наличие на противоположном конце молекулы остатков трех мононуклеотидов с одинаковой последовательностью – ЦЦА, причем остаток адениловой кислоты содержит свободную 3'-ОН-группу.
Между этими структурами в строго определенной последовательности располагаются все остальные нуклеотидные остатки, среди которых на долю минорных нуклеотидов приходится до 10%. Полинуклеотидная цепь разных типов тРНК содержит около 75 нуклеотидов.
Матричные (информационные) РНК относятся к наиболее гетерогенному классу нуклеиновых кислот, отличающихся по массе, структуре, размерам, стабильности и функциям. Основной функцией мРНК является перенос информации от ДНК (точнее, от гена) на белоксинте-зирующую систему клетки. мРНК выполняет роль матрицы и, следовательно, определяет первичную структуру синтезируемого белка. мРНК наделены рядом особенностей первичной структуры; в частности, на 5'-конце все они содержат определенную последовательность рибонуклеотидов, получившую название шапочки (кэп). Роль «кэпирования» и «полиаденилирования» мРНК в белковом синтезе окончательно не выяснена. Предполагают, что кэп необходим для специфического узнавания в процессе трансляции, в то время как поли-А отводится роль фактора стабилизации всей молекулымРНК.
В настоящее время проводятся исследования первичных структур различных молекулДНК. Около 15 лет назад была полностью расшифрована нуклеотидная последовательность митохондриальной ДНК человека (16569 пар нуклеотидов). Известны полные нуклеотидные последовательностиДНК ряда вирусов и плазмид. Исследователи активно работают над полной расшифровкой генома человека.
Результаты секвенирования (определение нуклеотидной последовательности) разных молекулДНК накапливаются в виде компьютерных банков данных. Ниже представлены три варианта схемы нуклеотидной последовательностиДНК:

В последнее время о первичной структуре ДНК (точнее, отдельных ее фрагментов) судят по ряду косвенных данных, например, по степени сплоченности нуклеотидных звеньев в молекулеДНК (определение сводится в конечном счете к выяснению числа и структуры отдельных фракций нуклеотидов, так называемых изоплитов), также по кинетикереассоциацииДНК (метод позволяет выяснить наличие в молекуле повторяющихся последовательностей нуклеотидов). О первичной структуре ДНК судят, кроме того, по распределению минорных оснований (имеются данные о существовании подобной закономерности) и обнаружению в ДНК и определению последовательности палиндромов («обратно бегущие» последовательности, или перевертыши), которые обнаруживаются главным образом в местах рестрикции. Большие надежды в определении первичной структуры ДНК исследователи возлагают на физические, химические (синтез генов), генетические и другие методы, а также на методы выделения некоторых генов (или их фрагментов) из природных источников и синтеза генов на мРНК при участии ферментаобратной транскриптазы. Для установления первичной структуры ДНК недавно предложен экспресс-метод, включающий применение двух ДНК-полимераз.
54) Под вторичной структурой нуклеиновых кислот понимают пространственно упорядоченные формы полинуклеотидных цепей.Вторичная структура ДНК представляет собой две параллельные неразветвленные полинуклеотидные цепи, закрученные вокруг общей оси в двойную спираль. Такая пространственная структура удерживается множеством водородных связей, образуемых азотистыми основаниями, направленными внутрь спирали. Водородные связи возникают между пуриновым основанием одной цепи и пиримидиновым основанием другой цепи. Эти основания составляют комплементарные пары.
ТИМИН (Т) комплементарен АДЕНИНУ (А),
ЦИТОЗИН (Ц) комплементарен ГУАНИНУ (Г).
Комплементарность оснований определяет комплементарность цепей в молекулах ДНК. Она характер. Следующими свойствами:
хранения и передачи наследственных признаков.
молекулы ДНК способны к репликации (удвоению)
молекулы ДНК могут направлять совершенно точным и определенным образом синтез белков, специфичных для организмов данного вида.
55) Пра́вила Ча́ргаффа — система эмпирически выявленных правил, описывающих количественные соотношения между различными типами азотистых оснований в ДНК. Были сформулированы в результате работы группы биохимика Эрвина Чаргаффа в 1949—1951 гг.
До работ группы Чаргаффа господствовала так называемая «тетрануклеотидная» теория, согласно которой ДНК состоит из повторяющихся белков по четыре разных азотистых основания (аденин, тимин, гуанин и цитозин). Чаргаффу и сотрудникам удалось разделить нуклеотиды ДНК при помощи бумажной хроматографии и определить точные количественные соотношения нуклеотидов разных типов. Они значительно отличались от эквимолярных, которых можно было бы ожидать, если бы все четыре основания были представлены в равных пропорциях. Соотношения, выявленные Чаргаффом для аденина (А), тимина (Т), гуанина (Г) и цитозина (Ц), оказались следующими:
Количество аденина равно количеству тимина, а гуанина — цитозину: А=Т, Г=Ц.
Количество пуринов равно количеству пиримидинов: А+Г=Т+Ц.
Количество оснований с аминогруппами в положении 6 равно количеству оснований с кетогруппами в положении 6: А+Ц=Г+Т.
Вместе с тем, соотношение (A+Т):(Г+Ц) может быть различным у ДНК разных видов. У одних преобладают пары АТ, в других — ГЦ.
Правила Чаргаффа, наряду с данными рентгеноструктурного анализа, сыграли решающую роль в расшифровке структуры ДНК Дж. Уотсоном и Фрэнсисом Криком.
Комплемента́рность (в химии, молекулярной биологии и генетике) — взаимное соответствие молекул биополимеров или их фрагментов, обеспечивающее образование связей между пространственно взаимодополняющими (комплементарными) фрагментами молекул или их структурных фрагментов вследствие супрамолекулярных взаимодействий (образование водородных связей, гидрофобных взаимодействий, электростатических взаимодействий заряженных функциональных групп и т. п.).
Взаимодействие комплементарных фрагментов или биополимеров не сопровождается образованием ковалентной химической связи между комплементарными фрагментами, однако из-за пространственного взаимного соответствия комплементарных фрагментов приводит к образованию множества относительно слабых связей (водородных и ван-дер-ваальса) с достаточно большой суммарной энергией, что приводит к образованию устойчивых молекулярных комплексов.
Вместе с тем, следует отметить, что механизм каталитичекой активности ферментов определяется комплементарностью фермента и переходного состояния либо промежуточного продукта катализируемой реакции — и в этом случае может происходить обратимое образование химической связи.
56) Каждая молекула ДНК упакована в отдельную хромосому. В диплоидных клетках человека содержится 46 хромосом. Общая длина ДНК всех хромосом клетки составляет 1,74 м, но она упакована в ядре, диаметр которого в миллионы раз меньше. Чтобы расположить ДНК в ядре клетки, должна быть сформирована очень компактная структура. Компактизация и суперспирализация ДНК осуществляются с помощью разнообразных белков, взаимодействующих с определёнными последовательностями в структуре ДНК. Все связывающиеся с ДНК эукариотов белки можно разделить на 2 группы: гисгоновые и негистоновые белки. Комплекс белков с ядерной ДНК клеток называют хроматином.
Гистоны - белки с молекулярной массой 11-21 кД, содержащие много остатков аргинина и лизина. Благодаря положительному заряду гистоны образуют ионные связи с отрицательно заряженными фосфатными группами, расположенными на внешней стороне двойной спирали ДНК.
Существует 5 типов гистонов. Четыре гистона Н2А, Н2В, НЗ и Н4 образуют октамерный белковый комплекс (Н2А, Н2В, НЗ, Н4)2, который называют "нуклеосомный кор" (от англ. nucleosome core). Молекула ДНК "накручивается" на поверхность гистонового октамера, совершая 1,75 оборота (около 146 пар нуклеоти-дов). Такой комплекс гистоновых белков с ДНК служит основной структурной единицей хроматина, её называют "нуклеосома". ДНК, связывающую нуклеосомные частицы, называют линкерной ДНК. В среднем линкерная ДНК составляет 60 пар нуклеотидных остатков. Молекулы гистона H1 связываются с ДНК в межнуклеосомных участках (линкерных последовательностях) и защищают эти участки от действия нуклеаз (рис. 4-8).
В ядре каждой клетки присутствует около 60 млн молекул каждого типа гистонов, а общая масса гистонов примерно равна содержанию ДНК. Аминокислотные остатки лизина, аргинина и концевые аминогруппы гистонов могут модифицироваться: ацетилироваться, фосфорилироваться, метилироваться или взаимодействовать с белком убиквитином (неги-стоновый белок). Модификации бывают обратимыми и необратимыми, они изменяют заряд и конформацию гистонов, а это влияет на взаимодействие гистонов между собой и с ДНК. Активность ферментов, ответственных за модификации, регулируется и зависит от стадии клеточного цикла. Модификации делают возможными конформационные перестройки хроматина.
Негистоновые белки хроматина
В ядре эукариотической клетки присутствуют сотни самых разнообразных ДНК-связывающих негистоновых белков. Каждый белок комплементарен определённой последовательности нуклео-тидов ДНК (сайт ДНК). К этой группе относят семейство сайт-специфических белков типа "цинковые пальцы". Каждый "цинковый палец" узнаёт определённый сайт, состоящий из 5 нуклеотидных пар. Другое семейство сайт-специфических белков - гомодимеры. Фрагмент такого белка, контактирующий с ДНК, имеет структуру "спираль-поворот-спираль" (см. раздел 1). К группе структурных и регуляторных белков, которые постоянно ассоциированы с хроматином, относят белки высокой подвижности (HMG-белки - от англ, high mobility gel proteins). Они имеют молекулярную массу менее 30 кД и характеризуются высоким содержанием заряженных аминокислот. Благодаря небольшой молекулярной массе HMG-белки обладают высокой подвижностью при электрофорезе в полиакриламидном геле. К негистоновым белкам принадлежат также ферменты репликации, транскрипции и репарации. При участии структурных, регуляторных белков и ферментов, участвующих в синтезе ДНК и РНК, нить нуклео-сом преобразуется в высококонденсированный комплекс белков и ДНК. Образованная структура в 10 000 раз короче исходной молекулы ДНК.
57) Дезоксирибонуклеи́новая кислота́ (ДНК) — один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетическойпрограммы развития и функционирования живых организмов. Основная роль ДНК в клетках — долговременное хранение информации о структуре РНК и белков.В клетках эукариот (например, животных или растений) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами. Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов.
С химической точки зрения, ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков, нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы и фосфатной группы. В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула спирализована. В целом структура молекулы ДНК получила название «двойной спирали».
В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин). Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином, гуанин — только с цитозином. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции и принимают участие в биосинтезе белков (процессе трансляции). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции.
58) Основные свойства генетического кода
Код триплетен. В состав РНК входят 4 нуклеотида: А, Г, Ц, У. Природа создала трехбуквенный, или триплетный, код. Это означает, что каждая из 20 АМК зашифрована последовательностью трех нукл-ов, называемых триплетом или кодоном
Код непрерывный. Это означает, что в коде отсутствуют сигналы, показывающие конец одного кодона и начало следующего. Поэтому рамка считывания должна быть правильно установлена в начале прочтения м-лы иРНК и затем двигаться последовательно от одного триплета к следующему. Если исходная рамка считывания оказалась «сбитой» в результате делеции или вставки на 1 или 2 нуклеотида, или же если рибосома случайно «пропустит» один нуклеотид в иРНК, все последующ кодоны выйдут из правильной рамки и это приводит к обр-нию белка с искаженной АМКной послед-стью.
Код неперекрывающийся. В случае неперекрывающегося триплетного кода каждая группа из трех нукл-ов кодирует только одну АМКу
Код вырожденный. Слово «вырожденность» – это матем термин, означающий в данном случае, что 1 АМКе может соотв больше одного кодона. Вырожденность кода вовсе не означает его несовершенство, поскольку нет ни одного кодона, к-рый бы кодировал несколько АМК. В физиологич усл код
Однозначен: каждый кодон обозначает только одну АМКу. Вырожденность кода для различных АМК разная. Исключ состметионин (AUG) и триптофан (UGG),кодирующиеся одним кодоном. Эти 2 АМКы встречаются в белках достаточно редко. Кодоны для гидрофобных АМК, например фенилаланина, лейцина, изолейцина и валина, различаются только одним основанием. Аналогичная ситуация наблюдается и для кодонов серина и треонина или аланина и глицина. При такой организации кода случайно возникшая замена основания с большей вероятностью, чем при случайном подборе кодонов, приведет к замене на сходную по свойствам АМКу или же замены не произойдет вовсе.
Код универсальный. Ген код един для всех живущих на Земле существ. У бактерий и грибов, пшеницы и хлопка, рыб и червей, лягушки и человека одни и те же триплеты кодируют одни и те же АМКы.
Отсутствие знаков препинания
Колинеарность – соответ послед-ти кодонов ДНК послед-ти АМК в белке.
Бессмысленные кодоны: УАА, УАГ, УГА
59) мРНК, строение и роль
мРНК (синоним — информацио́нная РНК, иРНК) — РНК, содержащая информацию о первичной структуре (аминокислотной последовательности) белков.мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.Длина типичной зрелой мРНК составляет от нескольких сотен до нескольких тысяч нуклеотидов.Эукариотические молекулы мРНК часто требуют сложной обработки и транспортировки из ядра — места синтеза мРНК, на рибосомы, где происходит трансляция, в то время как прокариотические молекулы мРНК этого не требуют и синтез РНК у них сопряжён с синтезом белка.Зрелая мРНК состоит из нескольких участков, различающихся по функциям: «5' кэп», 5' нетранслируемая область, кодирующая (транслируемая) область, 3' нетранслируемая область и 3' полиадениновый «хвост».5' кэп — это модифицированный гуанидиновый нуклеотид, который добавляется на 5' (передний) конец незрелой мРНК.Кодирующие области состоят из кодонов — следующих непосредственно друг за другом последовательностей из трёх нуклеотидов, каждая из которых соответствует в генетическом коде определённой аминокислоте или началу и концу синтеза белка.Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5'-нетранслируемая область и 3'-нетранслируемая область, соответственно.Длинная последовательность адениновых оснований, которая присутствует на 3' «хвосте» мРНК эукариот, синтезируется ферментом полиаденилат-полимеразой.Кроме первичной структуры (последовательности нуклеотидов), мРНК обладает вторичной структурой. Вторичная структура мРНК основана на внутримолекулярных взаимодействиях (линейная молекула «складывается», и водородные связи возникают между разными участками одной и той же молекулы).Осн назнач мРНК – переписывание ген инф-ции о первич стр-ре кодируемых белков с ДНК и участие в качестве матрицы в рибосомальном биосинтезе белков и пептидов.
60) тРНК, биороль
ТРАНСПОРТНЫЕ РИБОНУКЛЕИНОВЫЕ КИСЛОТЫ- низкомолекулярные РНК, осуществляющие перенос аминокислотных остатков к матричной РНК (мРНК) при трансляции. Присутствуют в цитоплазме и митохондриях. Цитоплазматич. тРНК состоят из одной полирибонуклеотидной цепи, включающей 74-95 нуклеотидных остатков, митохондриальные тРНК немного короче. Для всех молекул тРНК характерно присутствие остатка фосфорной к-ты на 5'-конце, наличие последовательности ССА—ОН (С-остаток цитидина, А-аденозина) на 3'-конце и неск. консервативных нуклеотидных остатков, рассеянных вдоль цепи и занимающих во всех тРНК одни и те же положения.Отличит. особенность тРНК-присутствие в молекуле минорных нуклеозидов (миноров), Большинство миноров влияет на стабильность пространственной структуры и(или) на адапторную ф-цию тРНК-способность каждой тРНК узнавать свой кодон . Более половины пуриновых и пиримидиновых оснований тРНК с помощью водородных связей образуют внутрицепочечные пары по принципу комплементарности (A-U, G-C, G-U; U и G-соотв. остатки уридина и гуанозина), формируя 4 двухспиральных участка. Эти короткие спирали чередуются с участками неспаренных оснований, в результате чего нуклеотидная цепь образует 3 петли. Таким образом формируется вторичная структура, получившая назв. клеверного листа . В ней выделяют: акцепторную ветвь; дигидроуридиловую ветвь (шпильку); антикодоновую ветвь (шпильку); тимидилпсевдоуридиловую ветвь, или Ty-шпильку. Число генов, кодирующих тРНК для одной и той же аминокислоты, может различаться у разных организмов более чем на порядок. Помимо акцепторно-адапторной ф-ции в белковом синтезе, мн. тРНК выполняют роль затравки при обратной транскрипции (синтезе ДНК на РНК-матрице). На 3'-концах РНК мн. вирусов растений присутствуют тРНК-подобные структуры, обладающие акцепторной активностью. Нек-рые тРНК участвуют в биосинтезе пеп-тидогликанов (компонентов внеш. оболочки нек-рых бактерий), в переносе аминокислот через внеш. мембрану клеток, в регуляции биосинтеза ряда аминокислот, в посттрансляционной модификации белков (перенос аминокислотного остатка от аминоацил-тРНК на N-конец полипептидной цепи под действием ферментов аминоацил-тРНК-протеин трансфераз), а также во внутриклеточной деградации белков. Имеются данные об участии тРНК как кофактора в р-ции восстановления глутаминовой к-ты при биосинтезе хлорофилла.
Какое минимальное число нуклеотидных пар содержится в гене, кодирующем полипептид, состоящий из 124 аминокислотных остатков? Почему число нуклеотидных пар может оказаться гораздо больше, чем в ответе?
124*3+3*2=378. Число нуклеотидных пар может оказаться намного больше потому что есть некодирующие участки, такие как промотер, терминатор, интроны.
Как может повлиять изменение одного азотистого основания в мРНК на аминокислотную последовательность полипептида?
При изменении одного азотистого основания в мРНК аминокислотная последовательность полипептида также изменится, поскольку
Макроэргические соединения: АТФ и другие нуклеозидтрифосфаты, креатинфосфат, аргининфосфат и другие. Напишите структурную формулу АТФ. Укажите макроэргические связи.
Макроэргические молекулы (макроэрги) — биологические молекулы, высокоэнергетические природные соединения, которые способны накапливать и передавать энергию в ходе реакции.
Нуклеозидтрифосфаты (Nucleoside triphosphate, NTP) — это нуклеозиды с тремя фосфатами. Природные нуклеозидтрифосфаты представлены аденозинтрифосфатом (ATP), гуанозинтрифосфатом (GTP), цитидинтрифосфатом (CTP), тимидинтрифосфатом (TTP) и уридинтрифосфатом (UTP). Данные термины означают, что нуклеотиды содержат сахар рибозу.
Нуклеотиды, содержащие сахар дезоксирибозу, имеют приставку дезокси- в имени и d- в сокращении: дезоксиаденозинтрифосфатом (dATP), дезоксигуанозинтрифосфатом (dGTP), дезоксицитидинтрифосфатом (dCTP), дезокситимидинтрифосфатом (dTTP) и дезоксиуридинтрифосфатом (dUTP).
Важные представители фосфогенов - креатинфосфат ( у большинства позвоночных) и аргининфосфат ( у многих беспозвоночных) - являются производными гуанидина. В их молекулах атомы фосфора непосредственно связаны с азотом. Большое значение стандартной свободной энергии их гидролиза обусловлено трудностями стабилизации гуанидиновой и фосфатной групп в молекулах. В результате гидролиза отщепляется фосфатная группа, а продукты реакции стабилизируются. Фосфогены выполняют роль аккумуляторов энергии и возникают при фосфорилировании креатина и аргинина с помощью АТФ. В случае необходимости они могут освобождать энергию и ресинтезировать АТФ из АДФ. Креатинфосфат — продукт обратимого метаболического N-фосфорилирования креатина, являющийся, подобно АТФ, высокоэнергетическим соединением. Однако, в отличие от АТФ, гидролизуемой по пирофосфатной связи O-P, креатин гидролизуется по фосфамидной связи N-P, что обуславливает значительно больший энергетический эффект реакции. Так, при гидролизе изменение свободной энергии для креатина ~ −43 кДж/моль, в то время как при гидролизе АТФ до АДФ ~ −30 кДж/моль. Креатинфосфат содержится преимущественно в возбудимых тканях (мышечная и нервная ткани) и его биологической функцией является поддержание постоянной концентрации АТФ за счёт обратимой реакции перефосфорилирования:
креатинфосфат + АДФ ⇔ креатин + АТФ
Структурная формула АТФ (красным обозначены макроэрг. связи)

Какие химические соединения называются макроэргическими? Напишите формулы нуклеотидов, являющихся макроэргическими соединениями. Какова их биологическая роль.
Макроэргические молекулы (макроэрги) — биологические молекулы, высокоэнергетические природные соединения, которые способны накапливать и передавать энергию в ходе реакции.
Аденинтрифосфорная к-та.
Источник энергии :
1) для реакций ассимиляции (синтеза веществ)
2) для активного транспорта веществ
3) для движения
4) для свечения (ночесветки и пр.)
5) для работы элетрических органов (например, у электрических угрей и скатов).
Кроме того является источником фосфатных группировок для синтеза различных содержащих эту группировку веществ.
АТФ не только источник энергии, а т.ж.:
1) Он учавствует в синтезе нуклеиновых кислот,
2) Учавствует в передаче гормонального сигнала в клетку,
3) Является ингибитором некоторых ферментов
4) Медиатором в некоторых рецепторах.

Кроме АТФ существуют и другие макроэргические соединения на основе нуклеотидов: ГТФ или гуанозинтрифосфат (содержит гуанин; участвует в биосинтезе белков, глюкозы),

УДФ (содержит урацил; участвует в синтезе полисахаридов).
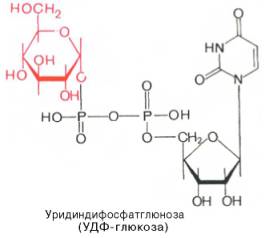
Цитидинтрифосфат (Она используется как источник энергии и как кофермент в метаболических реакциях, таких как синтез глицерофосфолипидов и гликозилирование белков. Цитидинтрифосфат участвует в синтезе практически всех фосфолипидов и является источником цитидина в процессе синтеза рибонуклеиновой кислоты, так же как дезоксицитидинтрифосфат является источником дезоксицитидина в синтезе ДНК. Цитидинтрифосфат участвует в процессе образования АТФ в качестве донора фосфатных остатков для АДФ.)
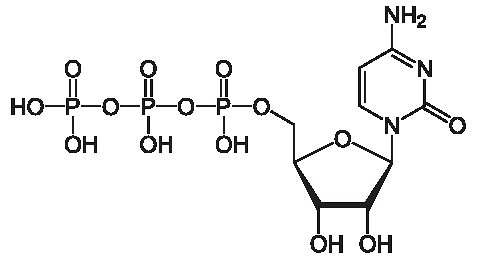
Нуклеотиды способны образовывать циклические формы, например, цАМФ, цЦМФ, цГМФ. Циклические нуклеотиды выполняют роль регуляторов различных физиологических процессов.
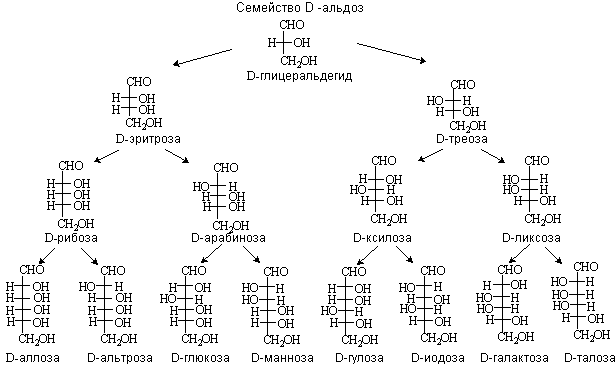
Классификация и номенклатура углеводов. Особенности строения моносахаридов.
Углеводы делятся на:
А) Моносахариды :
- Альдозы;
- Кетозы.
Б) Олигосахариды (дисахариды, трисахариды и т.д.)
В) Полисахариды:
- Гомополисахариды;
- Гетерополисахариды.
Моносахариды можно рассматривать как производные многоатомных спиртов, содержащие карбонильную (альдегидную или кетонную) группу. Если карбонильная группа находится в конце цепи, то моносахарид представляет собой альдегид и называется альдозой; при любом другом положении этой группы моносахарид является кетоном и называется кетозой. Простейшие представители моносахаридов – триозы: глицеральдегид и диоксиацетон. При окислении первичной спиртовой группы трехатомного спирта – глицерола – образуется глицеральдегид (альдоза), а окисление вторичной спиртовой группы приводит к образованию диоксиацетона (кетоза).
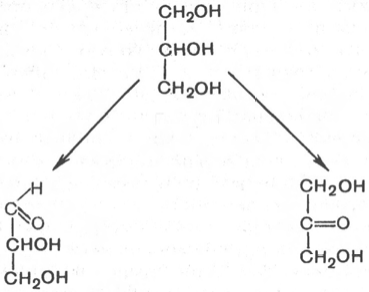
Стереоизомерия моносахаридов. Все моносахариды содержат асимметричные атомы углерода: альдотриозы – один центр асимметрии, альдотетрозы – 2, альдопентозы – 3, альдогексозы – 4 и т.д. Кетозы содержат на один асимметричный атом меньше, чем альдозы с тем же числом углеродных атомов. Следовательно, кетотриоза диоксиацетон не содержит асимметричных атомов углерода. Все остальные моносахариды могут существовать в виде различных стереоизомеров. Общее число стереоизомеров для любого моносахарида выражается формулой N = 2n, где N – число стереоизомеров, а n – число асимметричных атомов углерода. Как отмечалось, глицеральдегид содержит только один асимметричный атом углерода и поэтому может существовать в виде двух различных стереоизомеров. Изомер глицеральдегида, у которого при проекции модели на плоскость ОН-группа у асимметричного атома углерода расположена с правой стороны, принято считать D-глицеральдегидом, а зеркальное отражение – L-глицеральдегидом:
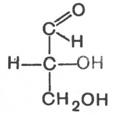
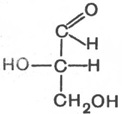
D-глицеральдегид L-глицеральдегид
Альдогексозы содержат четыре асимметричных атома углерода и могут существовать в виде 16 стереоизомеров (24), представителем которых является, например, глюкоза. Для альдопентоз и альдотетроз число стереоизомеров равно соответственно 23 = 8 и 22 = 4. Все изомеры моносахаридов подразделяются на D- и L-формы (D- и L-конфигурация) по сходству расположения групп атомов у последнего центра асимметрии с расположением групп у D- и L-глицеральдегида. Природные гексозы: глюкоза, фруктоза, манноза и галактоза – принадлежат, как правило, по стереохимической конфигурации к соединениям D-ряда. Известно, что природные моносахариды обладают оптической активностью.
Циклические
(полуацетальные) формы моносахаридов.
Любой
моносахарид с конкретными физическими
свойствами (температура плавления,
растворимость и т.д.) характеризуется
специфической величиной удельного
вращения
![]() .
Установлено, что величина удельного
вращения при растворении любого
моносахарида постепенно меняется и
лишь при длительном стоянии раствора
достигает вполне определенного значения.
Например, для свежеприготовлен-ного
раствора глюкозы
.
Установлено, что величина удельного
вращения при растворении любого
моносахарида постепенно меняется и
лишь при длительном стоянии раствора
достигает вполне определенного значения.
Например, для свежеприготовлен-ного
раствора глюкозы![]() = +112,2°, после длительного стояния раствора
эта величина достигает равновесного
значения
= +112,2°, после длительного стояния раствора
эта величина достигает равновесного
значения![]() = +52,5°. Изменение величины удельного
вращения при стоянии (во времени)
растворов моносахаридов называется
мутаротацией. Очевидно, мутаротация
должна вызываться изменением асимметрии
молекулы, а следовательно, трансформацией
ее структуры в растворе. Явление
мутаротации имеет объяснение. Известно,
что альдегиды и кетоны легко и обратимо
реагируют с эквимолярным количеством
спирта с образованием полуацеталей:
= +52,5°. Изменение величины удельного
вращения при стоянии (во времени)
растворов моносахаридов называется
мутаротацией. Очевидно, мутаротация
должна вызываться изменением асимметрии
молекулы, а следовательно, трансформацией
ее структуры в растворе. Явление
мутаротации имеет объяснение. Известно,
что альдегиды и кетоны легко и обратимо
реагируют с эквимолярным количеством
спирта с образованием полуацеталей:
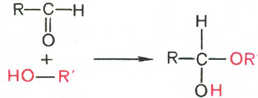
Полуацеталь
Реакция образования полуацеталя возможна и в пределах одной молекулы, если это не связано с пространственными ограничениями. По теории А. Байера, внутримолекулярное взаимодействие спиртовой и карбонильной групп наиболее благоприятно, если оно приводит к образованию пяти- или шестичленных циклов. При образовании полуацеталей возникает новый асимметрический центр (для D-глюкозы это С-1). Шестичленные кольца сахаров называют пиранозами, а пятичленные – фуранозами. α-Форма – это форма, у которой расположение полуацетального гидроксила такое же, как у асимметричного углеродного атома, определяющего принадлежность к D- или L-ряду. Иными словами, в формулах с α-модификацией моносахаридов D-ряда полуацетальный гидроксил пишут справа, а в формулах представителей L-ряда – слева. При написании β-формы поступают наоборот. Таким образом, явление мутаротации связано с тем, что каждый твердый препарат углеводов представляет собой какую-либо одну циклическую (полуацетальную) форму, но при растворении и стоянии растворов эта форма через альдегидную превращается в другие таутомерные циклические формы до достижения состояния равновесия. При этом значение удельного вращения, характерное для исходной циклической формы, посте-пенно меняется. Наконец, устанавливается постоянное удельное вращение, которое характерно для равновесной смеси таутомеров.
Дайте определения следующим понятиям: оптические антиподы, эпимеры, диастереоизомеры, рацемическая смесь.
Напишите структурные формулы следующих моносахаридов:
эпимер D-глюкозы по С2;
аномер а,Б-глюкопиранозы.
Назовите эти моносахариды.
Антиподы оптические, пространственные изомеры с одинаковыми химическими и физическими свойствами, кроме направления (знака) вращения плоскости поляризации света. По структуре молекулы А. о. относятся друг к другу, как предмет к своему зеркальному изображению (см. Изомерия). Антипод, вращающий плоскость поляризации света вправо, называется право-вращающим [(+)-антиподом], а вращающий влево — левовращающим [(—)-антиподом]. Примером А. о. может служить глицериновый альдегид

Эпимеры - стереоизомеры, содержащие несколько хиральных центров, но различающиеся по конфигурации только одного из центров.
Диастереоизомеры - пространственные изомеры с несколькими асимметрическими центрами, у которых конфигурация части асимметрических атомов совпадает, а части - противоположна. В отличие от антиподов оптических, у которых конфигурация всех асимметрических центров соответственно противоположна и которые отличаются друг от друга только знаком оптического вращения при полном совпадении всех др. свойств, Д. отличаются не только величиной оптического вращения, но и другими физическими свойствами, например температурами плавления, растворимостью. Они отличаются также некоторыми химическими свойствами (скоростями реакций).
Рацемическая смесь - смесь в равных пропорциях двух энантиомеров в-в, проявляющих оптическую активность. Один из них - правовращающий, т.е. поворачивающий плоскость поляризации света, проходящего через него, в правую сторону; др. - левовращающий, отличается только направлением поворота. В рез-те оба эффекта взаимно гасят друг друга, и Р.с. не обнаруживает оптич. активности. Назв. происходит от рацемической винной к-ты, представляющей собой смесь равных кол-в D-(правовращающей) и L-(левовращающей) винных к-т.
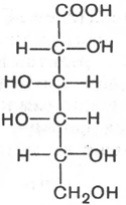
эпимер D-глюкозы по С2 (D-манноза):
аномер а,Б-глюкопиранозы (на рисунке слева вверху)

Что такое мутаротация? Как можно объяснить преобладание [3- D-глюкопиранозы в растворе после стояния? Какие еще формы глюкозы находятся в растворе? Напишите формулы.
Изменение величины удельного вращения при стоянии (во времени) растворов моносахаридов называется мутаротацией.
Явление мутаротации имеет объяснение. Известно, что альдегиды и кетоны легко и обратимо реагируют с эквимолярным количеством спирта с образованием полуацеталей:
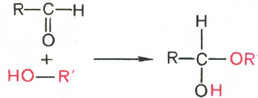
Полуацеталь
Реакция образования полуацеталя возможна и в пределах одной молекулы, если это не связано с пространственными ограничениями. По теории А. Байера, внутримолекулярное взаимодействие спиртовой и карбонильной групп наиболее благоприятно, если оно приводит к образованию пяти- или шестичленных циклов. При образовании полуацеталей возникает новый асимметрический центр (для D-глюкозы это С-1). Шестичленные кольца сахаров называют пиранозами, а пятичленные – фуранозами. α-Форма – это форма, у которой расположение полуацетального гидроксила такое же, как у асимметричного углеродного атома, определяющего принадлежность к D- или L-ряду. Иными словами, в формулах с α-модификацией моносахаридов D-ряда полуацетальный гидроксил пишут справа, а в формулах представителей L-ряда – слева. При написании β-формы поступают наоборот. Таким образом, явление мутаротации связано с тем, что каждый твердый препарат углеводов представляет собой какую-либо одну циклическую (полуацетальную) форму, но при растворении и стоянии растворов эта форма через альдегидную превращается в другие таутомерные циклические формы до достижения состояния равновесия. При этом значение удельного вращения, характерное для исходной циклической формы, посте-пенно меняется. Наконец, устанавливается постоянное удельное вращение, которое характерно для равновесной смеси таутомеров.
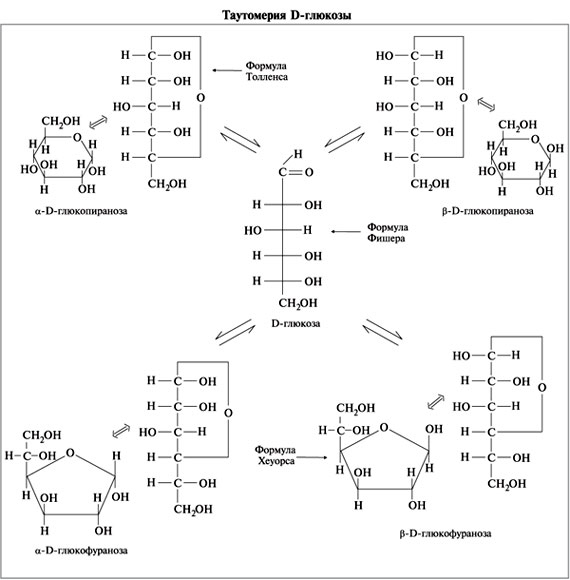
Например, известно, что в водных растворах глюкоза находится главным образом в виде α- и β-глюкопираноз, в меньшей степени – в виде α- и β-глюкофураноз и совсем небольшое количество глюкозы – в виде альдегидной формы. Следует подчеркнуть, что из различных таутомерных форм глюкозы в свободном состоянии известны лишь α- и β-пиранозы. Существование малых количеств фураноз и альдегидной формы в растворах доказано, но в свободном состоянии они не могут быть выделены вследствие своей неустойчивости.
В растворе глюкозы находятся следующие формы глюкозы:
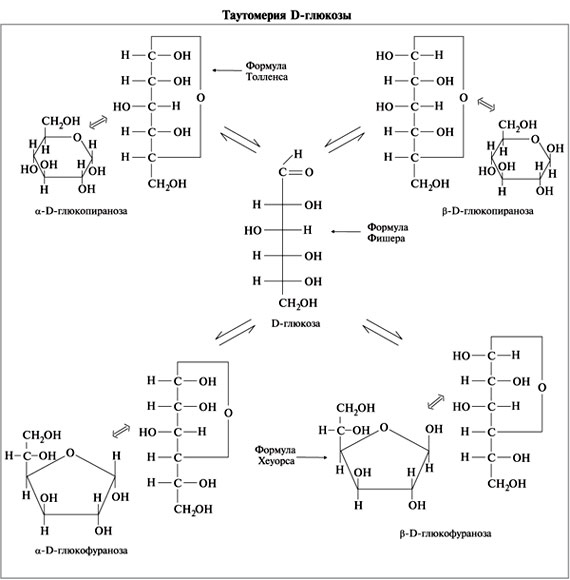
Основные таутомерные формы глюкозы в растворе. Напишите их формулы. Что такое мутаротация?
Изменение величины удельного вращения при стоянии (во времени) растворов моносахаридов называется мутаротацией.
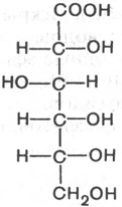
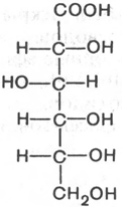
Какая функциональная группа глюкозы проявляет восстанавливающие свойства? Напишите схему реакции окисления глюкозы гидроксидом меди (II).
 +2Cu(OH)2->
+2Cu(OH)2->
 +Cu2O+2H2O
+Cu2O+2H2O
Окисляется альдегидная группа (т.е. проявляет восст. свойства), выпадает красный осадок оксида меди (I), образуется глюконовая кислота. Реакция хорошо идет при слабом нагревании, при низкой температуре образуется синий комплекс без окисления альдегидной группы, поскольку глюкоза еще и многоатомный спирт.
Химические свойства моносахаридов (реакции с участием карбонильной и спиртовой групп, гликозидного гидроксила).
Реакции полуацетального гидроксила. Уже отмечалось, что моносахариды как в кристаллическом состоянии, так и в растворе в основном существуют в полуацетальных формах. Полуацетальный гидроксил отличается большей реакционной способностью и может замещаться другими группировками в реакциях со спиртами, карбоновыми кислотами, фенолами и т.д.
Продукт реакции называют гликозидом. Соответственно α- и β-изомерам моносахаридов существуют α- и β-глюкозиды. Например, при реакции метилового спирта с глюкозой (допустим, в β-пиранозной форме) в присутствии неорганических кислот образуется продукт алкилирования метил-β-D-глюкопиранозид:
СH3OH H2O
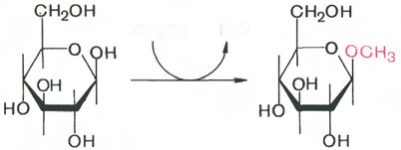
b-D-глюкопираноза Метил-b-D-глюкопиранозид
При действии на β-D-глюкопиранозу уксусной кислотой образуется продукт ацилирования ацетил-β-D-глюкопиранозид (по той же схеме).
Ацилированию и метилированию способны подвергаться и остальные группы моносахаридов, но при намного более жестких условиях. Если в реакцию вступают спирты, фенолы или карбоновые кислоты, продукты реакции называют О-гликозидами. Следовательно, метил-β-D-глюкопиранозид и ацетил-β-D-глюкопиранозид являются О-гликозидами (связь осуществляется через кислород). Природные О-гликозиды, большинство из которых образуется в результате жизнедеятельности растений, существуют преимущественно в β-форме.
Реакции с участием карбонильной группы. Линейная форма в кристаллических препаратах моносахаридов и их растворах присутствует в незначительных количествах, но ее участие в таутомерном равновесии обеспечивает моносахаридам все свойства, присущие альдегидам (в альдозах) или кетонам (в кетозах). Способность альдоз и кетоз присоединять спирты представлена ранее. Рассмотрим некоторые другие их свойства.
Окисление моносахаридов. Обработка альдоз слабыми окислителями приводит к превращению альдегидной группы в положении атома С-1 в карбоксильную группу с образованием так называемых альдоновых кислот. Альдоновой кислотой может быть D-глюконовая кислота, которая образуется при окислении альдегидной группы D-глюкозы. Фосфорилированная форма D-глюконовой кислоты играет важную роль в качестве промежуточного продукта углеводного обмена. Другой пример – D-галактоновая кислота – продукт окисления альдегидной группы D-галактозы.
D-глюконовая к-та D-галактоновая к-та
В альдуроновых, или уроновых, кислотах окислена (с образованием карбоксильной группы) первичная спиртовая группа, а альдегидная группа остается неокисленной. Уроновая кислота, образующаяся из D-глюкозы, носит название D-глюкуроновой кислоты, а образующаяся из D-галактозы – D-галактоуроновой кислоты. Уроновые кислоты весьма важны в биологическом отношении, многие из них являются компонентами полисахаридов.
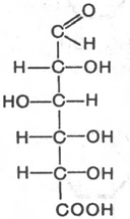
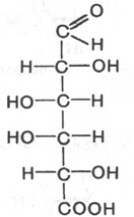
D-глюкуроновая к-та D-галактоуроновая к-та
Восстановление моносахаридов. Моносахариды легко гидрируются по связи С—О и при этом превращаются в многоатомные спирты (сахароспирты). D-глюкоза, например, образует спирт сорбит, а D-манноза – маннит. Восстановление D-фруктозы приводит к эквимолекулярной смеси эпимеров – D-маннита и D-copбита, так как в результате гидрирования второй атом углерода становится асимметричным. Такого рода восстановление может осуществляться и ферментативным путем.
Охарактеризуйте производные моносахаридов: аминосахара, кислоты, гликозиды. Приведите примеры и напишите формулы.
Продуктами реакции замещения полуацетального гидроксила другими группировками в реакциях со спиртами, карбоновыми кислотами,фенолами называются гликозиды.
Соответственно α- и β-изомерам моносахаридов существуют α- и β-глюкозиды. Например, при реакции метилового спирта с глюкозой (допустим, в β-пиранозной форме) в присутствии неорганических кислот образуется продукт алкилирования метил-β-D-глюкопиранозид:
СH3OH H2O

b-D-глюкопираноза Метил-b-D-глюкопиранозид
При действии на β-D-глюкопиранозу уксусной кислотой образуется продукт ацилирования ацетил-β-D-глюкопиранозид (по той же схеме).
Важным классом гликозидов являются N-гликозиды, в которых гликозидная связь осуществляется через азот, а не через кислород *. N-гликозиды рассматривают как производные моносахаридов, у которых гликозидная часть молекулы связана через атом азота с радикалом органического соединения R, не являющегося углеводом. Как и О-гликозиды, N-гликозиды могут быть построены как пиранозиды или как фуранозиды и иметь α- и β-форму:
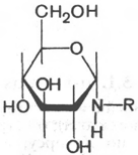
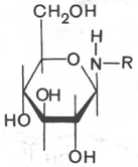
N-гликозид (a-форма) N-гликозид b-форма
Обработка альдоз слабыми окислителями приводит к превращению альдегидной группы в положении атома С-1 в карбоксильную группу с образованием так называемых альдоновых кислот.

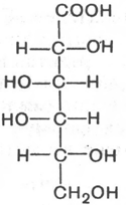
D-глюконовая к-та D-галактоновая к-та
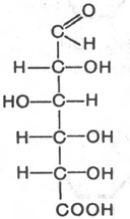

D-глюкуроновая к-та D-галактоуроновая к-та
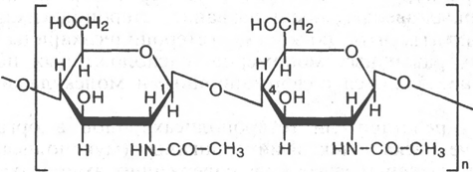
Аминосахара. Это производные моносахаридов, гидроксильная группа которых —ОН замещена аминогруппой —NH2. В зависимости от положения аминогруппы (при атомах углерода) в молекуле аминосахара различают 2-амино-, 3-амино- и 4-аминосахара и т.д. По числу аминогрупп выделяют моноаминосахара и диаминосахара. Аминосахара обладают всеми свойствами аминов, обычных моносахаров, а также специфическими свойствами, обусловленными пространственной близостью гидроксильных и аминных групп. В организме человека и животных наиболее важными аминосахарами являются D-глюкозамин и D-галактозамин:
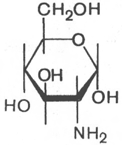
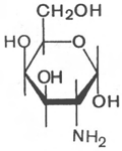
D-глюкозамин D-галактозамин
Аминосахара входят в состав мукополисахаридов животного, растительного и бактериального происхождения, являются углеводными компонентами различных гликопротеинов и гликолипидов. В составе этих высокомолекулярных соединений аминогруппа аминосахара чаще всего ацилирована, а иногда сульфирована.
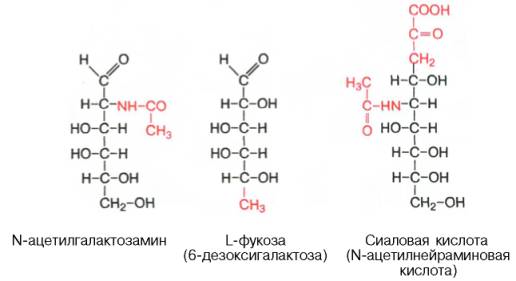
Структура, свойства и биологическая роль аминосахаров и их ацильных производых. Напишите структурную формулу N-ацетилнейраминовой кислоты.
Это производные моносахаридов, гидроксильная группа которых —ОН замещена аминогруппой —NH2. В зависимости от положения аминогруппы (при атомах углерода) в молекуле аминосахара различают 2-амино-, 3-амино- и 4-аминосахара и т.д. По числу аминогрупп выделяют моноаминосахара и диаминосахара. Аминосахара обладают всеми свойствами аминов, обычных моносахаров, а также специфическими свойствами, обусловленными пространственной близостью гидроксильных и аминных групп. В организме человека и животных наиболее важными аминосахарами являются D-глюкозамин и D-галактозамин:
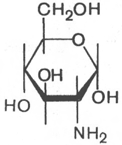
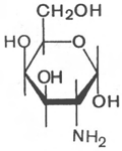
D-глюкозамин D-галактозамин
Аминосахара входят в состав мукополисахаридов животного, растительного и бактериального происхождения, являются углеводными компонентами различных гликопротеинов и гликолипидов. В составе этих высокомолекулярных соединений аминогруппа аминосахара чаще всего ацилирована, а иногда сульфирована.
Формула N-ацетилнейраминовой кислоты (спава)
В состав гликозаминогликанов входят аминосахара: глюкозамин и галактозамин в виде N-ацетилированных производных. Напишите 2-1М-ацетил-а-В-глюкозамин и 2-Ы-ацетил-р-В-галактозамин в пиранозной форме.
???
Что такое гликозиды? Как определить принадлежность гликозидов к L- и D-ряду? Напишите формулы следующих веществ:
а) метил-Р-Б-фруктопиранозида; б) метил- a-D-глюкопиранозида.
Продуктами реакции замещения полуацетального гидроксила другими группировками в реакциях со спиртами, карбоновыми кислотами,фенолами называются гликозиды.
Соответственно α- и β-изомерам моносахаридов существуют α- и β-глюкозиды. Например, при реакции метилового спирта с глюкозой (допустим, в β-пиранозной форме) в присутствии неорганических кислот образуется продукт алкилирования метил-β-D-глюкопиранозид. При действии на β-D-глюкопиранозу уксусной кислотой образуется продукт ацилирования ацетил-β-D-глюкопиранозид.
А)
метил-b-D-фруктопиранозид
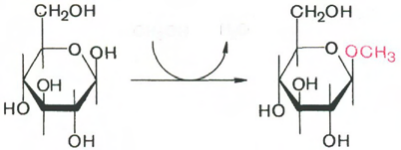
Б)
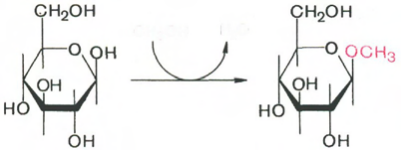
Метил-b-D-гликопиранозид (у a-D-формы OCH3 вниз)
Редуцирующие сахара. Химические свойства лактозы (напишите формулу). Способна ли она к мутаротации? Может ли она восстанавливать Си2+ до Си1+? Ответ подтвердить уравнениями химических реакций.
Лактоза (от лат. lactis — молоко) C12H22O11 — углевод группы дисахаридов, содержится в молоке и молочных продуктах. Молекула лактозы состоит из остатков молекул глюкозы и галактозы. Лактоза относится классу активных (восстанавливающих, редуцирующих углеводов).
Химические свойства:
- При кипячении с разбавленной кислотой происходит гидролиз лактозы.
- При взаимодействии с раствором щёлочи лактоза окисляется до сахариновых кислот.


Полуацетальный гидроксил глюкозы в молекуле лактозы, в отличие от молекулы сахарозы, остается свободным, поэтому лактоза является мутаротирующим и восстанавливающим сахаром.
Способна восстанавливать Си2+ до Си1+ :
C12H22O11 + 2Сu(ОН)2 —— > С12Н22О12 + Cu2Ov + 2Н2О.
Сахароза и лактоза, их строение и химические свойства. Какой из дисахаридов будет восстанавливать Си2+ в щелочной среде. Напишите уравнение реакции.
Сахароза.

Свойства
Сахароза - тростниковый или свекловичный сахар представляет собой белое кристаллическое вещество, растворимое в 0,5 частей воды и в 60 частях спирта, не растворимое в эфире и хлороформе.
Плавится при температуре 184-185°С, при дальнейшем нагревании темнеет и превращается в бурую, горькую на вкус массу (карамель).
Поскольку гликозидную связь в молекуле сахара образуют полуацетальные гидроксилы глюкозы и фруктозы, она является не восстанавливающим и не мутаротирующим сахаром.
Лактоза. (будет восстанавливать медь)
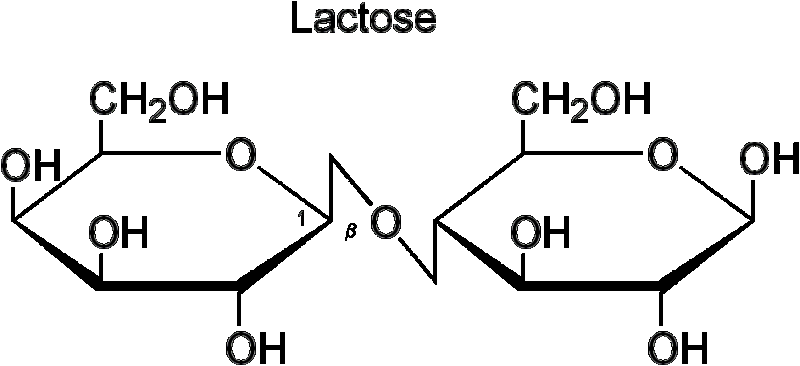
Свойства.
Уже название этого сахара говорит о том, что он встречается в молоке млекопитающих; женское молоко содержит 5—8% лактозы, коровье - 4-6%.В промышленном масштабе лактозу получают в качестве побочного продукта при производстве сыра.
Полученное вещество представляет собой белые кристаллы или белый кристаллический порошок, без запаха, слабого сладкого вкуса.
Полуацетальный гидроксил глюкозы в молекуле лактозы, в отличие от молекулы сахарозы, остается свободным, поэтому лактоза является мутаротирующим и восстанавливающим сахаром.
C12H22O11 + 2Сu(ОН)2 —— > С12Н22О12 + Cu2Ov + 2Н2О.
Какой вывод можно сделать о химических свойствах сахарозы на основании ее строения? Способна ли она к мутаротации? Может ли она восстанавливать аммиачный раствор серебра, реактив Фелинга?
Ответ подтвердить уравнениями химических реакций.
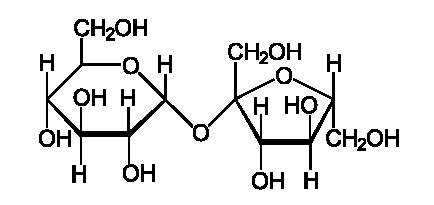
Это дисахарид из группы олигосахаридов, состоящий из двух моносахаридов — α-глюкозы и β-фруктозы. Не проявляет восстанавливающих свойств — не реагирует с реактивом Толленса и реактивом Фелинга. Не образует открытую форму, поэтому не проявляет свойств альдегидов и кетонов. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов. Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра (I) она не дает «серебряного зеркала» (в отличие от формалина: H-CHO + 2 Ag2O ---> CO2 + H2O + 4 Ag (осадок - "зеркало")) , при нагревании с гидроксидом меди (II) не образует красного оксида меди (I). Не способна к мутаротации,. поскольку гликозидную связь в молекуле сахара образуют полуацетальные гидроксилы глюкозы и фруктозы.
Строение сахарозы (напишите структурную формулу), её свойства. Инверсия сахарозы. Как называется и чем характеризуется подобный тип олигосахаридов?
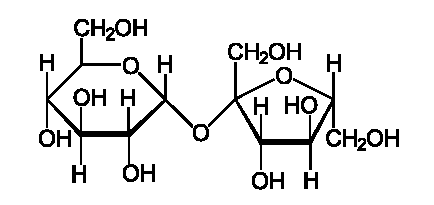
Свойства
Сахароза - тростниковый или свекловичный сахар представляет собой белое кристаллическое вещество, растворимое в 0,5 частей воды и в 60 частях спирта, не растворимое в эфире и хлороформе.
Плавится при температуре 184-185°С, при дальнейшем нагревании темнеет и превращается в бурую, горькую на вкус массу (карамель).
Поскольку гликозидную связь в молекуле сахара образуют полуацетальные гидроксилы глюкозы и фруктозы, она является не восстанавливающим и не мутаротирующим сахаром.
Благодаря наличию в молекуле свободного полуацетального гидроксила (в остатке глюкозы) лактоза относится к числу редуцирующих дисахаридов.
Гидролиз сахарозы приводит к образованию смеси, которую называют инвертированным сахаром. В этой смеси преобладает сильно левовращающая фруктоза, которая инвертирует (меняет на обратный) знак вращения правовращающего раствора исходной сахарозы.
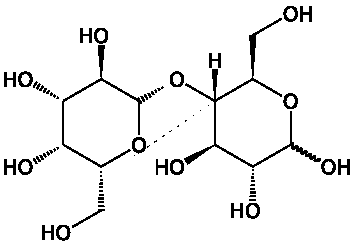
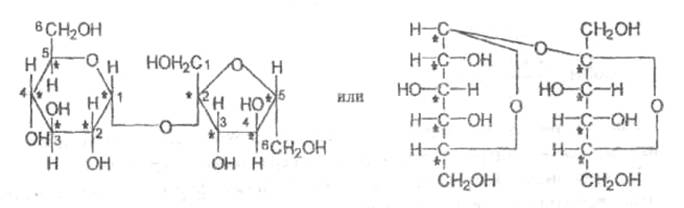
Относится к дисахаридам- сложные сахара, каждая молекула которых при гидролизе распадается на две молекулы моносахаридов. Дисахариды наряду с полисахаридами являются одними из основных источников углеводов в пище человека и животных. По строению дисахариды – это гликозиды, в которых 2 молекулы моносахаридов соединены гликозидной связью. Молекула сахарозы состоит из одного остатка D-глюкозы и одного остатка D-фруктозы. Следовательно, это α-глюкопиранозил-(1–>2)-β-фруктофуранозид.
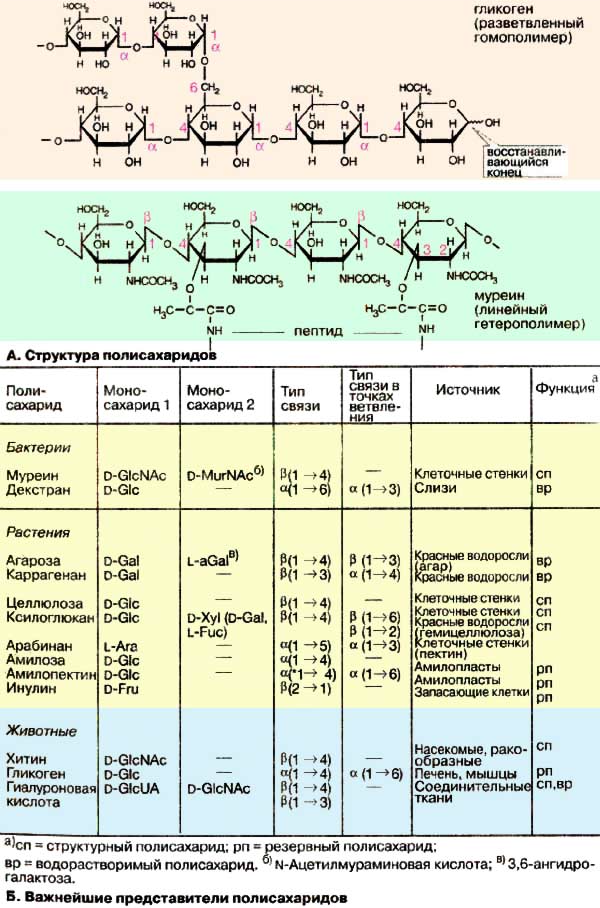
Гомогликаны, их строение и функции. Напишите структурную формулу фрагмента гликогена с точкой ветвления и целлюлозы.
Полисахариды, построенные из моносахаридных звеньев одного типа, называются гомогликаны.
Гомогликаны делятся на :
- гексозаны (C6H10O5. Полисахариды, молекулы которых построены из большого числа гексозных остатков, соединённых α- или β-гликозидными связями. К Г. относятся крахмал, гликоген, целлюлоза, декстраны, галактаны, маннаны, фруктозаны, лишайниковый крахмал — лихенин, глюкоманнаны, арабогалактаны и др.);
-пентазаны (так называются сахароколлоиды (полисахариды), дающие при гидролизе пентозы. К последним они стоят в таком же точно отношении, как гексозаны (крахмал, клетчатка, инулин и др.) к гексозам (декстрозе, фруктозе и др.), и представляют, следовательно, их ангидриды (ср. Клетчатка), состав которых выражается формулами (C5H8O4)n или (C 10H18O9)n, а происхождение из пентоз уравнением nC 5H10O5 - nH2O = (C5H8O4)n и т. п. Гидролиз П. совершается весьма легко при кипячении с разбавленными кислотами (серной или соляной), вследствие чего их надо отнести, согласно обозначению Э. Шульце, к числу так называемых полуклетчаток, или гемицеллюлоз. В настоящее время известно лишь два П. - ксилан и арабан, которые соответствуют пентозам - ксилозе и арабинозе и чрезвычайно сильно распространены в растениях, где они являются обыкновенно существенной частью в составе различных их тканей.).
Целлюлоза
Охарактеризуйте физико-химические свойства и укажите структурные особенности крахмала, гликогена и целлюлозы. Укажите черты сходства и различия в строении и свойствах указанных гомогликанов.
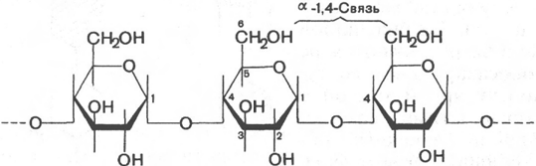
Крахмал, как отмечалось, является основным резервным материалом растительных организмов. В небольших количествах он содержится в листьях, но главным образом накапливается в семенах (зерна злаков, например пшеницы, риса, кукурузы, содержат до 70% крахмала), а также в луковицах, клубнях и сердцевине стебля растений, где содержание его доходит до 30%. Крахмал представляет собой смесь 2 гомополисахаридов: линейного – амилозы и разветвленного – амилопектина, общая формула которых (С6Н10О5)n. Как правило, содержание амилозы в крахмале составляет 10–30%, амилопектина – 70–90%. Полисахариды крахмала построены из остатков D-глюкозы, соединенных в амилозе и линейных цепях амилопектина α-1–>4-связями, а в точках ветвления амилопектина – межцепочечными α-1–>6-связями.
Итак, единственным моносахаридом, входящим в состав крахмала, является D-глюкоза. В молекуле амилозы линейно связано в среднем около 1000 остатков глюкозы; отдельные участки молекулы амилопектина состоят из 20–30 таких единиц. В настоящее время общепринятой является ветвистая структура отдельных цепочек с α-1–>4-связями в молекуле амилопектина.
Известно, что в воде амилоза не дает истинного раствора. Цепочка амилозы в воде образует гидратированные мицеллы. В растворе при добавлении йода амилоза окрашивается в синий цвет. Амилопектин также дает мицеллярный раствор, но форма мицелл несколько иная. Полисахарид амилопектин окрашивается йодом в красно-фиолетовый цвет. Крахмал имеет молекулярную массу 105–107 Да. При частичном кислотном гидролизе крахмала образуются полисахариды меньшей степени полимеризации – декстрины *, при полном гидролизе – глюкоза. Для человека крахмал является важным пищевым углеводом; содержание его в муке составляет 75–80%, в картофеле – 25%.
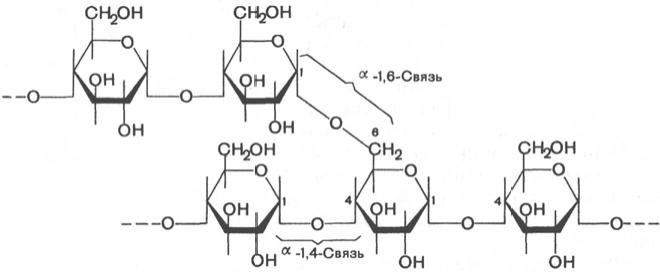
Гликоген – главный резервный полисахарид высших животных и человека, построенный из остатков D-глюкозы. Эмпирическая формула гликогена, как и крахмала, (С6Н10О5)n. Гликоген содержится практически во всех органах и тканях животных и человека; наибольшее количество
обнаружено в печени и мышцах. Молекулярная масса гликогена 105–108 Да и более. Его молекула построена из ветвящихся полиглюкозидных цепей, в которых остатки глюкозы соединены α-1–>4-гликозидными связями. В точках ветвления имеются α-1–>6-гликозидные связи. По строению гликоген близок к амилопектину. В молекуле гликогена различают внутренние ветви – участки от периферической точки ветвления до нередуцирующего конца цепи. Гликоген характеризуется более разветвленной структурой, чем амилопектин; линейные отрезки в молекуле гликогена включают 11–18 остатков α-D-глюкопиранозы. При гидролизе гликоген, подобно крахмалу, расщепляется с образованием сначала декстринов, затем мальтозы и, наконец, глюкозы. Инулин – полисахарид, содержащийся в клубнях и корнях георгинов, артишоков и одуванчиков. При его гидролизе образуется фруктоза, следовательно, он представляет собой фруктазан. Метилирование инулина свидетельствует, что остатки D-фруктозы связаны между собой 2–>1-связями и находятся в фуранозной форме. Степень полимеризации инулина равна примерно 35 моносахарным остаткам. Этот полисахарид в отличие от картофельного крахмала легко растворяется в теплой воде. Инулин используют в физиологических исследованиях для определения скорости клубочковой фильтрации в почках.
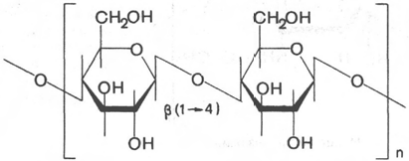
Целлюлоза (клетчатка) – наиболее широко распространенный структурный полисахарид растительного мира. Он состоит из α-глюкозных остатков в их β-пиранозной форме, т.е. в молекуле целлюлозы β-глюкопиранозные мономерные единицы линейно соединены между собойβ-(1–>4)-связями. При частичном гидролизе целлюлозы образуется дисахарид целлобиоза, а при полном гидролизе – D-глюкоза. Молекулярная масса целлюлозы 1000–2000 кДа. Клетчатка не переваривается ферментами пищеварительного тракта, так как набор этих ферментов у человека не содержит гидролаз, расщепляющих β-связи. В связи с этим целлюлозу можно рассматривать как значительный неиспользуемый пищевой резерв. Вместе с тем известно, что присутствие оптимальных количеств клетчатки в пище способствует формированию кала. При полном исключении клетчатки из пищи нарушается формирование каловых масс. В кишечнике жвачных и других травоядных животных имеются микроорганизмы, способные к ферментативному расщеплению β-связей (β-глюкозидных связей), и для этих животных целлюлоза является важным источником пищевых калорий. Наконец, целлюлоза и ее производные имеют колоссальное практическое значение. Основная масса целлюлозы используется для изготовления хлопчатобумажных тканей и бумаги. Кроме того, на основе целлюлозы производятся искусственные волокна, пластмассы и т.д. Характерной особенностью целлюлозы, определяющей в значительной степени ее механические, физико-химические и химические свойства, является линейная конформация молекул, закрепленная внутримолекулярными водородными связями.
Амилоза, амилопектин, целлюлоза, гликоген и декстраны построены из остатков D-глюкозы. Какие виды связей между D-глюкопиранозными остатками в указанных гомогликанах? Чем отличаются эти полимеры? Напишите структурную формулу дисахаридного фрагмента этих гомогликанов.
Участок молекулы амилозы
Участок молеклы амилопектина
Участок молекулы целлюлозы

Участок молекулы гликогена
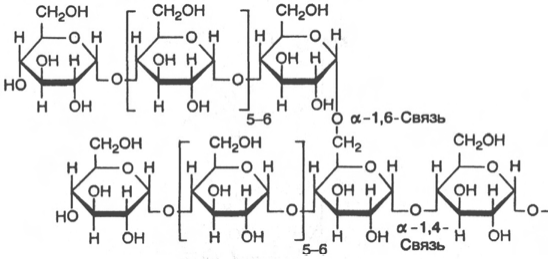
Инулин (декстран)

Хитин (декстран)
Гетерогликаны, их строение и функции. Приведите примеры. Напишите структурную формулу фрагмента какого-либо гетерогликана.
Полисахариды, в структуре которых характерно наличие двух или более типов мономерных звеньев, носят название гетерополисахаридов. Принято считать, что, поскольку гетерополисахариды чаще состоят только из двух различных мономеров, расположенных повторяющимся образом, они не являются информационными молекулами. Важнейшие представители гетерополисахаридов в органах и тканях животных и человека – гликозаминогликаны (мукополисахариды). Они состоят из цепей сложных углеводов, содержащих аминосахара и уроновые кислоты. Различают шесть основных классов гликозаминогликанов. Каждый из гликозаминогликанов содержит характерную для него повторяющуюся дисахаридную единицу; во всех случаях (кроме кератансульфатов) эта единица содержит либо глюкуроновую, либо идуроновую кислоту. Все гликозаминогликаны, за исключением гиалуроновой кислоты, содержат остатки моносахаридов с О- или N-сульфатной группой. Гликозаминогликаны значительно различаются по размерам, их молекулярные массы в пределах от 104 Да для гепарина до 107 Да для гиалуроновой кислоты. Выделенные индивидуальные гликозаминогликаны могут содержать смесь цепей различной длины (рис. 5.5). Гликозаминогликаны как основное скрепляющее вещество связаны со структурными компонентами костей и соединительной ткани. Их функция состоит также в удержании большой массы воды и в заполнении межклеточного пространства. Иными словами, гликозаминогликаны – основной компонент внеклеточного вещества – желатинообразного вещества, заполняющего межклеточное пространство тканей. Они также содержатся в больших количествах в синовиальной жидкости – это вязкий материал, окружающий суставы, который служит смазкой и амортизатором. Поскольку водные растворы гликозаминогликанов гелеобразны, их называют мукополисахаридами. Наконец, если цепи гликозаминогликана присоединены к белковой молекуле, соответствующее соединение называют протеогликаном. Протеогликаны образуют основное вещество внеклеточного матрикса. В отличие от простых гликопротеинов, которые содержат только несколько процентов углеводов (по массе), протеогликаны могут содержать до 95% (и более) углеводов.
Гепарин
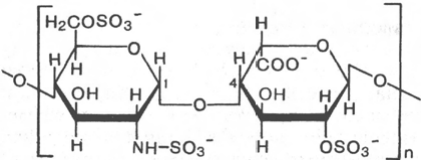
Сульфатированный Сульфатированная
Гликозаминн идуроновая к-та
Классификация и физико-химические свойства липидов.
Липиды представляют собой обширную группу соединений, существенно различающихся по своей химической структуре и функциям. Поэтому трудно дать единое определение, которое подошло бы для всех соединений, относящихся к этому классу. Можно сказать, что липиды представляют собой группу веществ, которые характеризуются следующими признаками: нерастворимостью в воде; растворимостью в неполярных растворителях, таких, как эфир, хлороформ или бензол; содержанием высших алкильных радикалов; распространенностью в живых организмах. Под это определение попадает большое количество веществ, в том числе такие, которые обычно причисляют к другим классам соединений: например, жирорастворимые витамины и их производные, каротиноиды, высшие углеводороды и спирты. Включение всех этих веществ в число липидов в известной степени оправдано, потому что в живых организмах они находятся вместе с липидами и вместе с ними экстрагируются неполярными растворителями. С другой стороны, имеются представители липидов, которые довольно хорошо растворяются в воде (например, лизолецитины). Термин липиды является более общим, чем термин липоиды, который объединяет группу жироподобных веществ, таких, как фосфолипиды, стерины, сфинголипиды и др.
Классификация:
Существует несколько классификаций липидов. Наибольшее распространение получила классификация, основанная на структурных особенностях липидов. По этой классификации различают следующие основные классы липидов.
A. Простые липиды: сложные эфиры жирных кислот с различными спиртами.
1. Глицериды (ацилглицерины, или ацилглицеролы – по международной номенклатуре) представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот.
2. Воска: сложные эфиры высших жирных кислот и одноатомных или двухатомных спиртов.
Б. Сложные липиды: сложные эфиры жирных кислот со спиртами, дополнительно содержащие и другие группы.
1. Фосфолипиды: липиды, содержащие, помимо жирных кислот и спирта, остаток фосфорной кислоты. В их состав часто входят азотистые основания и другие компоненты:
а) глицерофосфолипиды (в роли спирта выступает глицерол);
б) сфинголипиды (в роли спирта – сфингозин).
2. Гликолипиды (гликосфинголипиды).
3. Стероиды.
4. Другие сложные липиды: сульфолипиды, аминолипиды. К этому классу можно отнести и липопротеины.
B. Предшественники и производные липидов: жирные кислоты, глицерол, стеролы и прочие спирты (помимо глицерола и стеролов), альдегиды жирных кислот, углеводороды, жирорастворимые витамины и гормоны.
Строение, физико-химические свойства жирных кислот. Приведите примеры. Напишите структурную формулу линоленовой кислоты.
Жирные кислоты – алифатические карбоновые кислоты – в организме могут находиться в свободном состоянии (следовые количества в клетках и тканях) либо выполнять роль строительных блоков для большинства классов липидов. В природе обнаружено свыше 200 жирных кислот, однако в тканях человека и животных в составе простых и сложных липидов найдено около 70 жирных кислот, причем более половины из них в следовых количествах. Практически значительное распространение имеют немногим более 20 жирных кислот. Все они содержат четное число углеродных атомов, главным образом от 12 до 24. Среди них преобладают кислоты, имеющие С16 и С18 (пальмитиновая, стеариновая, олеиновая и линолевая). Нумерацию углеродных атомов в жирно-кислотной цепи начинают с атома углерода карбоксильной группы. Примерно 3/4 всех жирных кислот являются непредельными (ненасыщенными), т.е. содержат двойные связи. Ненасыщенные жирные кислоты человека и животных, участвующие в построении липидов, обычно содержат двойную связь между (9-м и 10-м атомами углеводородов); дополнительные двойные связи чаще бывают на участке между 11-м атомом углерода и метильным концом цепи. Своеобразие двойных связей природных ненасыщенных жирных кислот заключается в том, что они всегда отделены двумя простыми связями, т.е. между ними всегда имеется хотя бы одна метиленовая группа (—СН=СН——СН2—СН=СН—). Подобные двойные связи обозначают как ≪изолированные≫. Систематическое название жирной кислоты чаще всего образуется путем добавления к названию углеводорода окончания -овая. Насыщенные кислоты при этом имеют окончание -ановая (например, октановая кислота –систематическое название, каприловая кислота – тривиальное название), а ненасыщенные кислоты – -еновая (например, октадеценовая кислота – систематическое название, олеиновая кислота – тривиальное название).
В специальной литературе жирные кислоты часто изображают в виде зигзагообразной вытянутой линии, отражающей жесткость валентного угла атомов углерода в 111° для насыщенной и в 123° – для двойной связи. Однако такая конформация является условной и справедлива только для случая, когда жирная кислота находится в кристаллическом состоянии. В растворах жирно-кислотная цепь может образовывать бесчисленное количество конформаций вплоть до клубка, в котором имеются и линейные участки различной длины в зависимости от числа двойных связей. Клубки могут слипаться между собой, образуя так называемые мицеллы. В последних отрицательно заряженные карбоксильные группы жирных кислот обращены к водной фазе, а неполярные углеводородные цепи спрятаны внутри мицеллярной структуры. Такие мицеллы имеют суммарный отрицательный заряд и в растворе остаются суспендированными благодаря
взаимному отталкиванию. Известно также, что при наличии двойной связи в жирнокислотной цепи вращение углеродных атомов относительно друг друга ограничено. Это обеспечивает существование ненасыщенных жирных кислот в виде геометрических изомеров, причем природные ненасыщенные жирные кислоты имеют цис-конфигурацию и крайне редко транс-конфигурации. Считают, что жирной кислоте с несколькими двойными связями цис-конфигурация придает углеводородной цепи изогнутый и укороченный вид. По этой причине молекулы этих кислот занимают больший объем, а при образовании кристаллов упаковываются не так плотно, как транс-изомеры. Вследствие этого цис-изомеры имеют более низкую температуру плавления (олеиновая кислота, например, при комнатной температуре находится в жидком состоянии, тогда как элаидиновая – в кристаллическом). Цис-конфигурация делает ненасыщенную кислоту менее стабильной и более подверженной катаболизму.
Структурная формула олеиновой кислоты
Характеристика высших жирных кислот, входящих в состав жира. Что называется кислотным числом, числом омыления, йодным числом.
Глицериды (ацилглицерины, или ацилглицеролы *) представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот. Если жирными кислотами этерифицированы все три гидроксильные группы глицерина (ацильные радикалы R1, R2 и R3 могут быть одинаковы или различны), то такое соединение называют триглицеридом (триацилглицерол), если две – диглицеридом (диацилглицерол) и, наконец, если этерифицирована одна группа – моноглицеридом (моноацилглицерол). Наиболее распространенными являются триглицериды, часто называемые нейтральными жирами или просто жирами. Нейтральные жиры находятся в организме либо в форме протоплазматического жира, являющегося структурным компонентом клеток, либо в форме запасного, резервного, жира. Роль этих двух форм жира в организме неодинакова. Протоплазматический жир имеет постоянный химический состав и содержится в тканях в определенном количестве, не изменяющемся даже при патологическом ожирении, в то время как количество резервного жира подвергается большим колебаниям. Как отмечалось, основную массу природных нейтральных жиров составляют триглицериды. Жирные кислоты в триглицеридах могут быть насыщенными и ненасыщенными. Из жирных кислот чаще встречаются пальмитиновая, стеариновая и олеиновые кислоты. Если все три кислотных радикала принадлежат одной и той же жирной кислоте, то такие триглицериды называют простыми (например, трипальмитин, тристеарин, триолеин и т.д.), если разным жирным кислотам, то смешанными. Названия смешанных триглицеридов образуются в зависимости от входящих в их состав жирных кислот, при этом цифры 1, 2 и 3 указывают на связь остатка жирной кислоты с соответствующей спиртовой группой в молекуле глицерина (например, 1-олео-2-пальмитостеарин). Необходимо отметить, что положение крайних атомов в молекуле глицерина на первый взгляд равнозначно, тем не менее их обозначают сверху вниз – 1 и 3. Это объясняется прежде всего тем, что в структуре триглицерида при пространственном ее рассмотрении крайние ≪глицериновые≫ атомы углерода становятся уже не равнозначными, если гидроксилы 1 и 3 ацилированы разными жирными кислотами. При необходимости применяют также систему стереохимической нумерации (обозначают sn –stereochemical numbering): например, 1,2-дистеарил-3-пальмитил-sn-глицерол.
По этой системе, если в проекции Фишера гидроксильная группа при 2-м углеродном атоме глицерина располагается слева, атому углерода, находящемуся над ним, присваивается номер 1, а расположенному под ним – номер 3. Действительно, углероды 1 и 3 глицерола, учитывая их пространственное расположение, неидентичны. Особенно четко это видно на примере молекулы триглицерида. Ферменты это различают и всегда специфичны только к одному из трех углеродов глицерина. Так, глицеролкиназа фосфорилирует глицерин в положении sn-3, в результате чего образуется глицерол-3-фосфат, но не глицерол-1-фосфат. Жирные кислоты, входящие в состав триглицеридов, практически определяют их физико-химические свойства. Так, температура плавления триглицеридов повышается с увеличением числа и длины остатков насыщенных жирных кислот. Напротив, чем выше содержание ненасыщенных жирных кислот, или кислот с короткой цепью, тем ниже точка плавления. Животные жиры (сало) обычно содержат значительное количество насыщенных жирных кислот (пальмитиновой, стеариновой и др.). благодаря чему при комнатной температуре они твердые. Жиры, в состав которых входит много ненасыщенных кислот, при обычной температуре жидкие и называются маслами. Так, в конопляном масле 95% всех жирных кислот приходится на долю олеиновой, линолевой и линоленовой кислот и только 5% – на долю стеариновой и пальмитиновой кислот. В жире человека, плавящемся при температуре 15°С (при температуре тела он жидкий), содержится 70% олеиновой кислоты. Глицериды способны вступать во все химические реакции, свойственные сложным эфирам. Наибольшее значение имеет реакция омыления, в результате которой из триглицеридов образуются глицерол и жирные кислоты. Омыление жира * может происходить как при ферментативном гидролизе, так и при действии кислот или щелочей.
Кислотное число — количество миллиграмм гидроксида калия (KOH), необходимое для нейтрализации всех кислых компонентов, содержащихся в 1 г исследуемого вещества.
Число омыления — количество миллиграммов гидроксида калия (KOH), необходимое для нейтрализации свободных кислот и омыления сложных эфиров, содержащихся в 1 грамме исследуемого вещества.
Иодное число — масса иода (в г), присоединяющегося к 100 г органического вещества.
Моно- и полиеновые жирные кислоты, структура, свойства распространение. Напишите формулы следующих жирных кислот и назовите их:
