- •Часть I
- •1. Введение
- •1.1. Углерод
- •1.2. Органические соединения
- •1.3.Значение органической химии
- •Иллюстрация
- •1.4. Контрольные вопросы
- •2. Основы теории строения
- •2.1. Основные положения теории химического строения а.М.Бутлерова
- •2.1.1. Формулы строения
- •2.1.2. Понятие о изомерии
- •2.1.2.1. Структурные изомеры
- •2.1.2.2. Стереоизомеры
- •2.2. Электронные представления в органической химии
- •2.2.1. Свойства электрона
- •2.2.2. Атомные орбитали
- •2.2.3. Форма и энергия атомных орбиталей
- •2.2.4. Заполнение атомных орбиталей электронами
- •2.3. Контрольные вопросы
- •1. Какое из положений теории а.М. Бутлерова объясняет различие в реакциях соединений одинакового состава:
- •2. Изомерами называются . . .
- •3.1. Электроотрицательность элементов
- •3.2. Основные типы химических связей
- •3.2.1. Ионная связь
- •3.2.2. Ковалентная связь
- •3.2.2.1. Свойства ковалентной связи
- •3.2.2.2. Характеристики ковалентной связи
- •3.2.2.3. Неполярная ковалентная связь
- •3.2.2.4. Полярная ковалентная связь
- •3.3. Контрольные вопросы
- •2. Как изменяется электроотрицательность элементов в Периодической системе?
- •4. Природа кoвалентной связи
- •4.1. Как взаимодействуют атомные орбитали при образовании молекул?
- •4.2. Молекулярные орбитали
- •4.2.1. Энергия молекулярных орбиталей
- •Влияние несвязывающих молекулярных орбиталей (нсмо) на форму молекул
- •4.2.2.Форма молекулярных орбиталей. - и -мо
- •4.3. Гибридизация атомных орбиталей
- •Vrml-модель (109 822 байт).
- •Vrml-модель (2 камеры, 109 300 байт).
- •Vrml-модель (108 646 байт).
- •4.3.4. Энергия гибридных атомных орбиталей
- •4.4. Моделирование атомных и молекулярных орбиталей с использованием прикладных программ
- •4.5. Механизмы образования ковалентной связи
- •4.6. Донорно-акцепторные связи
- •4.7. Кратные связи
- •4.8. Электронные формулы молекул
- •4.9. Атомно-орбитальные модели
- •4.10. Делокализованные -связи. Сопряжение
- •4.11. Водородные связи (н-связи)
- •Почему связи типа водородных не образуют атомы других элементов?
- •4.11.2. Влияние водородных связей на свойства веществ
- •4.12. Контрольные вопросы
- •9. Укажите тип гибридизации атомов углерода в молекуле:
- •5.1. Классификация соединений по строению углеродной цепи
- •5.2. Классификация соединений по функциональным группам
- •5.3. Контрольные вопросы
- •6. Типы органических реакций
- •6.1. Основные понятия. Химическая реакция
- •6.1.1. Скорость реакции
- •6.1.2. Энергия активации
- •6.1.3. Тепловой эффект реакции
- •6.1.4. Химическое равновесие
- •6.1.5. Катализ
- •6.2. Отличительные особенности органических реакций
- •6.3. Понятие о механизме химической реакции
- •6.4. Классификация органических реакций
- •6.4.1. Классификация реакций по конечному результату
- •6.4.2. Классификация реакций по числу частиц, участвующих в элементарной стадии
- •6.4.3. Классификация реакций по механизму разрыва связей
- •Примеры нуклеофильных реакций
- •Является . . .
- •Панели управления Cosmo Player Панель 1 Панель 2
6.1.5. Катализ
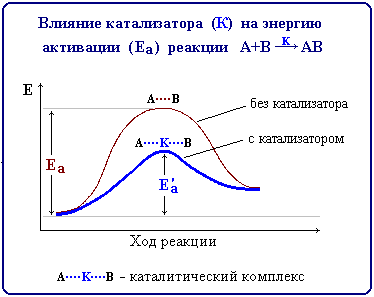
Катализ - изменение скорости химической реакции в присутствии веществ, которые, участвуя в реакции, к моменту окончания процесса остаются количественно неизменными.
Вещество, участвующее в реакции и изменяющее ее скорость, но остающееся неизменным после того, как химическая реакция заканчивается называется катализатором.
Катализ называется положительным, если скорость реакции увеличивается, и отрицательным, если скорость уменьшается. При гомогенном катализе реагенты и катализатор находятся в одной фазе (жидкой или газообразной), при гетерогенном катализе - в разных фазах (например, катализатор в твердом состоянии, а реагенты - в жидком или газообразном).
Механизм действия катализаторов, ускоряющих реакцию, связан с тем, что они снижают энергию активации реакции за счет образования промежуточных соединений с реагирующими веществами (каталитических комплексов), обладающих меньшей энергией:
6.2. Отличительные особенности органических реакций
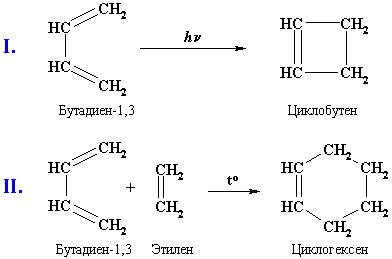
В реакциях органических соединений, как правило, изменения затрагивают только часть молекулы и ее основная конструкция (углеродный скелет) сохраняется. Например:
CH2=CH2 + H2O |
CH3CH2OH |
этилен |
этанол |
В случае неорганических реакций более характерен распад соединения на ионы или атомы, из которых образуются совершенно новые конструкции:
![]()
Большинство органических реакций протекают значительно медленнее реакций неорганических веществ и обычно не завершаются полностью вследствие их обратимости.
Многие органические реакции включают несколько элементарных стадий.
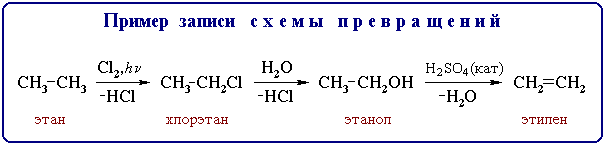
Примечание: последовательность нескольких реакций принято изображать в виде схемы превращений, в которой действующий на органическое соединение реагент записывается над стрелкой, а выделяющийся побочный продукт - под стрелкой со знаком “минус”:
Обратимая реакция - химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях. При выравнивании скоростей прямой и обратной реакций (состояние химического равновесия) обратимая реакция заканчивается.
Необратимой называется реакция, которая идет практически до конца в одном направлении.
6.3. Понятие о механизме химической реакции
Механизм реакции - детальное ее описание с учетом всех промежуточных стадий и промежуточных веществ, природы взаимодействия реагирующих частиц, характера разрыва связей, изменения энергии химической системы на всем пути ее перехода из исходного в конечное состояние. Цель изучения механизма реакции - возможность управлять ходом реакции, ее направлением и эффективностью.
Реакции, протекающие в одну стадию, называют простыми (элементарными) реакциями, а реакции, включающие несколько стадий - сложными. Энергетическая диаграмма простой реакции приведена на рис. 6.3 (а), сложной (двухстадийной) - на рис. 6.3 (б).
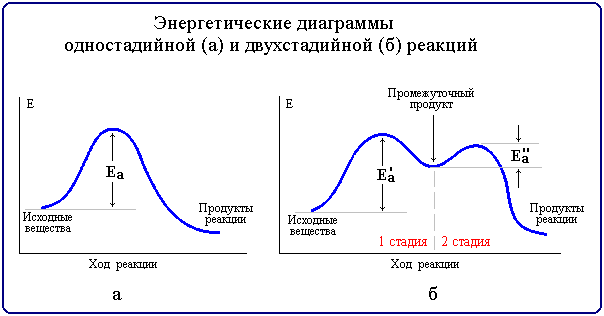 Рис.
6.3. Энергетические диаграммы
Рис.
6.3. Энергетические диаграммы
Многие органические реакции являются сложными и идут в несколько элементарных стадий (последовательных или параллельных). Общая скорость сложной химической реакции определяется скоростью ее наиболее медленной (лимитирующей) стадии. Например, в приведенной на рис. 6.3,б диаграмме лимитирующей является стадия 1 с более высокой энергией активации Еа'.
В случае сложных реакций на некоторых стадиях образуются нестабильные промежуточные частицы - органические ионы или свободные радикалы. Их относительная устойчивость и, следовательно, вероятность образования растут с увеличением возможности делокализации (рассредоточения) заряда в ионе или неспаренного электрона в радикале.
Примером многостадийной реакции может служить цепная реакция хлорирования метана CH4, которая будет подробнее рассмотрена в теме "Реакции замещения в алканах" (часть II, раздел 2.5.5).
Общая схема реакции: CH4 + Cl2 CH3Cl + HCl Стадии процесса: Cl2 2 Cl (на свету) I стадия (зарождение цепи) Cl + HCH3 HCl + CH3 II стадия (развитие цепи) CH3 + Cl2 CH3Cl + Cl III стадия (развитие цепи) Cl + CH3Cl HCl + CH2Cl2 IV стадия (развитие цепи) и т.д.
H3C + CH3 H3CCH3 V стадия (обрыв цепи) Cl + CH3 CH3Cl VI стадия (обрыв цепи)
Последовательные стадии: I, II (или III, IV) и V (или VI); параллельные - II, III, IV и V, VI.
Одностадийными реакциями являются, например, реакция I (циклизация бутадиена-1,3 в циклобутен) и реакция II (присоединение этилена к бутадиену):