
- •Загальна
- •Одеса онахт 2010
- •Глава 1. Основні поняття та закони хімії
- •1.1. Основні поняття хімії
- •1.2. Фундаментальні та стехіометричні закони хімії
- •1.2.1. Закон збереження маси речовини
- •1.2.2. Закон сталості складу речовин
- •1.2.3. Закон кратних відношень
- •1.2.4. Закон еквівалентів.
- •1.3. Закони газового стану
- •1.3.1. Закон об’ємних відношень гей-люсака
- •1.3.2. Закон авогадро
- •1.3.3. Закон бойля – маріотта
- •Контрольні завдання
- •Б) Із закону Авогадро випливає, що об’єм 0,025 моль h2s за нормальних умов
- •В) Відомо, що 1 моль будь-якої речовини містить 6,02 · 1023 молекул. Молярний об’єм газу за нормальних умов складає 22,4 л. Тому справедливо
- •Приклад 3. Який об’єм за нормальних умов займуть 4 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 104 Па?
- •Приклад 4. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
- •Приклад 5. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Відповідно до закону еквівалентів (1.1), маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
- •Зі співвідношення (1.8) знаходимо еквівалентну масу h3ро4:
- •Приклад 8. Обчислити точну атомну масу металу, якщо питома теплоємність металу дорівнює 0,23 кДж/(кг к), а хлорид цього металу містить 61,2% металу.
- •Приклад 10. Визначити формулу речовини, якщо відомо, що її густина за воднем дорівнює 29, а масові частки елементів наступні: с – 82,76%, н – 17,24%.
- •Глава 2. Класи неорганічних сполук
- •2.1. Оксиди.
- •2.1.1. Способи одержання оксидів
- •2.1.2. Класифікація та хімічні властивості оксидів
- •2.2. Гідроксиди металів
- •2.2.1. Способи одержання гідроксидів
- •2.2.2. Хімічні властивості гідроксидів металів
- •2.3. Кислоти
- •2.3.1. Способи одержання кислот
- •2.3.2. Хімічні властивості кислот
- •2.4.1.Основні способи одержання солей
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •3.2. Корпускулярно-хвильова природа електрона
- •3.3. Принцип невизначеності
- •3.4. Періодичний закон
- •3.5. Періодична система елементів
- •3.6. Електронні хмари
- •3.7. Квантові числа
- •3.8. Принцип паулі
- •3.9. Послідовність заповнення електронами енерґетичних рівнів у багатоелектронних атомах
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •Приклад 8. Які найвищий та найнижчий ступені окислення у фосфору, сульфуру та хлору? Скласти формули сполук даних елементів, що відповідають цим ступеням окислення.
- •Приклад 12. Як залежать кислотно-основні властивості оксидів і гідроксидів від ступеня окиснення атомів елементів, що їх утворюють?
- •Приклад 13. Відомо, що кремній є неметалом з напівпровідниковими властивостями. Які властивості будуть виявляти алюміній і фосфор?
- •Приклад 15. Як змінюються властивості вищих оксидів елементів третього періоду?
- •4.1.1. Характерні властивості ковалентного зв’язку
- •4.1.1.1. Насиченість ковалентного зв’язку
- •Мал. 4.3. Різновиди σ-зв’язків.
- •Мал. 4.3. Різновиди π-зв’язків.
- •4.1.1.3. Полярність і поляризованість ковалентного зв’язку.
- •4.3. Водневий зв’язок
- •4.5. Міжчастинкові взаємодії
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач Приклад 1. Довжина диполя молекули дорівнює 2,2 10-11 м. Обчисліть дипольний момент молекули.
- •Приклад 2. Обчислити довжину зв’язку в молекулі hBr, якщо між’я-дерні відстані у молекулах h2 та Br2 відповідно дорівнюють 7,4 · 10-11 м та 2,28 10-10 м.
- •Приклад 3. Яка гібридизація електронних хмар має місце в атомі карбону при утворенні молекули cf4? Якою є просторова конфігурація цієї молекули?
- •Приклад 4. Якими є валентні можливості атома фосфору в основному та збудженому станах?
- •Приклад 5. Визначте, що є донором електронної пари при утворенні йона bh4-.
- •Глава 5. Основи хімічної термодинаміки
- •5.2. Перший закон термодинаміки
- •5.3. Закони термохімії
- •5.4. Поняття про ентропію
- •5.5. Другий закон термодинаміки
- •5.6.Третій закон термодинаміки
- •5.7. Вільна енергія Гіббса
- •Приклад 1. Складіть термохімічне рівняння реакції горіння 1 моль ацетилену, якщо при цьому виділяється 1255,61 кДж теплоти.
- •Приклад 3. Не здійснюючи обчислень, поясніть, як змінюється ентропія системи (s): а) при переході води в пару; б) у реакції:
- •Приклад 4. Обчисліть зміну енерґії Ґіббса у хімічній реакції
- •І зробіть висновки про можливість мимовільного перебігу даної реакції за стандартних умов.
- •Стандартні зміни енерґій Ґіббса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •6.1. Поняття про швидкість хімічної реакції
- •6.2. Основний закон хімічної кінетики – закон діючих мас.
- •Межі застосування закону діючих мас.
- •6.3. Молекулярність реакції.
- •6.4. Порядок реакції.
- •6.5. Особливості кінетики гетероґенних реакцій.
- •6.6. Механізм хімічних реакцій.
- •6.7. Вплив температури на швидкість реакції. Правило Вант-Гоффа.
- •6.8. Рівняння Арреніуса. Енерґія активації
- •Вихідні Активов. Продукти
- •Мал.6.3. Енерґетична діаграма Мал.6.4. Розподіл молекул за
- •Глава 7. Хімічна рівновага.
- •7.1. Константа хімічної рівноваги
- •7.2. Зсув хімічної рівноваги. Принцип Ле-Шательє
- •7.3. Рівновага у гетероґенних системах
- •Константа рівноваги.
- •Глава 8. Поняття про каталіз.
- •8.1. Автокаталіз
- •8.2.Промотори та каталітичні отрути
- •8.3. Селективність каталізаторів
- •8.4. Механізми гомоґенного та гетероґенного каталізу
- •Підставляючи дані нашої задачі, одержуємо:
- •Глава 9. Розчини
- •9.1. Процес розчинення. Типи розчинів
- •9.2. Способи виразу концентрації речовин
- •9.3. Хімічна (гідратна) теорія розчинів д.І. Менделєєва
- •9.4. Теплові ефекти розчинення
- •9.5. Розчинність
- •Глава 10. Властивості розчинів
- •10.1. Тиск пари розчинника над розчином
- •10.2. Температури замерзання та кипіння розчинів
- •10.3. Осмотичний тиск
- •Глава 11. Електролітична дисоціація.
- •11.1. Основні положення теорії електролітичної дисоціації
- •11.2. Ступінь дисоціації
- •11.3. Слабкі електроліти. Константа дисоціації слабких електролітів
- •11.4. Вплив однойменних іонів на дисоціацію слабких електролітів
- •11.5. Розчини сильних електролітів
- •11.6. Електролітична дисоціація води. Йонний добуток води. Водневий показник
- •11.7. Поняття про індикатори
- •11.8. Іонні реакції
- •11.8. Гідроліз солей
- •Типові випадки гідролізу.
- •11.8.1. Ступінь і константа гідролізу
- •Глава 12. Комплексні сполуки
- •12.1. Основні положення координаційної теорії а.Вернера
- •12.2. Класифікація комплексних сполук
- •12.3. Номенклатура комплексних сполук
- •12.3.1. Назви катіонних комплексних сполук
- •12.3.2. Назви аніонних комплексних сполук
- •12.3.3. Назви нейтральних комплексних сполук
- •12.4. Ізомерія комплексних сполук
- •12.5. Дисоціація комплексних сполук
- •Якщо у гібридизації беруть участь d-орбіталі передостаннього рівня, тоді йон називається внутрішньоорбітальним. Іноді у комплексах проявляється йонно-дипольний зв’язок, наприклад в аквакомплексах.
- •Глава 13. Електрохімічні процеси
- •13.1. Хімічні процеси на електродах
- •13.2. Електродний потенціал
- •13.3. Електрохімічний ряд напруг металів
- •13.4. Гальванічний елемент
- •13.5. Окисні й відновні потенціали
- •13.6. Рівняння Нернста
- •13.7. Акумулятори
- •13.8. Паливні елементи
- •13.9. Електроліз
- •13.9.1. Закони Фарадея
- •1. Кількість речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь електроліт.
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •13.10. Корозія металів
- •0,01 Моль/л 0,1 моль/л
- •Глава 14. Окисно-відновні реакції складання рівнянь окисно-відновних реакцій
- •Контрольні завдання
- •Додатки
- •Додаток 6 – Перехідні коефіцієнти
- •Предметний покажчик
- •Відновлення 18-19, 77, 81, 124, 126, 128, 135-139
- •Водень 14, 17, 37, 75, 125, 130-132, 139
- •Ізомерія 119
- •Лантаноїди 25
- •Натрій 20-21, 69, 89
- •Термодинамічні 8, 54
- •Атомів 33, 50
- •Список рекомендованої літератури
- •Глава 1. Основні поняття та закони хімії ........................ 5
Вихідні Активов. Продукти
молекули комплекс реакції
В активованому комплексі старі зв’язки ще не розірвані, але вже послаблені; нові зв’язки намітились, але ще не утворились. Час існування такого комплексу є невеликим (порядку 10-13 с). При розпаді комплексу утворюються або продукти реакції, або вихідні речовини.
У будь-якому випадку для утворення перехідного комплексу необхідна енерґія. Система у перехідному стані має більш високу енерґію ніж у вихідному (Нвих.) та кінцевому (Нкінц.) станах (мал.6.3).
Енерґія, необхідна для переходу речовин у стан активованого комплексу називається енерґією активації. Її природу було пояснено Лондоном у 1928 році на підставі методу валентних зв’язків. Енерґетичний бар’єр створюється у підсумку взаємного відштовхування хімічно не сполучених атомів. Слід зазначити, що перехідний стан завдяки максимальній енерґії є нестійким, тому він не може бути визначений як хімічна сполука у звичайному розумінні (для нього незастосовні у повному обсязі такі поняття, як валентні кути, міжатомні відстані, тощо). Склад і будова активованих комплексів відомі тільки для небагатьох найбільш ретельно вивчених реакцій.
Утворення перехідного стану – процес енерґетично більш вигідний ніж повний розпад молекул, що вступають до реакції (для більшості процесів енерґія активації дещо менше енерґії дисоціації найменш міцного зв’язку в молекулах подібних речовин). Ось чому утворення активованого комплексу властиве для переважної більшості процесів.
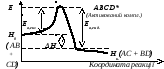
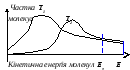

Мал.6.3. Енерґетична діаграма Мал.6.4. Розподіл молекул за
реакції з утворенням активов. компл. енерґіями при двох Т (Т2 >Т1).
Можливість утворення активованого комплексу, а відповідно й хімічної взаємодії, визначається енерґією молекул. Молекула, енерґія якої є достатньою для утворення активованого комплексу, називається активною. Частка таких молекул у системі залежить від температури. Частинки (молекули) у системі розподіляються за енерґіями відповідно до складної залежності Максвела – Больцмана, вигляд якої змінюється зі зміною температури (мал.4). Як видно з малюнку, зі збільшенням температури зростає частка молекул, енерґія яких дорівнює, чи вище енерґії активації (Еа), відповідно зростає кількість молекул здатних до активних зіткнень із утворенням активованого комплексу, тобто відбувається прискорення реакції. Чим вище енерґія активації, тим, відповідно, менше частка частинок, здатних до активної взаємодії. Екзотермічні реакції перебігають із меншою енерґією активації ніж ендотермічні (див.мал.3). Висока енерґія активації чи, як інколи кажуть, високий енерґетичний бар’єр є причиною того, що багато хімічних реакцій за невисоких температур не перебігають, хоча й принципово можливі (ΔG < 0). Так у звичайних умовах самочинно не займається целюлоза, вугілля, ґас, сірка, хоча зміна енерґії Ґіббса реакцій окиснення цих речовин менша за нуль. За високих температур частка активних частинок досить велика й реакції перебігають швидко.
Отже, енерґія активації – це та енерґія, яка необхідна для переходу частинок у стан активованого комплексу. Частинки, енерґія яких дорівнює, чи вище енерґії активації (Еа) називаються активними. Зі зростанням температури частка таких частинок, а відповідно й швидкість реакції збільшується. Зі збільшенням енерґії активації зменшується частка активних молекул, а отже й швидкість реакції.
Передекспоненціальний множник. З рівняння Арреніуса (6.8.) випливає, що k = k0 при Еа = 0, що може означати те, що будь-яке зіткнення частинок призводить до хімічної реакції. Кінетична теорія газів дозволяє розрахувати число зіткнень частинок за одиницю часу (Z). Як показує дослід, для більшості молекул k0 < Z, тобто не кожне зіткнення, навіть активних, частинок призводить до реакції, бо є ще одна умова перебігу реакції – певна орієнтація молекул, сприятлива перерозподілові електронної густини. Наприклад при взаємодії СО та Н2О можливі різні орієнтації цих молекул однієї відносно іншої:
Н Н
\ \
О + C ≡ O → H – H + O = C = O (1) О + O ≡ C → H2O + CO (2).
/ /
H H
У першому випадку орієнтація молекул сприяє, а у другому перешкоджає здійсненню реакції. Тому передекспоненціальний множник включає в себе й чинник орієнтації молекул (імовірнісний чинник) Рор.:
k0 = ZPop (6.15.); k = ZPopexp(–Ea/RT) (6.16.).
Імовірнісний чинник зменшується зі зростанням числа й складності одночасно реагуючих частинок від десятих частин одиниці до 10-9.
Таким чином, передекспоненціальний множник відображує частоту зіткнень та орієнтацію реагуючих частинок. Принципово можлива реакція перебігає за двох наступних умов: достатньої енерґії та належної орієнтації частинок.
Основне рівняння теорії активованого комплексу для константи швидкості: k = k0exp(-∆Н*/RT)exp(+Sа*/R) (6.17.),
де k0 – число зіткнень за одиницю часу; ∆Н* – зміна ентальпії активації; Sа* – зміна ентропії активації при утворенні активованого комплексу.
При співставленні рівняння (6.17.) з рівнянням Арреніуса (6.16.) та за умови, що ∆Н* ≈ Еа, розкривається фізичний зміст стеричного чинника Рор.: Рор = =exp(+∆S*/RT). Він відображує вплив зміни ентропії у процесі активації на швидкість реакції.
