
- •«Национальный исследовательский
- •1.1. Цели преподаваемой дисциплины
- •1.2. Задачи изложения и изучения дисциплины
- •2. Содержание теоретического раздела дисциплины
- •2.1. Введение. Основные понятия и законы химии
- •2.2. Строение вещества
- •2.2.1. Строение атомов
- •2.2.2. Периодическая система элементов и изменение свойств элементов
- •2.3.2. Химическая кинетика
- •3. Содержание практического раздела дисциплины
- •3.1. Тематика практических занятий
- •3.2. Перечень лабораторных работ
- •4. Элементы теории и вопросы для самопроверки по темам курса. Предисловие
- •1. Химические формулы. Валентность
- •2. Номенклатура
- •3. Классификация неорганических соединений
- •Гидроксиды
- •4. Структурные формулы
- •Тема 1. Атомно-молекулярное учение
- •1.2. Газовые законы
- •1.3. Определение молекулярных масс веществ
- •1.4. Эквивалент. Эквивалентные массы.
- •Тема 1. Атомно-молекулярное учение и стехиометрия
- •Тема 2. Строение атома
- •2.1. Корпускулярно-волновое описание движения электрона в атоме
- •2.2 Волновая теория строения атома.
- •2.3. Квантовые числа
- •2.5. Периодическая система и изменение свойств элементов
- •1) При заполнении уровня и подуровня устойчивость электронной конфигурации возрастает и
- •2) Особой устойчивостью обладают заполненные (s2, p6, d10, f14) и наполовину заполненные (p3, d5, f7) конфигурации.
- •Тема 2. Строение атома
- •Тема 3. Химическая связь
- •3.1. Метод валентных связей (вс)
- •Приведённым схемам вс соответствуют структурные формулы (сф) (рис. 3.3), на которых связывающие электронные пары изображают чёрточками (валентная черта), а несвязывающие электроны – точками.
- •3.2. Метод молекулярных орбиталей (мо)
- •3.3. Теории металлической связи
- •3.4. Межмолекулярные взаимодействия
- •3.5. Кристаллические решетки
- •Тема 3. Химическая связь
- •3.6. Комплексные соединения
- •3.6.1. Определения, составные части и классификация
- •3.6.2. Равновесие в растворах комплексных соединений
- •3.6.3. Изомерия комплексных соединений
- •3.6.4. Химическая связь в комплексных соединениях
- •Тема 4. Элементы термодинамики
- •4.1. Основные понятия и определения
- •4.2. Тепловые эффекты химических реакций
- •4.2.2. Термохимические расчеты.
- •4.3. Направление химических реакций
- •4.3.1. Энтропия
- •4.3.2 Энтальпийный и энтропийный факторы.
- •Тема 4. Химическая термодинамика
- •Тема 5. Химическое равновесие
- •5.1. Химическое равновесие
- •5.2. Константа равновесия
- •Например, для обратимой реакции
- •5.3. Свободная энергия и константа равновесия
- •5.4. Смещение химического равновесия. Принцип Ле Шателье
- •Напоминаем, что в выражение константы равновесия гетерогенной реакции входят только концентрации газообразных веществ, так как концентрации твердых веществ остаются, как правило, постоянными.
- •Тема 5. Химическое равновесие
- •Тема 6. Химическая кинетика
- •6.1. Основные понятия и представления
- •6.2. Зависимость скорости химической реакции
- •6.3. Зависимость скорости от температуры
- •6.4. Катализ
- •Тема 6. Химическая кинетика
- •Тема 7. Концентрация растворов
- •7.1. Способы выражения концентрации растворов
- •Тема 7. Концентрация растворов
- •Тема8. Растворы
- •8.1. Свойства разбавленных растворов неэлектролитов
- •8.2. Растворы электролитов
- •8.2.1. Диссоциация кислот, оснований и солей
- •8.2.2. Свойства разбавленных растворов электролитов
- •8.2.3. Ионные реакции
- •8.2.4. Электролитическая диссоциация воды.
- •8.2.5. Гидролиз солей
- •Тема 8. Свойства растворов
- •Реакции в растворах электролитов
- •Тема 9. Окислительно-восстановительные реакции
- •9.1. Уравнивание овр
- •9.2. Типы окислительно-восстановительных реакций
- •9.3. Эквиваленты окислителя и восстановителя
- •Тема 9. Окислительно-восстановительные реакции
- •Тема 10 .Электрохимические процессы
- •10.1. Химические источники электрической энергии
- •10.2. Электролиз
- •10.3. Количественные законы электролиза
- •2. При прохождении одного и того же количества электричества через раствор или расплав электролита массы (объемы) веществ, выделившихся на электродах, прямо пропорциональны их химическим эквивалентам.
- •10.4. Коррозия металлов
- •Тема 10. Электрохимические процессы
- •Контрольные задания
- •1. Закон эквивалентов. Газовые законы
- •2. Строение атома
- •Периодическое изменение свойств элементов
- •3. Химическая связь
- •4. Энергетика химических реакций
- •Свободная энергия, энтропия. Направление химических реакций
- •Химическое равновесие. Смещение химического равновесия
- •6. Химическая кинетика
- •7. Концентрация растворов
- •8. Свойства разбавленных растворов неэлектролитов
- •Обменные реакции в растворах электролитов
- •Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •10. Электрохимические процессы
- •Электролиз
- •Коррозия металлов
- •Комплексные соединения
- •Жесткость воды
- •Химия элементов
- •1. Цели и задачи учебной дисциплины. . . . . . . . . . . . . . . . . . . 3
- •Тема 2. Строение атома. . . . . . . . . . . . . . . . . . . . . . . . .. . . . . . . . . . . .37
- •Тема 3. Химическая связь. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
- •Тема 4. Элементы термодинамики . . . . . . . . . . . . . . . . . . . . . . .75
- •Тема 5. Химическое равновесие. . . . . . . . . . . . . . . . . . . .. . . . . . . 89
- •Тема 6. Химическая кинетика . . . . . . . . . . . . . . . . . . .. . . . . . . . . .97
- •Тема 7. Концентрация растворов . . . . . . . . . . . . . . . . . . . . . . .. . . 104
- •Тема8. Растворы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .108
- •Тема 9. Окислительно-восстановительные реакции. . . . .126
- •Тема 10. Электрохимические процессы. . . . . .. . . . . . . . . . . . . .132
3.6.2. Равновесие в растворах комплексных соединений
При диссоциации в растворах и многих химических реакциях комплекс сохраняется:
[Ni(NH3)4]SO4 [Ni(NH3)4]2+ + SO42
[Ni(NH3)4]SO4 + BaCl2 = [Ni(NH3)4]Cl2 + BaSO4
Обычно комплексные соединения в растворах диссоциируют на внешнюю и внутреннюю координационные сферы практически полностью по типу сильных электролитов (первичная диссоциация). Комплексные соединения обладают различной прочностью внутренней координационной сферы. Наряду с соединениями, внутренняя сфера которых отличается значительной прочностью и для которых диссоциация ничтожно мала, существуют соединения с крайне непрочной внутренней сферой. Растворы этих соединений практически не содержат комплексных ионов, так как они полностью диссоциируют на свои составные части (двойные соли). Диссоциация внутренней координационной сферы носит название вторичной, является обратимым процессом и проходит по типу слабых электролитов. Момент наступления равновесия характеризуется константой равновесия, которая в случае комплексного иона носит название константы нестойкости (КН).
Пример 14. Напишите процессы диссоциации и выражение для константы нестойкости комплексной соли К4[Fe(CN)6].
Решение. Если комплексная соль гексацианоферрат (III) калия, являясь сильным электролитом, в водном растворе практически полностью диссоциирует на ионы внешней и внутренней сфер:
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4 ,
то комплексный ион диссоциирует в незначительной степени на составляющие его частицы:
[Fe(CN)6]4 ⇆ Fe2+ + 6CN
Константа равновесия этой реакции в данном случае является константой нестойкости (КН) комплекса:
КН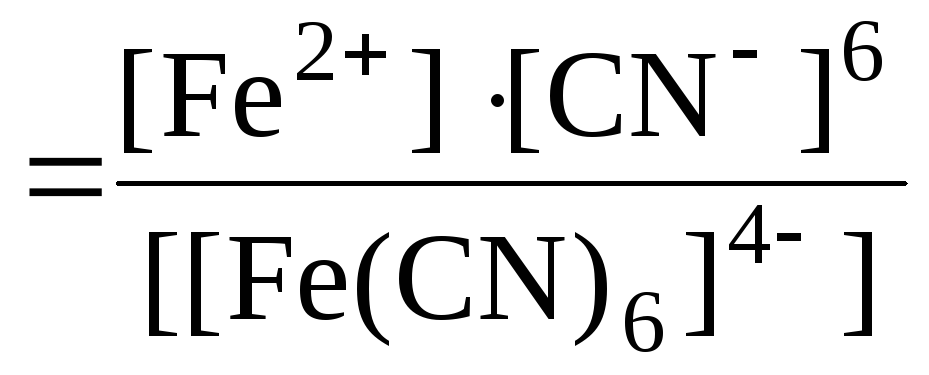 .
.
Значения констант нестойкости различных комплексных ионов колеблются в широких пределах и могут служить мерой устойчивости комплекса.
Чем меньше значение Кн, тем более прочен данный комплекс.
Сравним, например, константы нестойкости и устойчивость ряда комплексов серебра: [Ag(NO2)2], [Ag(NH3)2]+, [Ag(S2O3)]3 и [Ag(CN)2]. Для них Кн: 1,3·103 ; 5,7·108; 2,5·1014 и 8,0·1021 соответственно. Следовательно, можно прийти к выводу, что наименее устойчивым из этих ионов является первый, а наиболее устойчивым последний. Очевидно также, что при одной и той же молярной концентрации комплексного соединения концентрация ионов Аg+ будет больше в растворе первого соединения и меньше в растворе последнего.
3.6.3. Изомерия комплексных соединений
Возможны различные типы изомеров комплексных соединений (изомерия это такое явление, когда вещества, имеющие одинаковый состав, различаются строением и, следовательно, свойствами). В химии комплексных соединений это явление весьма распространено и является одной из причин многообразия комплексных соединений. Различают несколько видов изомерии:
1. Ионизационная изомерия различное распределение анионов между внутренней и внешней координационной сферами: [Co(NH3)5Br]SO4 (красно-фиолетовый) и [Co(NH3)5SO4]Br (красный).
2. Координационная изомерия выражается в различной координации двух типов лигандов относительно двух разных комплексообразователей. Например, для солей с комплексными анионом и катионом: [Pt(NH3)4][PdCl4] и [Pd(NH3)4][PtCl4].
Геометрическая (цис-транс)-изомерия для комплексов с разными лигандами


 Cl
NH3
Cl NH3
Cl
NH3
Cl NH3


 Pt
Pt
Pt
Pt
Cl NH3 H3N Cl
цис-изомер транс-изомер
Кроме того, известны и другие виды изомерии. Изомерия имела большое значение для установления геометрии комплексов ещё до появления физических методов её определения, так как количество изомеров для каждой геометрии точно известно, а определить это количество можно чисто химическими методами.
