
- •«Национальный исследовательский
- •1.1. Цели преподаваемой дисциплины
- •1.2. Задачи изложения и изучения дисциплины
- •2. Содержание теоретического раздела дисциплины
- •2.1. Введение. Основные понятия и законы химии
- •2.2. Строение вещества
- •2.2.1. Строение атомов
- •2.2.2. Периодическая система элементов и изменение свойств элементов
- •2.3.2. Химическая кинетика
- •3. Содержание практического раздела дисциплины
- •3.1. Тематика практических занятий
- •3.2. Перечень лабораторных работ
- •4. Элементы теории и вопросы для самопроверки по темам курса. Предисловие
- •1. Химические формулы. Валентность
- •2. Номенклатура
- •3. Классификация неорганических соединений
- •Гидроксиды
- •4. Структурные формулы
- •Тема 1. Атомно-молекулярное учение
- •1.2. Газовые законы
- •1.3. Определение молекулярных масс веществ
- •1.4. Эквивалент. Эквивалентные массы.
- •Тема 1. Атомно-молекулярное учение и стехиометрия
- •Тема 2. Строение атома
- •2.1. Корпускулярно-волновое описание движения электрона в атоме
- •2.2 Волновая теория строения атома.
- •2.3. Квантовые числа
- •2.5. Периодическая система и изменение свойств элементов
- •1) При заполнении уровня и подуровня устойчивость электронной конфигурации возрастает и
- •2) Особой устойчивостью обладают заполненные (s2, p6, d10, f14) и наполовину заполненные (p3, d5, f7) конфигурации.
- •Тема 2. Строение атома
- •Тема 3. Химическая связь
- •3.1. Метод валентных связей (вс)
- •Приведённым схемам вс соответствуют структурные формулы (сф) (рис. 3.3), на которых связывающие электронные пары изображают чёрточками (валентная черта), а несвязывающие электроны – точками.
- •3.2. Метод молекулярных орбиталей (мо)
- •3.3. Теории металлической связи
- •3.4. Межмолекулярные взаимодействия
- •3.5. Кристаллические решетки
- •Тема 3. Химическая связь
- •3.6. Комплексные соединения
- •3.6.1. Определения, составные части и классификация
- •3.6.2. Равновесие в растворах комплексных соединений
- •3.6.3. Изомерия комплексных соединений
- •3.6.4. Химическая связь в комплексных соединениях
- •Тема 4. Элементы термодинамики
- •4.1. Основные понятия и определения
- •4.2. Тепловые эффекты химических реакций
- •4.2.2. Термохимические расчеты.
- •4.3. Направление химических реакций
- •4.3.1. Энтропия
- •4.3.2 Энтальпийный и энтропийный факторы.
- •Тема 4. Химическая термодинамика
- •Тема 5. Химическое равновесие
- •5.1. Химическое равновесие
- •5.2. Константа равновесия
- •Например, для обратимой реакции
- •5.3. Свободная энергия и константа равновесия
- •5.4. Смещение химического равновесия. Принцип Ле Шателье
- •Напоминаем, что в выражение константы равновесия гетерогенной реакции входят только концентрации газообразных веществ, так как концентрации твердых веществ остаются, как правило, постоянными.
- •Тема 5. Химическое равновесие
- •Тема 6. Химическая кинетика
- •6.1. Основные понятия и представления
- •6.2. Зависимость скорости химической реакции
- •6.3. Зависимость скорости от температуры
- •6.4. Катализ
- •Тема 6. Химическая кинетика
- •Тема 7. Концентрация растворов
- •7.1. Способы выражения концентрации растворов
- •Тема 7. Концентрация растворов
- •Тема8. Растворы
- •8.1. Свойства разбавленных растворов неэлектролитов
- •8.2. Растворы электролитов
- •8.2.1. Диссоциация кислот, оснований и солей
- •8.2.2. Свойства разбавленных растворов электролитов
- •8.2.3. Ионные реакции
- •8.2.4. Электролитическая диссоциация воды.
- •8.2.5. Гидролиз солей
- •Тема 8. Свойства растворов
- •Реакции в растворах электролитов
- •Тема 9. Окислительно-восстановительные реакции
- •9.1. Уравнивание овр
- •9.2. Типы окислительно-восстановительных реакций
- •9.3. Эквиваленты окислителя и восстановителя
- •Тема 9. Окислительно-восстановительные реакции
- •Тема 10 .Электрохимические процессы
- •10.1. Химические источники электрической энергии
- •10.2. Электролиз
- •10.3. Количественные законы электролиза
- •2. При прохождении одного и того же количества электричества через раствор или расплав электролита массы (объемы) веществ, выделившихся на электродах, прямо пропорциональны их химическим эквивалентам.
- •10.4. Коррозия металлов
- •Тема 10. Электрохимические процессы
- •Контрольные задания
- •1. Закон эквивалентов. Газовые законы
- •2. Строение атома
- •Периодическое изменение свойств элементов
- •3. Химическая связь
- •4. Энергетика химических реакций
- •Свободная энергия, энтропия. Направление химических реакций
- •Химическое равновесие. Смещение химического равновесия
- •6. Химическая кинетика
- •7. Концентрация растворов
- •8. Свойства разбавленных растворов неэлектролитов
- •Обменные реакции в растворах электролитов
- •Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •10. Электрохимические процессы
- •Электролиз
- •Коррозия металлов
- •Комплексные соединения
- •Жесткость воды
- •Химия элементов
- •1. Цели и задачи учебной дисциплины. . . . . . . . . . . . . . . . . . . 3
- •Тема 2. Строение атома. . . . . . . . . . . . . . . . . . . . . . . . .. . . . . . . . . . . .37
- •Тема 3. Химическая связь. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
- •Тема 4. Элементы термодинамики . . . . . . . . . . . . . . . . . . . . . . .75
- •Тема 5. Химическое равновесие. . . . . . . . . . . . . . . . . . . .. . . . . . . 89
- •Тема 6. Химическая кинетика . . . . . . . . . . . . . . . . . . .. . . . . . . . . .97
- •Тема 7. Концентрация растворов . . . . . . . . . . . . . . . . . . . . . . .. . . 104
- •Тема8. Растворы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .108
- •Тема 9. Окислительно-восстановительные реакции. . . . .126
- •Тема 10. Электрохимические процессы. . . . . .. . . . . . . . . . . . . .132
3.6. Комплексные соединения
3.6.1. Определения, составные части и классификация
Комплексными называются соединения, которые можно рассматривать как образованные из более простых:
3KCN + Fe(CN)3 = K3[Fe(CN)6]
4NH3 + CuSO4 = [Cu(NH3)4]SO4
В квадратные скобки ставят собственно комплекс. Внутри скобок внутренняя координационная сфера, а за скобками внешняя.
Комплексы (комплексные, координационные соединения) это молекулы или ионы, обладающие высокой симметрией, имеющие атом в центре симметрии центральный атом, комплексообразователь, электронная валентность которого больше стехиометрической. Вокруг центрального атома располагаются атомы или группы атомов лиганды, которые и образуют симметричную фигуру.
Например, [Pt(NH3)2Cl2] квадрат с атомом Pt в центре (Vстх. = 2, Vē = 4) и лигандами Cl– и NH3; [CoF6]3 октаэдр с атомом Co (Vстх = 3, Vē = 6) в центре и лигандами F– .
В качестве лигандов выступают обычно анионы (F, Cl, CO32), нейтральные молекулы (H2O, NH3) и, очень редко, катионы (например, NO+).



 3
3
F


 F F
F F
C
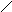 l
NH3
\
l
NH3
\

 Pt
Со
Pt
Со
H3N Cl / \

 F
F
F
F
F
F
Лиганды могут занимать одно, два, три и более мест вокруг центрального атома. Число мест, занимаемых лигандом, называется дентатностью. Например, все приведенные выше лиганды занимают одно координационное место они монодентатны. У этилендиамина (NH2CH2CH2NH2) два координационных места (у атомов N), он бидентатен; анион этилендиаминтетрауксусной кислоты (ЭДТА) гексадентатен и т. д.
Число координационных мест вокруг центрального атома называется его координационным числом (4 и 6 в приведенных примерах).
В качестве центрального атома в комплексах обычно выступают катионы, иногда атомы и редко отрицательные ионы. Например, в приведенных выше комплексах это катионы Fe2+, Cu2+, Pt2+ и Co3+, в комплексе [Ni(CО)4]o нейтральный атом Ni; в комплексе H[Co(CO)4] отрицательный ион Co.
Комплексные соединения классифицируются по составу и заряду комплексов:
катионные [Ni(NH3)4]2+, анионные [Co(CN)6 ]3, нейтральные [Co(NH3)4Сl2]0;
по кислотно-основным свойствам: кислоты H[AuCl4]; основания [Ag(NH3)2]OH; соли [Ni(NH3)6]SO4;
по типу (составу) лигандов: гидроксокомплексы K2[Zn(OH)4]; аквакомплексы [Fe(H2O)6]Cl3; ацидокомплексы (лиганды анионы кислот) K4[Fe(CN)6]; комплексы смешанного типа K[Co(NH3)2Cl4], [Pt(NH3)4(H2O)2]Cl4.
Пример 12. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях:
а) K4[Fe(CN)6]; б) K2[MoF8]; в) [Cr(H2O)2(NH3)4]Cl3.
Решение. Координационное число комплексообразователя равно числу связей c лигандами, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (H2O, NH3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Заряд комплексного иона равен заряду внешней сферы, но противоположен по знаку. Отсюда:
-
Соединение
Заряд комп-
лексн. иона
к.ч. центр. атома
Степ. окисл.
центр. атома
а) K4[Fe(CN)6]
4
6
+2
б) K2[MoF8]
2
8
+6
в) [Cr(H2O)2(NH3)4]Cl3
+3
6
+3
Названия комплексов строятся по общим правилам IUPAC : справа налево, лиганды с окончанием -о, анионы с окончанием -ат. Лишь некоторые молекулы-лиганды имеют особые названия, например Н2О и NH3 называют «аква» и «амин» соответственно.
Пример 13. Дать названия следующим комплексным соединениям:K3[Fe(CN)6], [Cu(NH3)6]SO4, [CoF3(H2O)3].
Решение. K3+[Fe+3(CN)6]3 комплекс анионного типа, поэтому название заканчивается суффиксом -ат . Степень окисления центрального атома указывают римскими цифрами в скобках гексационоферрат (III) калия;
[Cu+2(NH3)6]+2SO4 комплекс катионного типа сульфат гексааммин меди (II);
[Co+3F3(H2O)3]o нейтральный комплекс (неэлектролит) центральный ион называют без указания его степени окисления триакватрифторокобальт, так как фтор в соединениях всегда F.
