
химия14
.docx|
14 |
1 |
314 |
324 |
334 |
344 |
354 |
364 |
384 |
394 |
414 |
424 |
434 |
454 |
|
2 |
489 |
505 |
527 |
538 |
544 |
569 |
592 |
601 |
607 |
640 |
658 |
679 |
Ответы к расчетным задачам
394. 158,14 г Sb2S3; 71,68 л NO. 424. [Pb2+][OH-]2 = 0,125·10-3. 434. Окислитель – 31,6 г/моль; восстановитель – 252 г/моль.
538. 14,79г V2O5; 2,26 л NH3
314. Как изменяется константа гидролиза однотипных веществ по периодам и группам? Написать уравнение гидролиза в молекулярном и ионно-молекулярном виде следующих веществ: КВr, МgBr2, АlBr3, SiBr4
324. Написать возможные схемы реакций цинка с концентрированной серной кислотой и выбрать из них термодинамически более вероятную (использовать окислительно-восстановительные потенциалы). Уравнять методом полуреакций.
334. Закончить уравнения реакций с участием соединений галогенов и уравнять методом полуреакций.
1) FeSO4 + KIO3 +H2SO4 =
2) Br2 + KOH =
3) Cr(OH)3 +CI2 + NaOH =
4) KCI + KCIO3 +H2SO4 =
Вычислить молярную массу эквивалентов окислителя и восстановителя в реакции (1).
344. Чем объяснить, что электролитическая и термическая диссоциация молекул HF требует разных энергетических затрат.
НF(р) = H+(р) + F-(р); Hº298 = –13,29 кДж/моль
HF(г) = H(г) + F(г); Hº298 = 562,4 кДж/моль
354. Селен и теллур могут быть получены из H2SeO4 и H6TeO6 при их восстановлении сильными восстановителями. Составить молекулярные уравнения: а) теллуровой кислоты с диоксидом серы; б) селеновой кислоты с гидразином.
364. Охарактеризовать наиболее вероятные состояния гибридизации атомов серы в молекулах SF6, SCl2. SOCl2, SO2Cl2 и изобразить пространственную конфигурацию этих молекул.
384. Какие из соединений азота: NH3, N2H4, NH2OH, HN3, NO, N2O3, NO2, N2O5 могут получаться в качестве продуктов восстановления азотной кислоты металлами? Привести примеры уравнений соответствующих реакций, подобрать коэффициенты методом полуреакций.
394. Сколько граммов Sb2S3 можно растворить в 200 мл раствора НNО3 с массовой долей 60 % ( = 1.68 кг/л)? Какой объем (н.у.) оксида азота (II) выделится при этом?
414. Используя метод ВС, объяснить химические связи и геометрическое строение молекул СН4, СО2, СS2, С2Н2. Сколько - и -связей образует атом углерода в каждой из этих молекул?
424.
Выпадет ли осадок гидроксида свинца
(II) (ПР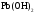 =
10–20),
если к 10 мл 0,2 н раствора нитрата свинца
(II) добавить 10 мл 0,1 н раствора аммиака?
=
10–20),
если к 10 мл 0,2 н раствора нитрата свинца
(II) добавить 10 мл 0,1 н раствора аммиака?
434. Закончить уравнения реакций:
1) In + HNO3(конц) = 2) Tl2SO4 + KMnO4 + H2SO4 =
3) Ga + NaOH(раствор) = 4) Ga + NaOH(расплав) =
Подобрать коэффициенты в уравнениях 1 и 2 методом полуреакций. В уравнении 2 вычислить молярную массу эквивалентов окислителя и восстановителя.
454. Из каких природных соединений и какими способами получают металлы второй группы периодической системы? Описать их отношение к воде, кислотам, щелочам и кислороду воздуха.
489. Почему d-элементы образуют большое число комплексных соединений? Почему все комплексные соединения цинка(+2) и кадмия(+2) бесцветны, а железа – окрашены?
505. Как относятся металлы подгруппы скандия к водороду? Сравнить строение и свойства гидридов алюминия, галлия и лантана. В чем проявляется существенное различие гидридов алюминия и лантана?
527. Закончить уравнения реакций; назвать продукты.
1) ТiO2 + КОН(расплав) = 2) ТiO2+ Na2CO3(расплав) =
3) ТiO2+ H2SO4(конц) = 4) ТiO2+ HF(конц) =
538. Какая масса ванадата аммония, содержащего 25 % примесей, потребуется для получения 9,2 г оксида ванадия (V), какой объем аммиака (н.у.) выделится при этом?
544. При взаимодействии растворов сульфида и метаванадата аммония образуется тиометаванадат аммония. Последний при действии НCl разлагается, образуя соответствующий малорастворимый тиоангидрид. Написать уравнения реакций.
569. Почему хром (III) не образует низкоспиновых комплексов? Для объяснения использовать метод ВС и теорию кристаллического поля.
592. По каким признакам можно определить, в какой среде проходила реакция восстановления KMnO4? Написать уравнения таких реакций. Вычислить молярную массу эквивалента KMnO4 в каждом из этих случаев.
601. Даны окислительно-восстановительные потенциалы полуреакций:
MnO + 4H+
+ 3e–
=MnO2
+ 2H2O;
=
1,69 B;
+ 4H+
+ 3e–
=MnO2
+ 2H2O;
=
1,69 B;
ReO + 4H+
+ 3e–
= ReO2
+ 2H2O;
=
0,51 B;
+ 4H+
+ 3e–
= ReO2
+ 2H2O;
=
0,51 B;
Cl2 + 2e– = 2Cl-; = 1,36 В.
Можно ли окислить MnO2 и ReO2 хлором по схемам:
MnO2 + H2O + Cl2 HMnO4 + HCl;
ReO2 + H2O + Cl2 HReO4 + HCl?
607. Важной операцией для получения металлов является «вскрытие» природных минералов. Написать уравнения «вскрытия» хромистого железняка расплавленной содой в присутствие кислорода воздуха. Сколько соды затрачивается на «вскрытие» тонны этого минерала?
640. Палладий и платина – хорошие катализаторы реакций гидрирования и дегидрирования органических соединений (т. е. присоединения и отщепления водорода). Чем объяснить это их свойство?
658. Какие исходные вещества образуют золотохлористоводородную кислоту Н[AuCl4]? Написать уравнение получения кислоты. Определить тип гибридизации, геометрию, магнитные свойства иона [AuCl4]-.
679. Почему цинк, кадмий и ртуть, являясь d-элементами, не используют в образовании химических связей электронов d-подуровня?
