
- •С.А. Погожих
- •От автора
- •1.Введение
- •1.1. Техника безопасности
- •1.2. Порядок выполнения работ
- •1.3. Правила построения графиков
- •1.4. Вычисление погрешностей
- •1.5. Рекомендуемая литература
- •2. Описания лабораторных работ
- •2.1. Лабораторная работа №1
- •2.2. Лабораторная работа №2 проверка закона шарля
- •2.3. Лабораторная работа № 3 определение плотности воздуха
- •2.4. Лабораторная работа №4
- •2.5. Лабораторная работа №5
- •2.6. Лабораторная работа №6
- •2.7. Лабораторная работа №7
- •2.8. Лабораторная работа № 8
- •Линейное тепловое расширение
- •Объемное тепловое расширение
- •Тепловое расширение с точки зрения молекулярно- кинетической теории
- •2.9. Лабораторная работа №9
- •Определение коэффициента динамической вязкости
- •Определение длины свободного пробега молекул
- •Определение эффективного диаметра молекул
- •Определение коэффициента динамической вязкости
- •Определение длины свободного пробега молекул
- •Определение эффективного диаметра молекул
- •2.10. Лабораторная работа №10
- •2.11. Лабораторная работа №11
- •2.12. Лабораторная работа №12
- •Измерения и обработка их результатов
- •2.13. Лабораторная работа №13
- •2.14. Лабораторная работа №14
- •2.15. Лабораторная работа №15
- •2.16. Лабораторная работа №16
- •Лабораторная работа №17
- •3. Приборы молекулярной физики
- •3.1. Насосы
- •3.2. Манометры
- •3.3. Термометры
- •3.4. Приборы, измеряющие влажность.
- •3.5. Термостат
- •Запрещается включать термостат без воды!!!
- •3.6. Вискозиметр
- •Методика измерения вязкости.
- •3.7. Катетометр
- •Конструкция прибора
- •Работа с катетометром
- •4. Справочние сведения*
2.14. Лабораторная работа №14
ИЗУЧЕНИЕ ИЗМЕНЕНИЯ ЭНТРОПИИ В ИЗОЛИРОВАННОЙ СИСТеме
Цель работы:исследование приращения энтропии в необратимых адиабатных процессах.
Приборы и принадлежности:калориметр с мешалкой, нагреватель, термометр с ценой деления 0.1°С, бачок с водой, мензурка вместимостью 100–150мл, набор из пяти исследуемых образцов: №1 – свинцовый, №2 – медный, №3 – стальной, №4 – алюминиевый, №5 – оловянный; весы технические, набор гирь.
ТЕОРИЯ МЕТОДА И ОПИСАНИЕ ЭКСПЕРИМЕНТАЛЬНОЙ УСТАНОВКИ
Для описания поведения термодинамических систем Клаузиус ввел функцию параметров состояния S, названную им энтропией. Для вычисления изменения энтропииS рассматриваемый процесс делится на достаточно малые участки, в пределах которых температуруТсистемы можно считать постоянной. Элементарное приращение энтропииdSна таком участке приравнивается приведенному количеству теплотыdQ/T, сообщенному при этом системе или отнятому от нее:
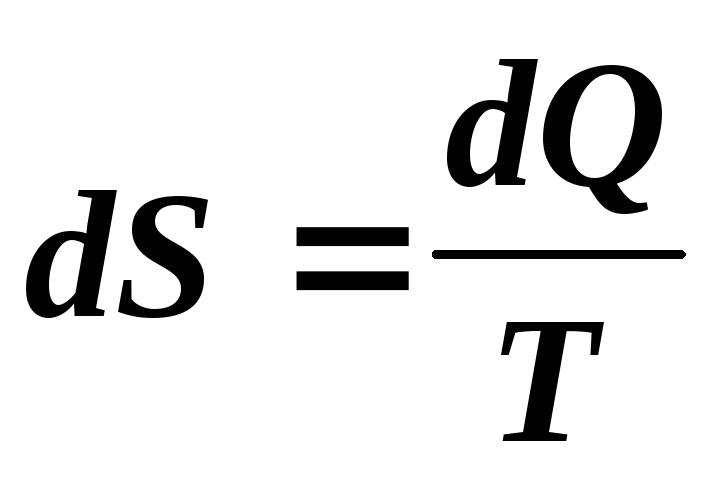 .
.
Полное изменение энтропии в каком–либо процессе вычисляется путем интегрирования ее элементарных приращений dSпо всему процессу от начального состояния 1 до конечного 2:
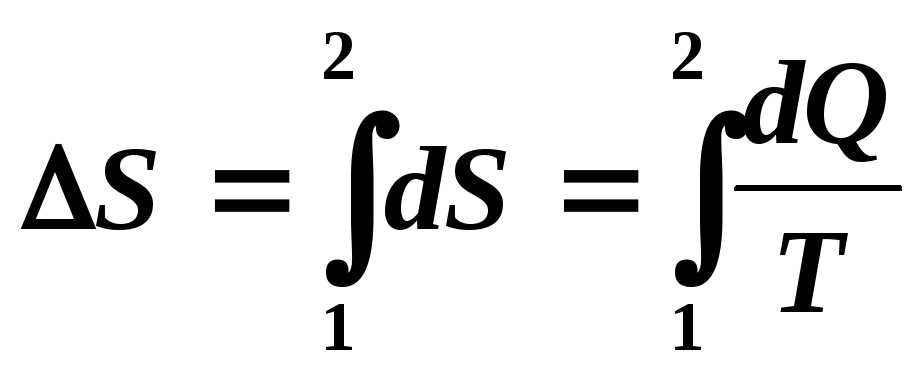 ,
(1)
,
(1)
где dQ –элементарный приток теплоты в систему, Т – термодинамическая температура системы. При вычислениях подынтегральное выражение (1) и пределы интегрирования преобразуют с помощью величин, характеризующих рассматриваемый процесс.
Пользуясь понятием энтропии, основное содержание второго начала термодинамики можно сформулировать следующим образом: любой процесс в изолированной системе подчиняется условию:
S 0 , (2)
где S– изменение энтропии системы, при этом, если процесс обратим, в выражении (2) имеет место знак равенства, если необратим – знак неравенства. Таким образом,Sв изолированной системе может служить мерой необратимости протекающих в ней процессов: чем меньшеS, тем ближе процесс к обратимому.
В данной работе предлагается измерить изменение энтропии изолированной системы, в которой происходит необратимый процесс теплообмена.
Схема экспериментальной установки приведена на рис. 20. Она включает в себя исследуемый образец 1, опущенный посредством пробки 7 в сосуд с водой 3, нагреваемый при помощи электроплитки 2. Теплообмен происходит при перенесении и опускании исследуемых образцов, нагретых до одной и той же температуры Т(температуры кипящей воды по шкале Кельвина), из сосуда 3 в воду, находящуюся в калориметре 4 при температуреТ1. Наличие внешнего стакана калориметра делает систему практически изолированной. В теплообмене участвуют четыре тела:1. Испытуемый образец массойmт , удельной теплоемкостьюcт , и начальной температуройТ = 373К.2. Стакан калориметра массойmк, удельной теплоемкостьюcки начальной температуройТ1.3. Мешалка 6 (рис. 20) массойmм, удельной теплоемкостьюcми начальной температуройТ1.4. Вода, находящаяся в калориметре, имеет массуmв, удельную теплоемкостьcви начальную температуруT1.

Р и с. 20
После теплообмена установится температура Т0. При этом энтропия каждого из тел изменится следующим образом:
для первого тела
 ;
;
для второго тела
 ;
;
для третьего тела
 ;
;
для четвертого тела
 .
.
Учитывая свойство аддитивности энтропии, можно рассчитать изменение энтропии всей системы:
 .
(3)
.
(3)
По этой формуле проводятся расчеты.
ИЗМЕРЕНИЯ И ОБРАБОТКА ИХ РЕЗУЛЬТАТОВ
1.Определите при помощи технических весов массы исследуемых образцов mТ, калориметраmК, мешалкиmМ.
2.Налейте в сосуд 3 наполовину воды и поместите в него исследуемый образец известной массы. Образец на шнуре закрепляется при помощи пробки, вставляемой в крышку сосуда 3.
3.Поставьте сосуд на электрическую плитку и включите ее в сеть.
4.Налейте в стакан калориметра 4 100 млводы, отмерив нужный объем мензуркой.
5.Через 5 минут после того, как вода в нагревателе закипит, измерьте температуру воды Т1в калориметре.
6.Затем быстро перенесите и опустите исследуемый образец в калориметр, закрыв его крышкой. Оставьте его подальше от нагревателя и следите за повышением температуры воды по термометру 5.
7.Когда рост температуры замедлится, сделайте 4–5 перемешиваний при помощи мешалки. Отсчитайте наибольшее значение температуры T0.
8.По измеренным данным, пользуясь формулой (3), найдите изменение энтропии. Теплоемкости калориметра cКи мешалкисМ принять равными 896Дж/(кгК)(алюминий). Результаты измерений и вычислений занесите в таблицу 17.
Таблица 17
|
№ образца |
mТ,кг |
cТ,Дж/(кгК) |
T1, K |
T0, K |
S,Дж/К |
|
1- свинец |
|
130 |
|
|
|
|
2- медь |
|
395 |
|
|
|
|
3- сталь |
|
460 |
|
|
|
|
4- алюминий |
|
896 |
|
|
|
|
5- олово |
|
230 |
|
|
|
9.Вылейте воду из калориметра и дайте ему охладиться. Для ускорения охлаждения можно воспользоваться водой комнатной температуры. Повторите измерения с другими телами (масса воды во всех опытах должна быть одинаковой mВ= 100г.
10.Постройте график зависимости Sот молярной теплоемкости испытуемых телC = сТ,Т, сделайте выводы. Для определения молярной массыТиспытуемых образцов воспользуйтесь периодической системой химических элементов.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Приведите различные формулировки второго начала термодинамики.
2.Дайте определение энтропии. В чем ее статистический смысл?
3.Какие процессы называют обратимыми и необратимыми, равновесными и неравновесными?
4.Энтропию как и энергию называют функцией состояния. Что это значит?
5.Составьте уравнение теплового баланса для исследуемой термодинамической системы, пользуясь экспериментальными данными, полученными по одному из предложенных образцов.
6.Изобразите обратимый цикл Карно в диаграмме T–Sи получите выражение для его термического КПД.
