- •Содержание
- •Введение
- •Взаимодействие браннерита с гидрофторидом аммония
- •10.2.2 Взаимодействие примесей с гидрофторидом аммония
- •2.2 Аппаратурно – технологическая схема процесса
- •2.3 Обоснование выбора основного аппарата
- •3 Расчетный раздел
- •3.1 Определение степени фторирования
- •3.2 Материальный баланс
- •3.2.1 Материальный баланс процесса фторирования (материальный баланс основного аппарата)
- •3.2.2 Материальный баланс процесса растворения
- •3.2.3 Материальный баланс процесса утилизации nh4f
- •3.2.4 Материальный баланс по урану
- •3.3 Тепловая нагрузка аппарата
- •3.4 Конструктивный расчет
- •3.4.1 Определение объема аппарата
- •3.4.2 Определение высоты и диаметра аппарата
- •3.4.3 Определение параметров мешалки
- •3.4.4 Определение диаметра патрубков
- •3.5 Расчет мешалки
- •3.6 Прочностной расчет
- •3.6.1 Исходные данные для прочностного расчета
- •3.6.2 Определение характеристик аппарата
- •3.6.2.6 Коэффициенты прочности сварных швов
- •3.6.2.7 Прибавки к расчетным толщинам конструктивных элементов
- •3.6.3 Расчет элементов аппарата
- •3.6.3.1 Расчет толщины стенки корпуса из условия действия внутреннего давления
- •3.6.3.2 Расчет толщины плоской крышки
- •3.6.3.3 Расчет толщины стенки конического днища
- •3.6.4 Проверка на прочность при гидравлических испытаниях
- •3.7 Подбор фланцев
- •3.8 Подбор опор
- •4 Безопасность и экологичность работы
- •4.1 Производственная безопасность
- •4.1.1Анализ опасных и вредных производственных факторов
- •4.2Мероприятия по защите от опасных и вредных факторов
- •4.3 Организация рациональных условий жизнедеятельности
- •4.4Безопасность в чрезвычайных ситуациях
- •4.4.1Анализ возможных чс
- •Возможные причины пожаров и взрывов
- •4.4.2Мероприятия по предупреждению пожаров и взрывов в конкретных условиях
- •4.5 Экологическая безопасность
- •4.5.1Анализ воздействия разработки на биосферу
- •4.5.2 Мероприятия по защите окружающей среды
- •Заключение
- •Список литературы
3 Расчетный раздел
3.1 Определение степени фторирования
Отношение твердой и жидкой фазы 1:2
Т.е. на 10 г руды идет 20 г БФА 10%. В 20 г 10% БФА содержится 2 г чистого БФА. Отсюда по уравнению реакции получим:
X 2 г
SiO2+3NH4F·HF=(NH4)2SiF6+2H2O+NH3
60 57
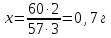
Т.е. 0,7 г SiO2 прореагировало с 2 г БФА.
Отсюда определим степень фторирования:
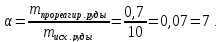
Принимаем степень фторирования α=10%.
3.2 Материальный баланс
3.2.1 Материальный баланс процесса фторирования (материальный баланс основного аппарата)
Материальный расчет основывается на законе сохранения материи, в данном случае - массы веществ, с учетом условий равновесия, определяемых термодинамикой процесса и ею макрокинетикой:
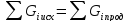
|
где |
|
– |
количества реагентов, поступающих в аппарат в единицу времени или за одну загрузку; |
|
|
|
– |
количества реагентов, удаляемых из аппарата в единицу времени или за одну загрузку. |
Gруды = 700000 т/год = 1917,8 т/сут
Руда поступает в аппарат в виде пульпы. Пройдя стадию измельчения, классификации и сгущения в пульпе находится 50% воды от массы руды.
Определим сколько воды в пульпе:
1917,8 т – 100%
Х – 50%
Отсюда
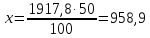
Gразб1 = 958,9 т/сут
В сухой руде CSiO2 = 57,55%. Тогда получим:
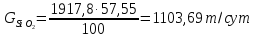
Степень фторирования руды α = 10%. Тогда
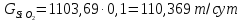
Реакция, протекающая в аппарате:
SiO2 + 3NH4F·HF = (NH4)2SiF6 + 2H2O + NH3
М 60 57 178 18 17
По реакции определим массы всех компонентов.
Определим массовый расход БФА (сухого):
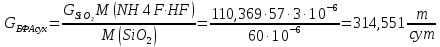
Концентрация БФА СБФА = 10%. Т.к. руда подается с водой и для того, чтобы в аппарате не было слишком много воды, мы приготовим раствор БФА более крепкий, чтоб та вода, которая подается с рудой разбавляла раствор БФА до нужной нам концентрации.
Рассчитаем массу воды необходимая для разбавления БФА до 10%:
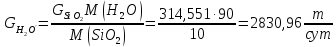
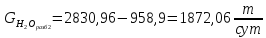
Рассчитаем концентрацию БФА, которую можно получить при разбавлении этой водой:
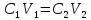
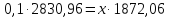
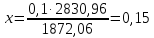
Концентрация БФА СБФА = 15%.
Определим массовый расход ГФСА:
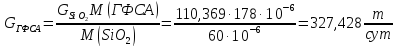
Массовый расход аммиака:
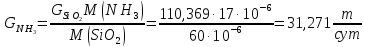
Массовый расход воды (по реакции):
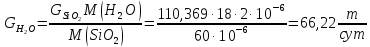
Массовый расход руды после реакции:
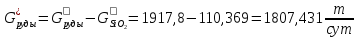
На основании расчета материальных потоков составим таблицу материального баланса (таблица 9).
Таблица 9 – Материальный баланс процесса
|
Приход |
Расход | |||||
|
Статьи прихода |
т/сут |
Статьи расхода |
т/сут | |||
|
Руда |
1917,8 |
Руда* |
1807,431 | |||
|
H2Oразб1 |
958,9 |
H2Oразб1 |
958,9 | |||
|
БФА |
314,551 |
H2Oразб2 |
1872,06 | |||
|
H2Oразб2 |
1872,06 |
ГФСА |
327,428 | |||
|
|
|
NH3 |
31,271 | |||
|
|
|
H2O(реакция) |
66,22 | |||
|
Σ |
5063,311 |
Σ |
5063,311 | |||
Поскольку материальный баланс сошелся, значит, расчеты реакции были произведены, верно.
3.2.2 Материальный баланс процесса растворения
Реакция процесса:
(NH4)2SiF6 + 4NH4OH = SiO2 + 6NH4F + 2H2O
М 178 35 60 37 18
Массовый расход NH4OH (сухого):
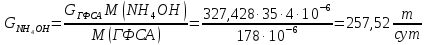
СNH4OH = 25%
Массовый расход воды для разбавления аммиака:
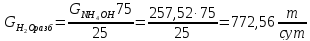
Массовый расход SiO2:
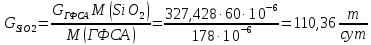
Массовый расход NH4F:
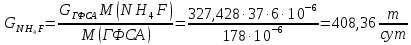
Массовый расход H2O (реакция):

На основании расчета материальных потоков составим таблицу материального баланса (таблица 10).
Таблица 10 – Материальный баланс процесса растворения
|
Приход |
Расход | |||||
|
Статьи прихода |
т/сут |
Статьи расхода |
т/сут | |||
|
ГФСА |
327,428 |
SiO2 |
110,36 | |||
|
NH4OH |
257,52 |
NH4F |
408,36 | |||
|
H2Oразб |
772,56 |
H2O |
66,22 | |||
|
|
|
H2Oразб |
772,56 | |||
|
Σ |
1357,51 |
Σ |
1357,51 | |||
Поскольку материальный баланс сошелся, значит, расчеты реакции были произведены, верно.