
- •Содержание
- •Введение
- •Взаимодействие браннерита с гидрофторидом аммония
- •10.2.2 Взаимодействие примесей с гидрофторидом аммония
- •2.2 Аппаратурно – технологическая схема процесса
- •2.3 Обоснование выбора основного аппарата
- •3 Расчетный раздел
- •3.1 Определение степени фторирования
- •3.2 Материальный баланс
- •3.2.1 Материальный баланс процесса фторирования (материальный баланс основного аппарата)
- •3.2.2 Материальный баланс процесса растворения
- •3.2.3 Материальный баланс процесса утилизации nh4f
- •3.2.4 Материальный баланс по урану
- •3.3 Тепловая нагрузка аппарата
- •3.4 Конструктивный расчет
- •3.4.1 Определение объема аппарата
- •3.4.2 Определение высоты и диаметра аппарата
- •3.4.3 Определение параметров мешалки
- •3.4.4 Определение диаметра патрубков
- •3.5 Расчет мешалки
- •3.6 Прочностной расчет
- •3.6.1 Исходные данные для прочностного расчета
- •3.6.2 Определение характеристик аппарата
- •3.6.2.6 Коэффициенты прочности сварных швов
- •3.6.2.7 Прибавки к расчетным толщинам конструктивных элементов
- •3.6.3 Расчет элементов аппарата
- •3.6.3.1 Расчет толщины стенки корпуса из условия действия внутреннего давления
- •3.6.3.2 Расчет толщины плоской крышки
- •3.6.3.3 Расчет толщины стенки конического днища
- •3.6.4 Проверка на прочность при гидравлических испытаниях
- •3.7 Подбор фланцев
- •3.8 Подбор опор
- •4 Безопасность и экологичность работы
- •4.1 Производственная безопасность
- •4.1.1Анализ опасных и вредных производственных факторов
- •4.2Мероприятия по защите от опасных и вредных факторов
- •4.3 Организация рациональных условий жизнедеятельности
- •4.4Безопасность в чрезвычайных ситуациях
- •4.4.1Анализ возможных чс
- •Возможные причины пожаров и взрывов
- •4.4.2Мероприятия по предупреждению пожаров и взрывов в конкретных условиях
- •4.5 Экологическая безопасность
- •4.5.1Анализ воздействия разработки на биосферу
- •4.5.2 Мероприятия по защите окружающей среды
- •Заключение
- •Список литературы
Содержание
|
|
Введение |
4 |
|
1 |
Аналитический раздел |
5 |
|
|
1.1 Руды и минералы урана |
5 |
|
|
1.2 Запасы урана и его основные месторождения |
8 |
|
|
1.3Выщелачивание урановых руд |
10 |
|
|
1.4Эльконское месторождение и специфика выщелачивания его руд |
13 |
|
|
1.5Примение фторидов аммония для фторирования миенрального сырья |
15 |
|
|
1.6 Свойства гидрофторида аммония |
17 |
|
|
1.7 Взаимодействие гидрофторида аммония с оксидом кремния |
18 |
|
|
1.8Переработка отходов процесса фторирования |
18 |
|
|
1.9Физико-химические основы процесса |
19 |
|
2 |
Технологический раздел |
27 |
|
|
2.1Принципиально-технологическая схема |
27 |
|
|
2.2Аппаратруно-технологическая схема |
29 |
|
|
2.3Обоснование выбора основного аппарата |
31 |
|
3 |
Расчетный раздел |
33 |
|
|
3.1Определние степени фторирования |
33 |
|
|
3.2Материальный баланс |
33 |
|
|
3.3Тепловая нагрузка аппарата |
41 |
|
|
3.4Конструктивный расчет |
46 |
|
|
3.5Расчет мешалки |
53 |
|
|
3.6Прочностной расчет |
57 |
|
|
3.7Подбор фланцев |
65 |
|
|
3.8Подбор опор |
67 |
|
4 |
Безопасность и экологичность работы |
71 |
|
|
Заключение |
82 |
|
|
Список литературы |
83 |
|
|
Приложение А1 – Спецификация агитатор (обязательное) |
84 |
Введение
Целью данной курсовой работы является исследование процесса активации – подготовка к выщелачиванию упорных урансодержащих руд растворами бифторида аммония.
Возрастающая потребность в России в ядерном топливе требует увеличения добычи урана. С связи с этим разрабатываются новые месторождения, такие как Эльконское на юге Якутии. Оно является одним из самых крупнейших месторождений в мире. Но основное количество урана ассоциировано с браннеритом, который практически не растворим в содовых растворах, очень устойчив и трудно растворим в серной кислоте. За счет высокого содержания кварцевого концентрата. Для этого требуется высокая кислотность растворов кислоты, а это достаточно не экономично. Поэтом требуется применение новых эффективных технологий. Например использование фтораммониевой технологии с применением бифторида аммония. Данный реагент приводит к разложению силикатов, с образованием фтораммониевых комплексных солей. А также данный реагент легко регенерируется и возвращается в голову процесса.
Задачами работы является расчет материальных и тепловых потоков, расчет основного аппарата, а также рассмотреть вопросы безопасности и экологичности процесса.
Аналитический раздел
Руды и минералы урана
Уран широко распространен в природе. В довольно значительных концентрациях он обнаружен во многих горных породах, океанах и морях, в лунном грунте, в метеоритах. Почти повсеместное присутствие урана объясняется высокой химической активностью, хорошей растворимостью его солей, способностью принимать участие в разнообразных химических реакциях и образовывать соединения со многими другими элементами. Среднее содержание урана в земной коре составляет (2 – 4)⋅10–4 %, т.е. в 1 тонне содержится около 3 грамм урана. Содержание урана в мантии земли примерно 10–6 %.
Всего в относительно тонком 20-километровом слое земной коры содержится около 1014 т урана. В различных породах земной коры содержание урана неодинаково. Более богаты ураном кислые изверженные породы с высоким содержанием кремнезема SiO2.
В настоящее время известно около 150 минералов, включающих уран как основной компонент, и еще около 50 других минералов, содержащих незначительные количества урана в качестве примесей. Урановые минералы можно разделить на две большие группы – первичные и вторичные. Первичными называются минералы, образовавшиеся при формировании земной коры (как правило, магматического происхождения). Вторичные минералы – те, которые образовались на более поздних стадиях под действием природных факторов.
Таблица 1 – Важнейшие минералы урана
|
Название |
Формула |
Содержание урана, % |
|
Уранинит |
(U,Th)O2x |
62-85 |
|
Настуран |
UO2x |
52-76 |
|
Коффинит |
U(SiO 4 )1-x (OH)4x |
60-70 |
|
Нингиоит |
CaU(PO4)2 ⋅2H2O |
57-65 |
|
Уранофан |
Ca[UO 2(SiO3OH)] 2 ⋅5H2O |
55-58 |
|
Цейнерит |
Ca(UO2 )2(AsO4)2 ⋅12H2O |
55 |
|
Отенит |
Ca(UO2)2 (PO 4)2 ⋅10H2O |
48-54 |
|
Казалит |
Pb[UO2 SiO4]⋅H2O |
42-50 |
|
Браннерит |
(U,TH)Ti2O6 |
35-50 |
|
Урановые черни |
UO2x |
11-53 |
Уран в рудах может входить в состав урановых минералов, но может образовывать значительные скопления в залежах фосфатов, залежах лигнитов (лигнит – каменный уголь низкого качества, промежуточная форма между торфом и бурым углём, структура сохраняет структуру дерева) или монацитовых песков.
Наряду с ураном эти руды содержат золото, которое и является основным объектом промышленной добычи. Кроме золота, из урановых минералов извлекают медь, титан, тантал, ванадий и ряд редкоземельных металлов. 12% мирового выпуска урана приходится на производства, где уран извлекается в качестве побочного продукта.
По условиям образования среди урановых руд различают:
эндогенные руды, отложившиеся при повышенных температурах и давлениях из пегматитовых расплавов и водных (предположительно постмагматических) растворов, характерны для складчатых областей и активизированных платформ;
экзогенные руды, сформировавшиеся в близкоповерхностных условиях и на поверхности Земли в процессе осадконакопления (сингенетические руды) или в результате циркуляции грунтовых вод (эпигенетические руды), связаны преимущественно с молодыми платформами.
По размерам зёрен урановых минералов выделяются:
крупнозернистые урановые руды (свыше 25 мм в поперечнике),
среднезернистые (3–25 мм);
мелкозернистые (0,1–3 мм);
тонкозернистые (0,015–0,1 мм);
дисперсные (менее 0,015 мм).
Размеры агрегатов и зёрен урановых минералов определяют возможность механического обогащения руд.
По химическому составу нерудной составляющей среди урановых руд различают:
силикатные (в основном из силикатных минералов);
карбонатные (более 10–15% карбонатных минералов);
железоокисные, представляющие собой железо-урановые руды;
сульфидные, содержащие более 8–10% сульфидных минералов;
каустобиолитовые, состоящие в основном из органического вещества.
Химический состав руд часто имеет решающее значение при выборе способа их переработки. Так, например, из силикатных руд уран выщелачивается кислотами, из карбонатных – содовыми растворами; железо-окисные руды подвергаются доменной плавке, при которой уран концентрируется в шлаках; каустобиолитовые урановые руды иногда обогащаются путём их сжигания и т.д.
По содержанию урана выделяются 5 сортов руд:
очень богатые руды (свыше 1% урана);
богатые (1–0,5%);
средние (0,5–0,25%);
рядовые (0,25–0,1%);
бедные (менее 0,1%).
В качестве побочного продукта уран извлекается из руд, содержащих 0,01–0,015% урана (например, из золотоносных конгломератов Витватерсранда, ЮАР) и даже 0,006–0,008% (фосфориты Флориды, США).
Основными технологическими характеристиками урановых руд являются:
химический состав нерудной составляющей (вмещающей породы);
«контрастность» руды;
крупность зёрен урановых минералов и их агрегатов.
Химический состав нерудной составляющей играет решающее значение при выборе способа их химической переработки. Из силикатных руд уран выщелачивают кислотами; из карбонатных – содовыми растворами; сульфидные руды предварительно подвергают обжигу; железо-окисные руды подвергают переплавке, а затем уран выщелачивают из шлака и т.д.
Другой важной характеристикой урановых руд является «контрастность» – степень неравномерности содержания урана в кусковой фракции горной массы. По «контрастности» руды подразделяются:
«контрастные» – смесь богатых штуфов, содержащих основную массу урана и породы с низким содержанием урана, содержание урана в штуфах превышает в десятки раз среднее содержание урана во всей горнорудной массе;
«слабоконтрастные» – руды с более или менее равномерным распределением урана по всей горнорудной массе; могут быть руды с небольшим превышением урана в штуфах (в 3 – 5 раз).
«Контрастность» руд играет важную роль при выборе метода их обогащения: «контрастные» руды обогащают исключительно радиометрическим методом; для «слабоконтрастных» руд радиометрический метод обогащения непригоден, их обогащают либо гравитационным, либо флотационным методом.
Размеры зёрен и агрегатов определяют, в основном, степень измельчения руд при их обогащении и гидрометаллургической переработке.
Запасы урана и основные его месторождения в России
Разведанные российские запасы урана оцениваются в 546 тысяч тонн. К сожалению, многие из них находятся в труднодоступных регионах. Самым крупным среди является месторождение Элькон на юге Якутии, его запасы исчисляются 344 тыс. т. Около 150 тыс. т - запасы другого месторождения, известного под названием Стельцовское рудное поле в Читинской области. 70 тыс. т.
Открытый (карьерный) метод в России сейчас не применяется. Шахтный метод используется на месторождениях урана в Читинской области. Более широко используется технология подземного выщелачивания. Добываемые ураносодержащие руды и растворы перерабатываются с целью получения урановых концентратов на месте.
В 2007 в России урановую руду добывала корпорация «ТВЭЛ», включающая три дочерних предприятия: Приаргунское горно-химическое объединение в городе Краснокаменске Читинской области (3 тыс. т/г), ЗАО «Далур» в Курганской области и ОАО «Хиагда» в Бурятии (мощность каждого 1 тыс. тонн урана в год).
В Читинская обл. открыты урановые месторождения Аргунское и Жерловое и Берёзовое.
Расположенное в Читинской области (Забайкалье) Стрельцовское рудное поле - включает в себя более десятка месторождений урана (и молибдена), пригодных под шахтный и карьерный способы добычи. Из них самые крупные – Стрельцовское и Тулендевское – имеют запасы по 60 и 35 тыс. тонн соответственно. В настоящее время добыча ведётся шахтным способом на пяти месторождениях силами двух рудников, что обеспечивает 93% производства российского урана
Общие запасы месторождений урана в Эльконском районе Якутии составляют 346 тыс. тонн, что относит их к одним из крупнейших в мире. Количественно это превосходит все балансовые запасы в стране, но из-за рядового качества руд они могут стать рентабельными только при высокой цене на уран.
Самое крупное из известных потенциальных источников уранового сырья – Алданское месторождение пригодно для разработки только горным, шахтным способом. По мнению геологов, более перспективно освоение Витимского урановорудного района. Витимский район (Сибирь) с разведанными запасами в 60 тыс. т при концентрации урана 0,054% в руде с сопутствующими скандием, редкоземельными элементами и лантаноидами;). Витимский рудный район - включает в себя 5 месторождений, общие запасы которых оцениваются в 75 тыс. т. Наиболее крупными являются: Хъягдинское и Тетрахское. Оба объекта локализованы в палеодолинах, пригодны под способ подземного выщелачивания, особенностью их является расположение в зоне вечной мерзлоты под мощным (до 100 м) чехлом базальтов. Так как в России это самый трудный район для освоения.
Дальневосточный рудоносный район, расположенный в прибрежной зоне Охотского моря пока разведан недостаточно.
К перспективным регионам относится Онежский район (Карелия), где обнаружены запасы ванадиевой руды с содержанием урана, золота и платины. «Невскгеология» проведена разведка уранового месторождения (Средняя Падмы) в районе Ладожского озера вблизи деревни Салми (Медвежьегорский район). Запасы урановой руды здесь возможно достигают 40 тыс. тонн. Месторождение не разрабатывается, главным образом из-за отсутствия технологии переработки данного типа руд. Урановые руды России беднее зарубежных. В эксплуатируемых подземным способом российских месторождениях руды содержат всего 0,18% урана, в то время как на канадских подземных рудниках отрабатываются руды с содержанием урана до 1%. Способом скважинного подземного выщелачивания в России разрабатываются месторождения, руды которых содержат всего 0,04-0,05% урана, тогда как на аналогичных месторождениях Казахстана содержание урана в рудах составляет 0,06-0,08%, и при этом они очень велики по запасам, которые превышают 100 тыс.т урана. В рудах нигерийского месторождения Акута содержание урана достигает 0,43%, в австралийских объектах – в среднем 0,15%.
По годовому производству урана (около 3,3 тыс. т.) Россия занимает 4 место после Казахстана. Годовое же потребление урана в России сейчас составляет 16 тыс. т и складывается из расходов на собственные АЭС в объёме 5,2 тыс. т, а также на экспорт тепловыделяющих средств (5,5 тыс. т) и низкообогащенного урана (6 тыс. т).
Талица 2 – Основные месторождения России
|
Месторождение |
Запасы, тыс.т |
Содержание урана,% |
|
Стрельцовское (Читинская область) |
37,2 |
0,154 |
|
Октябрьское (Читинская область) |
8,9 |
0,194 |
|
Антей (Читинская область) |
11,2 |
0,163 |
|
Мало-Тулукуевское (Читинская область) |
12,6 |
0,192 |
|
Аргунское (Читинская область) |
37,5 |
0,215 |
|
Далматовское (Курганская область) |
8,4 |
0,034 |
|
Хиагдинское (Республика Бурятия) |
11,2 |
0,055 |
|
Южное (Республика Саха(Якутия)) |
257,9 |
0,145 |
|
Северное ( Республика Саха(Якутия)) |
59,6 |
0,149 |
Выщелачивания урановых руд
Выщелачивание – это процесс перевода в раствор одного или нескольких компонентов твердого вещества с помощью водного или органического растворителя, часто в присутствии окислителей и восстановителей.
В гидрометаллургических схемах переработки рудного сырья выщелачивание обычно проводят после измельчения руды и ее обогащения. Иногда перед выщелачиванием руды и концентраты обжигают в окислит. атмосфере (на воздухе) или в присутствии добавок (CaO, CaSO4, H2SO4, сульфатов, хлоридов, фторосиликатов и др.), что способствует вскрытию минералов и переводу их в иные, легкорастворимые химические соединения. Вслед за выщелачиванием проводят разделение жидкой и твердой фаз путем отстаивания, фильтрации и другими методами.
Целью выщелачивания является избирательное растворение минералов урана.
Способы выщелачивания:
Карбонатное (содовое);
Кислотное.
Выбор способа выщелачивания зависит от:
Типа урановых минералов;
Размера урановых минералов;
Состава пустой породы.
Руды урана:
Первичные (4 валентный уран) – используется кислотное выщелачивание с окислителем;
Вторичные (6 валентный уран) – используется как кислотное так и содовое выщелачивание.
Минералы урана:
1 группа (черни, ванадаты, фосфаты, арсенаты) – легко растворяются без окислителя, поэтому используется карбонатный и кислотный способы;
2 группа (уранинит, настуран, различные смолки) – растворяются с добавкой окислителя, используются также оба способа;
3 группа (браннерит, давидит) – являются труднорастворимыми, поэтому используется только кислотное выщелачивание.
Состав пустой породы:
1 тип (нерастворимые: силикатные породы, граниты) – используется оба типа выщелачивания;
2 тип (растворимы в кислых растворах: карбонаты, фосфаты, слюды, биотиты) – используется карбонатный способ;
3 тип (растворимы в карбонатных растворах: сульфиды) – применяют кислотный способ.
Основная масса урана из добываемых руд выщелачивается серной кислотой. Основным недостатком серной кислоты при вскрытии урановых руд является необходимость добавления окислителя. В качестве окислителя можно применять HNO3 , MnO2 , KClO3 и др. Чаще всего в промышленной практике применяют очищенный природный минерал пиролюзит (MnO2).
При выщелачивании урана из руд, содержащих минералы группы уранинита – настурана, серной кислотой в присутствии MnO2 протекает следующая реакция:
U3O8 + 4H2SO4 + MnO2 → 3UO2SO 4 + MnSO4 + 4H2O.
Наряду с простым сульфатом в кислой среде образуются комплексные сульфатные анионы уранила [UO2(SO4)2]2– и [UO2(SO4) 3]4–.
Простой сульфат существует в растворах, при pH>2 . Константа устойчивости простого сульфата К = 50. Дисульфатный комплекс уранила образуется в растворах при рН =1..2. Константа устойчивости этого комплекса К = 350. Трисульфатный комплекс образуется при рН меньше единицы, т.е. в сильнокислых средах.
В процессе выщелачивания урана из кремнистых руд при повышенных температурах примерно 1 % кремнезёма вскрывается серной кислотой с образованием труднофильтрующейся кремневой кислоты, что в значительной степени затрудняет дальнейшую переработку пульп и растворов:
SiO2 + H2SO4 → H2SiO 3 .
Глинозём в количестве 3 – 5 % от исходного количества переходит в раствор в виде хорошо растворимого сульфата алюминия Al2(SO4)3:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O.
Железо в рудах может содержаться в виде оксидов или карбонатов. Из оксидов железа в серной кислоте легко растворяется Fe2O3 , труднее Fe3O4 . Карбонат железа FeCO3 легко растворяется. В присутствии окислителя двухвалентное железо окисляется до трёхвалентного:
2FeSO4 + 2H2SO4 + MnO2 → Fe2(SO4)3 + MnSO4 + 2H2O.
Таким образом, в пульпе железо будет присутствовать в виде Fe2(SO4)3 . Растворимость Fe2(SO4)3 вследствие гидролиза ограничена. В горячей воде растворимость не превышает 5 – 7 г/л, поэтому при большем содержании железа оно будет выпадать в осадок в виде Fe(OH)3:
Fe2(SO4)3 + 3H2O → 2Fe(OH)3 ↓ + 3H2SO4 .
При выщелачивании других типов руд (фосфатных, ванадатных) фосфор, ванадий и другие элементы количественно переходят в раствор.
Эльконское месторождение и специфика выщелачивания его руд
Одним из крупнейших резервных месторождений урана в России является Эльконский ураново-рудный район, расположенный на юге Якутии. Разведанные запасы урана в данном районе более 346 тыс.т. (прогнозные более 600 тыс.т.), кроме того в рудах содержится золото (около 200 т.), серебро (2,5 тыс.т.) и молибден (90 тыс.т.).
Основное количество урана ассоциировано с браннеритом, трудность его переработки с особым минералогическим составом. Руды не менее чем на 60% сложены очень мелким минералом, обычно не характерным для урановых руд, – полевым шпатом. В этом полевошпатовом агрегате рассеяны мелкие скрытокристаллические черные выделения золотоносного сульфида железа – пирита, придающего руде темный цвет. В том же агрегате полевого шпата и золотоносного пирита присутствуют карбонаты (кальцит и др.). Более крупное золото в рудных зонах Эльконского горста практически отсутствует, поэтому на реках не образовались золотоносные россыпи. Урансодержащий минерал – браннерит – практически не растворим в содовых растворах, очень устойчив и трудно растворим в серной кислоте. а Поэтому для его кислотного выщелачивания требуется весьма высокая кислотность растворов. А это весьма не экономично. Следовательно извлечение урана и золота из Эльконского месторождения требует применения новых эффективных и экологичных технологий.
Таблица 3 – Минералогический состав пробы руды
|
Минерал |
Содержание, % |
|
Калиевые полевые шпаты |
37,87 |
|
Кварц |
22,27 |
|
Плагиоклаз |
10,2 |
|
Карбонаты |
8,57 |
|
Амфиболы, пироксены |
4,0 |
|
Биотит, хлорит |
3,0 |
|
Серицит, гидрослюды |
5,0 |
|
Барит |
0,6 |
|
Апатит |
0,52 |
|
Флюорит |
1,22 |
|
Пирит, марказит |
3,13 |
|
Магнетит, гидроксиды железа |
2,27 |
|
Минералы Ti |
1,1 |
|
Минералы U |
0,15 |
Таблица 4 – Химический состав исследуемой пробы руды
|
Элемент |
Содержание, % |
Элемент |
Содержание, % |
|
SiO2 |
57,55 |
Na2O |
1,08 |
|
TiO2 |
1,5 |
K2O |
7,03 |
|
Al2O3 |
12,12 |
CaCO3 |
7,65 |
|
Fe2O3 |
4,34 |
CaF2 |
1,22 |
|
FeO |
1,14 |
U |
0,115 |
|
MnO |
0,03 |
Au, г/т |
0,76 |
|
CaO |
5,16 |
Mo |
<0,002 |
|
MgO |
1,8 |
Sобщ |
2,07 |
|
P2O5 |
0,22 |
SO4 |
0,15 |
Браннерит - хрупкий материал с сильным смолистым блеском и раковистым изломом. Цвет его, в зависимости от степени изменения, варьирует от черного и коричневого разных оттенков до медово-желтого.
Отличительной особенностью месторождения браннеритовых руд является то, что в результате последующих галогенных процессов и брекчирования, в том числе - образования поздних карбонатных брекчий, имело место интенсивное разложение браннерита с выносом основных составляющих его компонентов (урана и титана).
Внешне в процессе окисления браннерит теряет черную окраску. Вначале он становится менее плотным, постепенно теряет свой характерный, жирный блеск, меняет показатель преломления. Химические анализы браннеритов и продуктов его изменения (Белова,1964) показывают, что в процессе окисления четырехвалентный уран, характерный для не окисленного браннерита, превращается в шестивалентный, отношение же Uк Тiдо определенного момента остается более или менее постоянным, т.е. минерал, видимо, не распадается; затем уран начинает выноситься энергичнее, а вынос титана замедляется.
По данным электронномикроскопического исследования браннерит в процессе окисления претерпевает сложные превращения, следствием которых является образование новых кристаллических фаз. На ранних стадиях изменения образуются продукты естественной раскристаллизации метамиктного браннерита - рутил (Тi02) и фазаUO2 (тонкодисперсный уранинит), а также фаза "X" (U+6Ti2O7).
Интенсивно измененный браннерит - медово-желтый - сложен реликтовыми кристаллами браннерита, аморфным веществом с реликтами кристалловUO2и включениямиTiO2в виде анатаза. Конечные продукты изменения браннерита - охристые, желто-окрашенные руды - состоят в основном из анатаза с тонкодисперсно рассеянным по его поверхности ураном, минеральную форму нахождения которого установить не удалось.
Вышеописанные изменения связаны с окислением браннерита, в основном, в процессе наложения на него карбонатных брекчий. В случае развития по браннериту метасоматического рисовидного кварца, минерал, интенсивно разрушаясь, остается в массе кварца в виде реликтов. Местами окварцевание сопровождается переотложением браннерита с образованием призматических удлиненных кристаллов типа щеток, растущих на колломорфных выделениях браннерита.
Применение фторидов аммония для фторирования минерального сырья
Исследования фторирования минерального сырья фторидами аммония проводятся уже несколько лет. Установлено, что NH4F·HFимеет преимущество по сравнению с другими фторирующими реагентами (HF,FeF3) по причине проведения процесса фторирования при более низких температурах и относительно легкой его регенерации. При перемешивании исходных реагентов в условиях комнатной температуры происходит частичное (до 40%) разложение силикатов, а также активирование оставшейся части, которое облегчает дальнейшее завершение процесса разложения за счет высушивания смеси при температуре 110˚С.
Основным видом минерального сырья является кварцевый концентрат, большую часть которого составляет диоксид кремния SiO2(кварц, кремнезем). В концентрате также содержится до 1 – 2 % примесей, основными которыми являются:Al2O3, Fe2O3, TiO2,Na2O,K2Oи другие.
Фторирование кварцевого концентрата гидродифторидом аммония осуществляется по ниже приведенным реакциям:
SiO2 + 3NH4F·HF = (NH4)2SiF6 + 2H2O + NH3;
Al2O3 + 6NH4F·HF = 2(NH4)3AlF6 + 3H2O;
Fe2O3 + 6NH4F·HF = 2(NH4)3FeF6 + 3H2O;
TiO2 + 3NH4F·HF = (NH4)2TiF6 + 2H2O + NH3;
Na2O + NH4F·HF = 2NaF + H2O + NH3;
K2O + NH4F·HF = 2KF + H2O + NH3.
Возможно протекание реакций пирогидролиза и термического разложения:
2(NH4)3AlF6 + 3H2O = Al2O3 +6NH3 + 12HF;
2(NH4)3FeF6 + 3H2O = Fe2O3 +6NH3 + 12HF;
(NH4)3AlF6 = AlF3 + 3NH4F;
(NH4)3FeF6 = FeF3 +3NH4F.
Фторирование кварцевого концентрата гидродифторидом аммония термодинамически возможно во всем интервале температур и начинается уже при стандартных условиях.
Разделение концентрата на SiO2иAl2O3является основой фтораммонийной технологии. В основе способа разделения лежит свойствоNH4F·HFобразовывать с оксидами металлов и кварцем комплексные фтораммониевые соли с различной летучестью и термической устойчивостью, что обеспечивает глубокое разделение и очистку компонентов .
Установлено, что полное взаимодействие реагентов имеет место при мольном соотношении SiO2:NH4F·HF= 1 : 3,5. В процессе фторирования образуются пары воды, аммиак, гексафторосиликат аммония (NH4)2SiF6, и ряд других фторсодержащих газов.
Таким образом, гидрофторид аммония является эффективным реагентом для фторирования минерального кварцсодержащего сырья, и может использоваться для удаления избыточного содержания кварца в виде (NH4)2SiF6.
Свойства гидрофторида аммония
NH4HF2 – бесцветное, не имеющее запаха кристаллическое вещество. Он образует ромбическую кристаллическую решетку, по структуре близкая к гидрофторидам щелочных металлов. Но группы NH4+ связаны с атомом фтора водородными связями. Причем каждый атом фтора образует две водородные связи с атомом азота и одну с другим атомом фтора.
NH4HF2 хорошо растворим в воде, безводном HF и фтористоводородной кислоте. В органических растворителях растворимость гидрофторида гораздо ниже, чем в воде, поэтому многими из них он может высаливаться из водных растворов.
Температура плавления NH4HF2 126,45оС, температура кипения близка к 240оС. Стандартная энтальпия образования кристаллического NH4HF2 равна -800,3 или -801,9 кДж/моль, теплоемкость 106,7 Дж/(моль·К), энтропия 115,5 Дж/(моль∙К).
Химические реакции, характерные для NH4HF2, подразделяются на две группы: реакции присоединения и реакции фторирования. В реакциях присоединения NH4HF2 отдает либо NH4F (эти реакции специфичны для NH4F), либо HF (такие реакции специфичны для HF):
mNH4F·HF + MeFn = (NH4)nMeFn+m + mHF
NH4F·HF + MeF = MeHF2 + NH3.
Однако более характерными являются реакции фторирования.
Расплавленный NH4HF2 – более энергичный фторирующий реагент, чем газообразный HF. Это подтверждается более глубоким фторированием и большей скоростью в случае NH4HF2. При использовании HF многие процессы можно остановить на стадии образования оксифторидов: таким путем из оксидов получают оксифториды Ti, Nb, Ta. В случае NH4HF2 можно легко миновать стадию образования оксифторидов. При небольшом избытке реагента оксиды металлов I-IV групп превращаются во фторометаллаты, а граница между соединениями с полностью и частично замещенными атомами кислорода проходит по переходным металлам V группы. Гидрофторид аммония является довольно сильным фторирующим агентом по отношению к оксидам многих переходных элементов, поэтому его рекомендуют использовать для фторирования редких земель, соединений актиноидов и лантаноидов. Фторирование большинства соединений чаще всего приводит к образованию двойных соединений. Чем ниже температура фторирования, тем больше содержание NH4F в образующемся фторометаллате. В случае элементов со степенью окисления 2+ это (NH4)2MеF4 или NH4MеF3. При фторировании оксидов легких актиноидов и церия в состоянии окисления 4+ могут образовываться (NH4)4MеF8.
Взаимодействие гидрофторида аммония с оксидом кремния
Взаимодействие кварца и гидрофторида аммония приводит к образованию гексафторосиликата аммония. Данное взаимодействие протекает в две стадии с образованием первоначально гептафторосиликата аммония и последующим его разложением до гексафторосиликата.
(NH4)3SiF7 = (NH4)2SiF6 + HF + NH3
Механизм взаимодействия кварца с бифторидом аммония можно представить следующим образом:
SiO2
+ NH4F∙HF
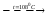 (NH4)3SiF7
(NH4)3SiF7
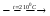 (NH4)2SiF6
(NH4)2SiF6
Переработка отходов процесса фторирования
Фторирование руды протекает по реакции:
SiO2 + 3NH4F·HF = (NH4)2SiF6 + 2H2O + NH3
Отходами будут являться раствор ГФСА и газообразный аммиак и H2O.
Избыточное содержание кварца в концентрате удаляется в виде ГФСА.
Утилизация этих продуктов осуществляется следующими методами:
Абсорбция аммиака (поглощение водой);
Растворение ГФСА в растворе аммиака с получением фторида аммония.
При взаимодействии ГФСА с раствором аммиака, степень превращение ГФСА в SiO2достигает 95% уже при концентрации 5%. При увеличении концентрации аммиака скорость процесса растет и при концентрации 20% и выше реакция будет протекать практически мгновенно и ГФСА полностью превратится вSiO2за несколько секунд.
Полученный фторид аммония можно отправить на выпаривание с получение БФА(стадия регенерации БФА) или на утилизацию, путем перевода в твердое состояние.
Перевод в твердое состояние осуществляется при нагревании фторида аммония с гидроксидами или хлоридами:
NH4F + Ca(OH)2 = NH3 + H2O + CaF2;
NH4F + Al(OH)3 = NH3 + H2O + AlF3;
NH4F + NaOH = NH3 + H2O + NaF3;
NH4F+CaCl2= 2NH4Cl+CaF2.
В результате получаются осадки фторида, которые можно отправить на захоронение.
Физико-химические основы процесса
Термодинамические расчеты основных реакций
При фторировании исходной руды бифторидом аммония возможно взаимодействие как непосредственно браннерита, так и основных компонентов руды и примесей. Рассчитаем термодинамику возможных реакций, для упрощения расчетов принимая, что теплоемкость веществ остается постоянной во всем диапазоне температур 298-373 К. Термодинамические расчеты осложняются тем, что для ряда веществ отсутствуют (либо приводятся лишь приблизительные) термодинамические характеристики.
Расчет термодинамики химических реакций проводился по следствию из закона Гесса.
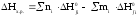 ;
;
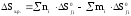

где
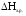 – стандартная энтальпия образования
веществ
– стандартная энтальпия образования
веществ
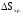 – стандартная энтропия образования
веществ
– стандартная энтропия образования
веществ
 – энергия Гиббса
– энергия Гиббса
Термодинамические расчеты представлены в таблице 5.
Таблица 5– Возможные реакции взаимодействия основных компонентов руды с БФА
|
№ реак-ции |
Исх в-во |
Возможная реакция |
Продукты (тв) |
Продукты (р-р) |
|
1 |
SiO2 |
SiO2 + 3NH4F·HF = (NH4)2SiF6 + 2H2O + NH3↑ |
|
(NH4)2SiF6 |
|
2 |
SiO2 |
SiO2 + 3,5NH4F∙HF = (NH4)3SiF7 + 2H2O + 0,5NH3↑ |
|
(NH4)3SiF7 |
|
|
|
(NH4)3SiF7 = (NH4)2SiF6 + HF + NH3↑ |
|
|
|
3 |
Al2O3 |
Al2O3 + 6 NH4F·HF = 2(NH4)3AlF6 + 3H2O |
|
|
|
4 |
CaO |
CaO + NH4F·HF = CaF2 + H2O + NH3↑ |
CaF2 |
|
|
5 |
TiO2 |
TiO2 + 3NH4F·HF = (NH4)2TiF6 + 2H2O + NH3↑ |
|
(NH4)2TiF6 |
|
|
|
TiO2 + 4NH4F·HF = TiF4 + 2H2O + 4NH4F |
|
|
|
|
|
TiF4 +2NH4F·HF = (NH4)2TiF6 + 2HF |
|
|
|
6 |
Fe2O3 |
Fe2O3 + 3NH4F·HF = (NH4)3FeF6 + 3H2O |
|
(NH4)3FeF6 |
|
7 |
FeO |
FeO + NH4F·HF = FeF2 + H2O + NH3↑ |
FeF2 |
|
|
8 |
CuO |
CuO + NH4F·HF = CuF2 + H2O + NH3↑ |
CuF2 |
|
|
9 |
Y2O3 |
Y2O3 + 6NH4F·HF = 2YF3 + 3H2O + 6NH4F |
YF3 |
|
|
|
|
YF3 + nNH4F·HF = YF3∙nNH4F + nHF |
|
|
|
|
|
YF3 + nNH4F = YF3∙nNH4F |
|
|
|
10 |
Ce2O3 |
Ce2O3 + 6NH4F·HF = 2 CeF3+ 3H2O + 6NH4F |
CeF3 |
|
|
|
|
CeF3 + nNH4F·HF = CeF3∙nNH4F + nHF |
|
|
|
|
|
CeF3 + nNH4F = CeF3∙nNH4F |
|
|
|
11 |
MoS2 |
MoS2 + 4NH4F·HF = MoF4 + 2H2S + 4NH4F |
|
|
|
12 |
MnO |
MnO + NH4F·HF = MnF2 + H2O + NH3↑ |
MnF2 |
MnF2 |
|
13 |
MgO |
MgO + NH4F·HF = MgF2 + H2O + NH3↑ |
MgF2 |
|
|
14 |
Na2O |
Na2O + NH4F·HF = 2NaF + H2O + NH3↑ |
|
NaF |
|
15 |
К2O |
К2O + NH4F·HF = 2КF + H2O + NH3↑ |
|
КF |
|
16 |
CaCO3 |
CaCO3 + NH4F·HF = CaF2 + CO2 + H2O + NH3↑ |
CaF2 |
|
Таблица 6 – Результаты термодинамических расчетов
|
№ реакции |
∆H0298, кДж |
∆G0298, кДж |
∆G 373, кДж |
|
1 |
-104,4 |
-34,4 |
-69,3 |
|
2 |
-33,6 |
-77,1 |
-88,0 |
|
3 |
-489,9 |
-481,6 |
-477,3 |
|
4 |
-119,0 |
-201,1 |
-172,3 |
|
5 |
-128,2 |
58,7 |
41,2 |
|
6 |
-279,3 |
-287,6 |
-289,7 |
|
7 |
18,68 |
-22,84 |
-40,61 |
|
8 |
81,18 |
38,23 |
19,87 |
|
9 |
-393,57 |
-390,45 |
-395,0 |
|
10 |
-430,73 |
-419,23 |
-422,39 |
|
11 |
425,88 |
345,99 |
317,3 |
|
12 |
-5,48 |
-47,76 |
-65,87 |
|
13 |
58,39 |
-100,1 |
-117,09 |
|
14 |
-268,55 |
309,35 |
326,95 |
|
15 |
-311,13 |
354,73 |
373,31 |
|
16 |
49,37 |
36,0 |
-69,88 |
Взаимодействие оксидов урана с бифторидом аммония, наиболее вероятно, протекает по следующим реакциям:
Таблица 7 – Возможные реакции взаимодействия соединений урана с БФА
|
№ реак-ции |
Исх в-во |
Возможная реакция |
Продукты (тв) |
Продукты (р-р) |
|
17 |
UO2 |
UO2 + 4NH4F·HF = UF4 + 4NH4F + 2H2O |
UF4 |
|
|
18 |
UO3 |
UO3 + 2NH4F·HF = UO2F2 + 2NH4F + H2O |
|
UO2F2 |
|
19 |
U3O8 |
U3O8 + 8NH4F·HF = UF4 + 2UO2F2 + 4H2O + 8NH4F |
UF4 |
UO2F2 |
|
|
|
UF4 + NH4F = (NH4)UF5 |
(NH4)UF5 |
|
|
|
|
UO2F2 + 3NH4F = (NH4)3UO2F5. |
|
|
Таблица 8 – Результаты термодинамических расчетов
|
№ реакции |
17 |
18 |
19 |
|
∆H0298, кДж |
- 79,224 |
-51,549 |
-139,82 |
|
∆G 298, кДж |
-76,87 |
-51,05 |
-133,33 |
|
∆G 373, кДж |
-81,01 |
-53,28 |
-140,3 |
