
- •«Томский политехнический университет»
- •2 ВВЕДЕНИЕ
- •1.8. Произведение растворимости
- •Сильные электролиты диссоциируют полностью, поэтому константы диссоциации сильных электролитов бесконечно велики и в справочной литературе они не приводятся.
- •Электролит
- •Карбонат бария (ПР = 5,1·10–9) более растворим, чем сульфат бария (ПР = 1,1·10–10), поэтому равновесие этой реакции смещено в правую сторону.
- •Вычисляем константу равновесия этой реакции:
- •Растворитель
- •1. ПРАВИЛА РАБОТЫ И ТЕХНИКА БЕЗОПАСНОСТИ
- •1.1. Общие правила работы в химических лабораториях
- •1.2. Правила техники безопасности
- •Происшествие
- •Первая помощь
- •ОЖОГИ
- •ОТРАВЛЕНИЯ
- •Отравление газами
- •Правила работы на рН-метре
- •Правила работы на кондуктометре
- •3. ОБРАБОТКА РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА
- •3.4. Оформление отчета
- •Порядок выполнения опыта
- •Масса, г
- •Концентрация приготовленного раствора
- •соли
- •Порядок выполнения опыта
- •Порядок выполнения опыта
- •Порядок выполнения опыта
- •Порядок выполнения опыта
- •Порядок выполнения опыта
- •Порядок выполнения опыта
- •Порядок выполнения опыта
- •Порядок выполнения опыта
- •Порядок выполнения опыта
- •Порядок выполнения опыта
- •Порядок выполнения опыта
- •В пробирку поместите микрошпатель сухой соли NH4Cl и 2–3 капли однонормального раствора гидроксида натрия. Для ускорения реакции подогрейте раствор. Что наблюдаете в растворе? Составьте уравнение реакции в ионном и молекулярном виде.
- •6.2. Получение малорастворимых веществ
- •Порядок выполнения опыта
- •Лабораторная работа 3
- •Порядок выполнения опыта
- •Исследуемый
- •откуда
- •где λ∞ – табличная величина при 291 К или 298 К.
- •Зная степень электролитической диссоциации, вычисляют константу диссоциации вещества по известному уравнению:
- •Порядок выполнения опыта
- •моль/л
- •Исследуемый раствор
- •Дистиллированная вода
- •Глава 2. Растворы неэлектролитов
- •Глава 3. Растворы электролитов
- •Глава 6. Гидролиз
- •Приготовление раствора хлорида аммония
- •1. Почему дистиллированная вода не проводит электрический ток, а водопроводная проводит?
- •Элемент
- •KClO4
- •KClO3
- •KMnO4
- •CaCl2
- •MgCl2
- •MgSO4
- •MnCl2
- •MnSO4
- •CuCl2
- •CuSO4
- •NaOH
- •NaCl
- •NaBr
- •NaNO3
- •NaClO4
- •NaClO3
- •NiCl2
- •NiSO4
- •HgCl2
- •AgNO3
- •HClO4
- •ZnCl2
- •ZnSO4
- •Хлор
- •HCNO
- •Ионная сила раствора J
- •СПИСОК ЛИТЕРАТУРЫ
- •ТЕОРЕТИЧЕСКИЙ РАЗДЕЛ
- •ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Порядок выполнения опыта
1. Налейте в одну пробирку (на 1/3 её объема) раствор щелочи для титрования, в другую – такой же объем приготовленного в опыте 2 раствора NH4Cl. В обе пробирки внесите по 2 капли индикатора фенолфталеина. Отметьте цвет индикатора в кислой и щелочной среде. Объясните, почему раствор хлорида аммония имеет кислую среду. Напишите уравнение реакции гидролиза хлорида аммония.
2. Подготовьте к работе мерную бюретку, закрепленную в штативе. Для этого заполните ее 0,1 н. раствором щелочи.
3. В три конических колбы мерной пипеткой внесите по 10 мл приготовленного раствора хлорида аммония. Пипетку предварительно ополосните исследуемым раствором.
4. Добавьте в колбы с исследуемыми растворами по 2 капли индикатора фенолфталеина.
5. Из бюретки небольшими порциями (по 0,5 мл) приливайте рабочий раствор щелочи в колбу с NH4Cl до появления окраски индикатора. Раствор во время опыта следует все время перемешивать. Как только появится малиновое окрашивание индикатора, добавление щелочи следует прекратить.
6. Запишите объем щелочи, израсходованный на титрование.
7. Повторите титрование еще 2 раза. Каждый опыт начинайте, устанавливая нулевой уровень рабочего раствора щелочи в бюретке. Для получения более точных результатов последние порции (0,5–0,7 мл) щелочи из бюретки прибавляйте по каплям. Появление окраски индикатора от одной капли щелочи является показателем конца реакции. Результаты титрования не должны отличаться друг от друга более чем на 0,1 мл. Если результаты отличаются более чем на 0,1 мл, проведите дополнительные опыты. Данные опыта запишите в таблицу:
№ |
Объем раствора |
Объем щелочи, из- |
Cреднее значение |
опыта |
NH4Cl, мл |
расходованный на |
объема щелочи, мл |
|
|
титрование, мл |
|
1. |
|
|
|
2. |
|
|
|
3. |
|
|
|
8. Вычислите молярную концентрацию эквивалента раствора хлорида аммония по закону эквивалентов для растворов:
Сэк(NH4Cl) V(NH4Cl) = Сэк(щелочи) V(щелочи),
где V – объем раствора, Сэк – молярная концентрация эквивалента рабочего раствора щёлочи.
125
9. Определите погрешность приготовления раствора по формуле:
ηотн = |
|
Сэк (NH 4 Cl)опытн. −Сэк (NH 4 Cl)задан. |
|
100 |
(%) |
|
|
||||
|
|
|
|||
|
Сэк (NH 4 Cl) |
|
|||
|
|
|
|
|
Сделайте вывод о возможных причинах погрешности приготовления раствора.
10. Аналогично п. 1–10 установите точную концентрацию раствора NH4Cl, приготовленного в опыте 2 (п. 5), используя для титрования 0,01 н. раствор щелочи. Результаты запишите и обработайте аналогично.
Опыт 4. Определение водородного показателя раствора
4.1. Определение с помощью индикаторной бумаги
Порядок выполнения опыта
1.Пипеткой перенесите 2–3 капли раствора NH4Cl, приготовленного в опыте 1, на универсальную индикаторную бумагу.
2.Быстро сравните окраску еще мокрого пятна на индикаторной бумаге с цветной шкалой и выберите на ней оттенок, наиболее близкий к цвету полученного пятна. Сделайте вывод о значении рН исследуемого раствора и укажите реакцию среды.
3.Согласно предварительному измерению выберите индикаторную бумагу для более узкого интервала рН. Повторите измерение рН с использованием другой индикаторной бумаги.
4.Сделайте вывод об уточненном значении рН исследуемого рас-
твора.
4.2.Определение с помощью рН-метра
Проведите измерение водородного показателя раствора, приготовленного в опыте 1. (Описание прибора и методика работы изложены в разделе «Измерительные приборы и некоторые операции химической лабораторной практики»). Запишите результат измерения.
Опыт 5. Гидролиз хлорида аммония
Как известно (теор. разд., гл. 6), гидролизом называются обменные химические реакции, протекающие с участием воды. Признаком гидролиза является изменение нейтральной среды раствора на кислую или щелочную.
126

Реакцию гидролиза хлорида аммония будем изучать, измеряя водородный показатель его растворов с помощью визуального колориметрирования и рН-метра.
5.1. Влияние разбавления раствора на степень гидролиза соли.
Определение константы и степени гидролиза
Порядок выполнения опыта
1.Определите рН приготовленных в опыте 2 растворов хлорида аммония с помощью рН-метра. Запишите экспериментально найденные значения рН растворов.
2.По результатам измерения рН вычислите значения константы
гидролиза Kг растворов, исходя из следующих соображений. Гидролиз хлорида аммония протекает по уравнению:
NH4+ + Н2О ' NН4OH + Н+
Состояние равновесия реакции гидролиза описывается константой гидролиза Кг:
ΚΓ = |
[NH 4OH ] [H + ] |
|
|
[NH 4 |
+ ] |
. |
|
В числителе и знаменателе этого выражения используются равновесные молярные концентрации. Из уравнения гидролиза видно, что равновесные концентрации ионов NH4OH и H+ равны. Вследствие практически полной диссоциации соли в растворе при небольших значениях степени гидролиза равновесная концентрация иона NH4+ мало отличает-
ся от начальной и можно принять, что [NH4+]равн = С. Тогда для расчета константы гидролиза можно использовать выражение:
ΚΓ = [HС+ ]2 ,
где [H+] – равновесная концентрация H+-ионов в растворе; С – молярная концентрация хлорида аммония.
Зная рН водных растворов NH4Cl, рассчитайте концентрацию ионов Н+ по формуле
рН = –lg[H+] .
Используя найденные в опыте три значения концентраций растворов хлорида аммония и вычисленные значения рН растворов, определите значения константы гидролиза в исследуемых растворах NH4Cl.
127
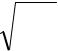
Степень гидролиза αг связана с константой гидролиза и молярной концентрацией раствора С по закону разбавления Оствальда:
αг = |
Κ Γ |
. |
С |
Вычислите по этой формуле степень гидролиза хлорида аммония в исследуемых растворах. Сделайте вывод о влиянии концентрации соли (разбавления раствора) на значение константы и степени гидролиза NH4Cl при неизменной температуре. Сравните вычисленные экспериментальные значения константы и степени гидролиза NH4Cl с теоретическим значением. Теоретическое значение определяется по формуле
Кг = Кw /Кд,
вкоторой Кд – константа диссоциации NH4OH при 25 0С (1,8·10-5).
5.2.Влияние температуры на степень гидролиза
Порядок выполнения опыта
1.Налейте в пробирку исследуемый раствор, приготовленный в опыте 1, и проведите измерение рН раствора с помощью индикаторной бумаги (как описано в опыте 4.1).
2.Нагрейте раствор до кипения и повторите измерение рН горячего раствора. Сравните результаты измерения рН раствора до и после нагревания. В каком направлении смещается равновесие гидролиза?
3.Охладите раствор до комнатной температуры. Измерьте рН охлажденного раствора. Происходит ли снова смещение равновесия гидролиза? Сделайте вывод о влиянии температуры на степень гидролиза.
Исследуемый раствор из пробирки вылейте в раковину.
5.3. Влияние состава солей на степень гидролиза
Порядок выполнения опыта
1.Для исследования используйте раствор хлорида аммония, приготовленный в опыте 1, и однонормальные растворы NH4СH3COO и NaCl.
2.Проведите измерение рН раствора NaCl с помощью рН-метра и
запишите результат опыта. Сравните значения рН растворов NH4Cl (опыт 4.2) и NaCl. Какой раствор подвергается гидролизу и почему? Напишите ионное и молекулярное уравнения реакции гидролиза соли.
3.Проведите измерения рН водного раствора NH4СH3COO с помощью рН-метра. Сравните значения рН растворов NH4Cl (опыт 4.2) и NH4CH3COO. Напишите уравнения реакций гидролиза солей. Рассчи-
128
