
Лекции_1_курс
.pdf
замечательным свойством обладает средняя кинетическая энергия поступательного движения молекул. Поэтому, в
качестве мерила температуры выбирается эта величина. Принято,
температурой считать 23 от этой величины:
T = 23  mV2 2
mV2 2  = 13
= 13 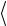 mV 2
mV 2 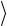 ,
,
здесь m - масса молекулы, V - скорость молекулы, угловые скобки обозначают усреднение по всем энергиям частиц в некоторый фиксированный момент времени, или усреднение по времени для одной частицы, что эквивалентно.
В соответствии с таким определением температура имеет размерность энергии. Однако, такая единица измерений неудобна. Кроме того, для измерения температуры нужно было бы измерять непосредственно среднюю кинетическую энергию молекул, что весьма затруднительно. Поэтому, за единицу температуры формально выбирают одну сотую часть разности между температурами кипения и замерзания чистой воды при атмосферном давлении. Отношение между эргом и этой единицей дает постоянная Больцмана
k =1,38 10−16 градэрг .
Таким образом, если выражать температуру в градусах, то
kT = 13  mV 2
mV 2  .
.
В молекулярной и атомной физике часто используют единицу «электрон Вольт». 1эВ соответствует энергии, которую приобретает электрон, проходя ускоряющую его разность потенциалов в 1В. 1 эВ = 11600 оК.
Так как кинетическая энергия величина не отрицательная, то и температура, в соответствии с определением, не может быть
111

отрицательной. Определенная таким образом температура называется абсолютной. При T = 0 всякое движение молекул прекращается. Шкала абсолютных температур называется шкалой Кельвина. Градусы в этой шкале обозначаются как градусы
Кельвина (0 K ). Более часто на практике используют шкалу
Цельсия. За ноль в этой шкале принимают температуру замерзания чистой воды при атмосферном давлении. Температуру
обозначают o C . Что бы перевести температуру из одной шкалы в другую, необходимо знать, чему равна температура замерзания воды в шкале Кельвина. Она равняется 273,15o K . Другими словами, в шкале Цельсия абсолютный нуль температуры находится при температуре − 273,15o C . В дальнейшем будем обозначать температуру в шкале Цельсия « t », а в шкале Кельвина
« T.». T = t + 273,15o .
Если говорят, что эксперимент проводится при комнатной
температуре, то подразумевают t = 20o C .
Для характеристики скорости хаотического (теплового) движения молекул пользуются квадратным корнем из величины
V 2 . Эту скорость называют тепловой и обозначают V . |
||||
|
|
|
|
T |
V |
= V 2 |
= |
3kT |
. |
|
||||
T |
|
|
m |
|
|
|
|
||
Так, например, тепловая скорость молекулы водорода при комнатной температуре равна 2 105 смc = 2 кмс . Из формулы
видно, что для молекул тепловая скорость достаточно велика, для Броуновских частиц она еще может быть заметной, для массивных тел – ничтожно мала.
1.2.Давление
Врезультате теплового движения частиц газ или жидкость оказывают давление на стенки объема, в котором они находятся. Ударяясь о стенки, молекулы передают им некоторый импульс.
112

Импульс, переданный в единицу времени определяет силу, а сила, отнесенная к единице поверхности, есть давление. Будем обозначать давление буквой P . Размерность давления: в системе
СГС - смдин2 , в интернациональной системе - мН2 . 1 мН2 =10 смдин2 .
Часто используют следующие единицы измерения давления:
1 |
бар =106 дин |
=105 |
Н |
, |
|
|
м2 |
|
|||||
|
см2 |
|
|
кГ |
||
1 |
техническая атмосфер =1 ат =1 |
|||||
см2 = 0,981 бар |
||||||
1 нормальная атмосфера =1,013 бар =1,033 ат = 760 мм.рт.столба.
Свойства тел, рассматриваемых в целом, называются
макроскопическими свойствами. Температура и давление – важнейшие макроскопические параметры тел. К числу таких
параметров относится также объем тела (V ). Для газов эти три параметра (T, P,V ) не являются независимыми. Знание двух из
них автоматически определяет знание третьего, таким образом, тепловые свойства тел полностью определяются знанием двух макропараметров. Изменив один из них, мы неизбежно изменим как минимум один другой параметр. Функциональная зависимость, связывающая друг с другом макропараметры, называется уравнением состояния. Уравнение состояния
f (T , P,V )= 0 определяет три семейства кривых:
1. |
семейство изотерм |
(T = const) |
2. |
семейство изобар |
(P = const) |
3. |
семейство изохор |
(V = const) |
Важное замечание. В состоянии теплового равновесия двух соприкасающихся тел их температура и давление одинаковы, т.е. между ними нет потоков энергии, и силы воздействия их друг на друга равны нулю.
2.Идеальный газ. Уравнение состояния идеального газа
113

Для изучения тепловых свойств тел выберем простейшую модель газа – идеальный газ. Это такой газ, в котором молекулы очень редко сталкиваются, но непременно сталкиваются. При этом движение молекул между столкновениями является свободным.
Выведем уравнение состояния идеального газа, т.е. найдем связь между параметрами T, P,V . Пусть объем, заполненный
идеальным газом, имеет форму параллелепипеда и удар молекул о его стенки абсолютно упругий. Такие предположения делаются только для простоты рассуждений, т.к. ясно, что свойства газа не могут зависеть от формы объема и свойств его стенок. Найдем давление газа на одну из стенок параллелепипеда. Для этого найдем импульс, передаваемый стенке в одну секунду ударяющимися молекулами. Учтем, что при отражении от стенки меняется только нормальная компонента скорости на
противоположную (Vz → −Vz ), а продольная, направленная вдоль
поверхности стенки скорость, остается неизменной. Согласно закону сохранения импульса при упругом ударе стенке передается
импульс, равный 2mVz , где m - масса молекулы. Отразившись от стенки, частица полетит к противоположной стенке, достигнет ее
через время |
h |
( h - размер грани параллелепипеда), снова |
|
Vz |
|||
|
|
отразится, и через время 2h снова столкнется с рассматриваемой
Vz
стенкой. Следовательно, частота столкновений молекулы со стенкой равна V2hz . Так как при каждом ударе молекула передает стенке импульс, равный 2mVz , то в одну секунду стенке со стороны молекулы будет передан импульс 2mVz V2hz = mVh z2 .
Просуммировав импульсы от всех молекул, получим:
114

Fz = 1h ∑mVz2 .
Пусть в рассматриваемом объеме содержится N молекул, пусть их среднее значение mVz2 равно  mVz2
mVz2  . Тогда
. Тогда
∑mVz2 = N mVz2
mVz2  .
.
Теперь учтем, что все три направления движения молекулы равноправны. Поэтому
 mVx2
mVx2  =
=  mVy2
mVy2  =
=  mVz2
mVz2  или
или  Vx2
Vx2  =
=  Vy2
Vy2  =
=  Vz2
Vz2  .
.
Но мы знаем, что  Vx2
Vx2  +
+ Vy2
Vy2  +
+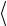 Vz2
Vz2  =
=  V 2
V 2  . Следовательно,
. Следовательно,
 mVz2
mVz2  = 13
= 13  mV 2
mV 2  ,
,
т.е. на три степени свободы движения молекул энергия делится в равной мере. Таким образом:
|
|
|
|
|
|
F = |
1 |
|
N |
1 |
mV 2 . |
|
|||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
z |
|
h |
3 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Теперь |
заменим, |
что Fz = PS , где |
P -давление, S - |
площадь |
|||||||||||
грани. |
Получим: |
PSh = |
N |
|
mV 2 , |
но Sh =V , |
поэтому |
||||||||
3 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
PV = |
mV |
2 |
= |
2 |
N |
mV 2 |
. Вспомнив определение температуры |
||||||||
|
3 |
2 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
115

kT = |
2 |
|
mV 2 |
, и в окончательном виде запишем уравнение |
|
3 |
2 |
||||
|
|
||||
состояния идеального газа:
PV = NkT .
Это уравнение универсально, т.к. природа газа при его выводе не фигурировала и не учитывались взаимодействия молекул между собой, т.е. при выводе этого уравнения не учитывалась индивидуальность газа.
Из уравнения состояния идеального газа следует, что если взять два различных газа при одинаковых значениях P,V ,T , то число молекул N будет одинаково. Это закон Авагадро. В
частности, в |
1 см3 любого идеального |
газа |
при |
T = 0o C и |
P =1 атм количество молекул будет L = 2,7 1019 |
- это число |
|||
Лошмидта. |
|
|
|
|
Число молекул N можно записать, как |
N =νN A , где ν - |
|||
число молей |
(грамм-молекул) газа, а |
N A - |
число Авагадро. |
|
N A = 6,022 1023 частицмоль - число молекул в одном моле. Тогда
PV =νN A kT =νRT , |
|
|
|||
где R = kN A = 8,314 107 |
эрг |
= 8,314 |
Дж |
и |
|
град моль |
град моль |
||||
|
|
|
|||
называется газовой постоянной.
В частности, для одного моля можно записать
PV = RT .
3.Законы Бойля Мариотта, Гей Люссака, Шарля, Дальтона
116

3.1. Закон Бойля Мариотта
Из уравнения состояния видно, что при T = const
PV = const
это закон Бойля Мариотта.
3.2. Закон Гей Люссака
Из уравнения состояния идеального газа следует, что при постоянном давлении изменение обьема и изменение температуры связаны соотношением:
V = T ,
V0 T0
где V0 иT0 некоторые начальные значения объема и температуры. Предположим теперь, что T0 - соответствует температуре
замерзания |
чистой воды при атмосферном давлении, тогда |
T = 273 + t |
и мы получаем: |
V =V |
|
T |
=V |
|
273 + t |
или |
||||
0 T |
0 273 |
|||||||||
|
|
|
|
|||||||
|
0 |
|
|
|
|
|
|
|
||
V =V |
|
|
|
t |
|
|
||||
1 + |
|
. |
|
|||||||
273 |
|
|||||||||
|
|
|
0 |
|
|
|
|
|
||
Это закон Гей Люссака. Согласно этому закону при нагревании на один градус объем увеличивается на 2731 часть объема, который
он занимал при 0o C .
Из приведенной формулы следует рецепт определения соотношения температур в шкалах Кельвина и Цельсия.
3.3. Закон Шарля
Аналогичным образом, для процесса, протекающего при постоянном объеме, мы можем получить:
117
P = P |
|
+ |
t |
|
|
1 |
|
. |
|||
273 |
|||||
0 |
|
|
|
Это закон Шарля.
3.4. Закон Дальтона
При выводе уравнения состояния идеального газа мы не пользовались предположением о том, что все молекулы одинаковы. Поэтому полученное уравнение применимо и для смеси газов (фактически это следствие того, что мы не учитывали характер взаимодействия молекул между собой, а вернее, совсем им пренебрегли).
Пусть смесь газов находится в одном объеме при температуре T . N - общее число молекул смеси газов, причем,
Ni - число молекул каждого газа
составляющего рассматриваемую смесь. Для этого случая уравнение состояния идеального газа будет иметь вид:
PV = ∑Ni kT .
i
Но для каждого из компонентов составляющих смесь газов, мы можем записать PiV = Ni kT . Поэтому, суммируя по всем молекулам, получим:
∑PiV = kT ∑Ni =PV .
i |
i |
Таким образом, имеем:
∑Pi = P ,
i
т.е. давление смеси газов равно сумме давлений каждого газа, если бы он один занимал весь объем V . Это закон Дальтона.
Давления Pi называются парциальными давлениями.
118

4.Идеальный газ во внешнем силовом поле. Распределение Больцмана. Барометрическая формула
Рассмотрим столб идеального газа во внешнем силовом поле. Пусть силы поля действуют на молекулы в неизменном направлении z . Рассмотрим две площадки единичного сечения отстоящие друг от друга на расстоянии dz . В результате действия силы поля давление в т. z будетP , а в точке z + dz будет P + dP . Разность давлений равна суммарной силе, действующей на молекулы, содержащиеся в параллелепипеде объемом 1 dz . Эта сила равна F n 1 dz , где F – сила, действующая на одну молекулу, n - плотность молекул. Итак: dP = nFdz . Учтем, что
сила связана с потенциальной энергией соотношением F = − dUdz ,
поэтому имеем:
dP = −n dUdz dz = −ndU .
С другой стороны, т.к. газ идеальный, мы можем записать:
PV = NkT или P = Vn kT = nkT или dP = kTdn . Подставляя эту величину в ранее представленное уравнение, получаем:
kTdn = −ndU .
Преобразуем это выражение: |
dn |
|
= − |
dU |
или |
d ln n = − |
dU |
. |
|
n |
kT |
|
|||||||
Окончательно имеем: |
|
|
|
kT |
|||||
|
|
U (z) |
|
|
|
|
|||
|
|
|
|
|
|
||||
n = n0 exp − |
|
|
, |
|
|
|
|
||
|
|
|
|
|
|
||||
|
|
kT |
|
|
|
|
|||
где n0 - плотность газа в плоскости, где U = 0 .
119
Это формула Больцмана. Распределение плотности частиц газа с температурой T в потенциальном силовом поле U (z).
Видно, что при U (z)= 0 распределение равномерное.
Умножим слева и справа формулу Больцмана на kT и получим выражение для распределения давления газа
P = P0 |
|
U (z) |
||
exp − |
|
|
, |
|
|
|
|||
|
|
kT |
||
которое для газа, находящегося |
в поле тяготения Земли ( |
|||
U (z)= mgh ) принимает вид: |
|
|
|
|
P = P0 |
|
mgh |
||
exp − |
|
. |
||
|
||||
|
|
kT |
||
Это барометрическая формула Она показывает зависимость давления газа от высоты над поверхность Земли.
5.Распределение частиц по скоростям при тепловом равновесии. Распределения Максвелла
Различные молекулы газа имеют различные скорости. Возникает вопрос, сколько молекул имеют ту или иную скорость, т.е. каково распределение молекул по скоростям.
Ответ на этот вопрос дает распределение Максвелла,
которое справедливо для газа, находящегося в тепловом
равновесии. |
|
|
|
|
|
|
Число молекул газа ( dN ), компоненты скоростей которых |
||||
лежат |
в |
интервалах |
между |
Vx , Vy , Vz |
и |
Vx + dVx , Vy + dVy , Vz + dVz определяется формулой:
|
3 |
|
|
mV 2 |
|
||
|
m |
|
|
− |
|
||
2 |
|
||||||
dN = N |
|
|
e |
|
2kT dVx dVy dVz . |
||
|
|||||||
|
2πkT |
|
|
|
|
||
120
