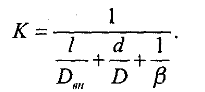- •Дайте общую краткую характеристику массообменных процессов и перечислите их.
- •Общие методы интенсификации процесса массопередачи. Роль и значение гидродинамики процесса.
- •Экстракция в системе жидкость - твердое тело. Определение. Общая характеристика процесса.
- •В чем заключаются особенности экстрагирования лекарственного растительного (высушенного и свежего) и животного сырья?
- •Стадии экстрагирования. Материальный баланс процесса экстракции.
- •Применение экстракции в системе жидкость - твердое тело в фармацевтической технологии.
- •Экстракция в системе жидкость-жидкость. Определение. Общая характеристика процесса.
- •Состав экстракционной системы. Растворители (экстрагенты) для жидкостной экстракции, их характеристика. Что такое коэффициент распределения? Чем обусловлен выбор растворителя?
- •Заполните таблицу: Экстракторы.
- •Применение жидкостной экстракции в фармацевтической технологии.
- •Экстракционные препараты.
- •Лекарственное растительное сырье и сырье животного происхождения как система, содержащая комплекс веществ. Значение экстракционных препаратов.
- •Приведите классификацию и характеристики экстракционных препаратов.
- •Водные извлечения: настои и отвары. Определение. Требования, предъявляемые к настоям и отварам гф XI.
- •Технологическая схема получения. (с учетом физико-химических свойств действующих веществ сырья)
- •Вариант 10
-
Дайте общую краткую характеристику массообменных процессов и перечислите их.
В промышленности широкое использование получили процессы массообмена.
Наиболее распространенными в химической и фармацевтической промышленности являются следующие массообменные процессы.
 Абсорбция
– избирательное поглощение газов
или паров жидким поглотителем. Наиболее
широко используется для разделения
технологических газов и очистки газовых
выбросов.
Абсорбция
– избирательное поглощение газов
или паров жидким поглотителем. Наиболее
широко используется для разделения
технологических газов и очистки газовых
выбросов.
Перегонка и ректификация – разделение жидких гомогенных смесей на компоненты при взаимодействии потоков жидкости и пара, полученного испарением разделяемой смеси. Процесс ректификации используется для разделения жидких смесей на составляющие их компоненты, получения сверхчистых жидкостей и для других целей.
Экстракция (жидкостная) – извлечение растворенного в одной жидкости вещества другой жидкостью, практически не смешивающейся или частично смешивающейся с первой. Процесс применяют для извлечения растворенного вещества или группы веществ сравнительно невысоких концентраций.
Адсорбция – избирательное поглощение газов, паров или растворенных в жидкости веществ твердым поглотителем, способным поглощать одно или несколько веществ из смеси. Адсорбцию применяют для извлечения того или иного вещества (или веществ) достаточно низкой концентрации из их смеси.
Сушка – удаление влаги из твердых влажных материалов, в основном путем ее испарения. Сушку широко применяют в технике для предварительного обезвоживания перерабатываемых веществ или обезвоживания готового продукта.
Кристаллизация – выделение твердой фазы в виде кристаллов из растворов или расплавов. Применяется, в частности, для получения веществ повышенной чистоты.
Массопередача осуществляется, как правило, при непосредственном соприкосновении фаз. При этом граница соприкосновения может быть подвижной (система «газ – жидкость» и др.) или неподвижной («газ – твердое тело» и т.д.). Одним из способов практической реализации массообменных процессов является использование аппаратов насадочного типа. В этом случае в качестве поверхности контакта двух фаз (массообменной поверхности) выступает поверхность инородных тел – насадка, которую укладывают различными способами.
Массообменные или диффузионные процессы преобладают и в процессе извлечения (экстрагирования) веществ из сырья (растительного, животного).
Различают диффузию: 1) молекулярную и 2) конвективную.
Молекулярной диффузией называется обусловленный хаотическим движением молекул процесс постепенного взаимного проникновения веществ (жидких или газообразных), граничащих друг с другом и находящихся в макроскопическом покое. Интенсивность диффузии зависит от кинетической энергии молекул. Чем она выше, тем интенсивнее протекает диффузионный процесс. Например, газы легко диффундируют друг в друга, поскольку молекулы их движутся с большими скоростями. Жидкости и растворы, движение молекул в которых более ограничено, диффундируют значительно медленнее.
Движущей силой диффузионного процесса является разность концентраций растворенных веществ в соприкасающихся жидкостях. Чем больше будет разница концентраций, тем большее количество вещества переместится при всех прочих равных условиях за одно и то же время. Конвективный перенос вещества происходит в результате сотрясения, изменения температуры, перемешивания и т. д., т. е. причин, вызывающих перемещение жидкости, а вместе с ней и растворенного вещества в турбулентном потоке. Инаие говоря, механизм конвективной диффузии состоит в переносе вещества в виде отдельных небольших объемов его раствора, причем внутри этих малых объемов имеет место и молекулярная диффузия.
-
Каково место и роль процессов массообмена в фармацевтической технологии? Значение массообменных процессов в решении задач охраны окружающей среды.
Сегодня очень многие биологически активные вещества получают из природного сырья растительного или животного происхождения. Каждый третий лекарственный препарат, из имеющихся, в арсенале современной медицины - продукт растительного происхождения. Следует также отметить, что в терапии отдельных заболеваний препараты из растений занимают доминирующее положение. Так, на долю препаратов растительного происхождения приходится 80% маточных, 77% сердечных, 72—74% отхаркивающих, противоглистных, желудочных средств.
Поэтому процессы экстрагирования (извлечения) имеют весьма большое значение в современной фармации. Путем извлечения получается основная группа суммарных (галеновых) препаратов — экстракты и настойки, а также новогаленовые препараты, полифракционные экстракты, извлечения из свежих растений и ряд других. Экстракционный процесс лежит в основе технологии многих препаратов, получаемых из сырья животного происхождения (препараты гормонов, ферментов и др.).
Экстракционный процесс лежит в основе не только производства суммарных препаратов, но и технологии выделения из сырья индивидуальных фармакологически активных веществ (алкалоиды, гликозиды, сапонины и др.).
Массообменные процессы используются также для решения задач разделения жидких и газовых смесей, концентрирования, защиты окружающей среды (очистка сточных вод и отходящих газов). Наиболее часто процессы массопередачи используют для разделения гомогенных систем.
Эффективность защиты окружающей среды от газовых выбросов и промышленных сточных вод определяется успехами катализа и в равной мере эффективностью массообменных процессов, таких, как абсорбция, экстракция, адсорбция и др. Hаиболее перспективные пути интенсификации массообменных процессов - использование явлений самоорганизации на межфазной поверхности (например, в результате возникновения локальных градиентов поверхностного натяжения), организованная нестационарность массопередачи, воздействие пульсаций и вибраций, звуковых и ультразвуковых колебаний, электрических и магнитных полей, разработка новых гидродинамических режимов и направленное совмещение химических и массообменных процессов.
-
Основы теории массопередачи.
-
Статика массообменных процессов. Способы выражения состава фаз. Законы фазового равновесия. Коэффициент распределения. Направление процессов массопереноса, их обратимость.
-
Кинетика массообменных процессов. Основные понятия. Механизмы переноса массы. Молекулярная диффузия. Законы диффузии (законы Фика). Коэффициенты молекулярной диффузии. Конвективная диффузия (коэффициент конвективной диффузии). Диффузионный пограничный слой. Теоретические модели переноса массы (пленочная, пограничного слоя, поверхности обновления и др.).
-
Массопередача. Основное уравнение массопередачи. Коэффициенты массопередачи и их выражения. Средняя движущая сила процесса массопередачи. Влияние гидродинамической структуры потоков на величину средней движущей силы массопередачи.
А.
Фазой называется совокупность гомогенных (однородных) частей системы, одинаковых по составу, химическим и физическим свойствам и отграниченных от других частей системы поверхностью. Поверхности раздела фаз образуются некоторым количеством молекул, расположенных на границе области, заполненной данной фазой. Молекулы, образующие поверхностный слой, находятся в особых условиях, вследствие чего поверхностный слой обладает особыми свойствами, не присущими веществу, находящемуся в глубине фазы. Образования, составленные из небольшого числа молекул, не могут быть разделены на поверхностный слой и внутреннюю массу вещества, поэтому к образованиям с очень малым объемом понятие фаза неприменимо. Жидкие и твердые фазы называются конденсированными.
Составляющее вещество системы - это каждое вещество системы, которое может быть выделено из системы и существовать вне ее. Если в системе не протекает химическая реакция, то количество каждого из веществ не зависит от количеств других веществ. Если в системе протекает химическая реакция, то состав фаз равновесной системы можно определить, зная концентрацию только части веществ. Составляющие вещества, концентрации которых определяют состав фаз данной равновесной системы, называют независимыми составляющими веществами или компонентами системы. Свойства системы определяются не только природой компонентов, но и их числом. Число компонентов совпадает с числом составляющих веществ при отсутствии химической реакции или меньше при наличии химической реакции
В равновесной системе связь между числами фаз, компонентов и термодинамических степеней свободы выражается правилом фаз Гиббса или законом равновесия фаз. Рассмотрим равновесную термодинамическую систему, состоящую из Ф фаз, каждая из которых содержит К компонентов. Примем в качестве параметров, определяющих состояние системы, давление, температуру и концентрации компонентов, выраженные в массовых или молярных долях или процентах. Оценим общее число параметров состояния и число уравнений, связывающих их. Число параметров, одинаковых во всех фазах системы, равно двум (Р и Т). Поскольку концентрации компонентов выражены в массовых или молярных долях или процентах, то для характеристики состава одной фазы достаточно задать (К — 1) концентраций. Концентрация одного из компонентов данной фазы будет определена, если известны концентрации остальных компонентов. Для характеристики состава всех фаз равновесной системы необходимо знать Ф(К — 1) концентраций. Тогда общее число параметров, определяющих состояние равновесной системы, будет равно Ф(К — 1) + 2.
Так как при Р = соnst T=const химические потенциалы компонентов являются функциями их концентраций, например, в идеальном растворе, то число уравнений, связывающих концентрации компонентов равновесной системы, можно определить из равенства химических потенциалов каждого компонента во всех фазах :
(1)
Число уравнений, связывающих концентрации одного компонента, равно (Ф — 1), а всех К компонентов — К(Ф — 1). Число независимых параметров состояния системы, т.е. число термодинамических степеней свободы, равно разности между общим числом параметров, определяющих состояние равновесной системы, и числом уравнений, связывающих эти параметры:
С = Ф(К - 1) + 2 - К(Ф - 1),
С=К-Ф + 2. (2)
Уравнение (2) называется правилом фаз Гиббса или законом равновесия фаз: в равновесной термодинамической системе, на которую из внешних факторов оказывают влияние только давление и температура. Число термодинамических степеней свободы равно числу компонентов минус число фаз плюс два. Число степеней свободы возрастает с увеличением числа компонентов и уменьшается с увеличением числа фаз. Поскольку число степеней свободы не может быть отрицательным, число фаз в равновесной системе не может превышать К + 2.
Правило фаз было выведено американским физиком Дж. Гиббсом в 1876 г. Учение о фазах в дальнейшем было использовано в работах Я. Вант-Гоффа, Б. Розебома, Н.С. Курнакова и др. и явилось основой изучения равновесий в гетерогенных системах. Если из внешних факторов на систему оказывает влияние только давление (Р=соnst) или температура (T=const), число степеней свободы уменьшается на единицу и уравнение правила фаз (2) принимает вид
СуСЛ = К-Ф+1 (3)
Вариантность системы, рассчитанная по этому уравнению, называется условной (Сусл), а система — условно инвариантной, условно моновариантной и т.д. При постоянстве давления и температуры
Cусл=К-Ф (4)
Если составы двух равновесных фаз, например жидкой и парообразной, одинаковы, то при подсчете числа степеней свободы следует учитывать еще одно уравнение, связывающее концентрации компонентов Х,(ж) = Х,(п). В этом случае вместо уравнения (2) следует пользоваться уравнением
СуСЛ = К-Ф+1 (5)
а вместо уравнения (3) — уравнением
Cусл=К-Ф (6)
Если состояние системы определяется и такими внешними факторами, как электрическое или магнитное поле, поле тяготения и др., то их также следует учитывать при подсчете числа степеней свободы в равновесной системе. В общем случае, когда на систему действуют п различных факторов, то
С=К-Ф+n (7)
Процесс перехода вещества из одной фазы в другую через границу раздела фаз носит название массопередачи , а процесс переноса вещества из объема фазы к границе раздела или в противоположном направлении – массоотдача.
Массопередачей называют переход вещества из одной фазы в другую в направлении достижения равновесия.
При взаимодействии двух фаз, согласно второму закону термодинамики, их состояние изменяется в направлении достижения равновесия, характеризующегося равенством температур и давлений фаз, а также химических потенциалов каждого компонента в сосуществующих фазах.
Движущей силой процесса переноса любого компонента из одной фазы в другую является разность химических потенциалов этого компонента во взаимодействующих фазах. Перемещение компонента происходит в направлении уменьшения его химического потенциала. Поскольку химические потенциалы компонентов неидеальных смесей являются сложными функциями состава, при анализе процессов массопередачи обычно рассматривают изменение не химических потенциалов, а концентраций компонентов.
Это объясняется тем, что концентрации компонентов поддаются непосредственному определению и чаще всего рассматриваются как параметры состояния двух – и многокомпонентных систем.
В массообмене участвуют в большинстве случаев три вещества: распределяющее вещество (G), составляющее первую фазу; распределяющее вещество (L), составляющее вторую фазу; распределяемое вещество (М), которое переходит из одной фазы в другую.
Поскольку все рассматриваемые массообменные процессы обратимы, распределяемое вещество может переходить из фазы G в фазу L, и наоборот, в зависимости от концентрации этого вещества в распределяющих фазах.
В качестве движущей силы процесса массопереноса компонента i из объема фазы к границе раздела или в обратном направлении принимается разность концентраций этого компонента на границе раздела фаз и в объеме рассматриваемой фазы. Так при десорбции, если концентрация компонента i в отдающей фазе равна хi, а в принимающей уi, и на границе раздела фаз концентрации соответственно равны хi* и уi*, то движущая сила процесса переноса в отдающей фазе будет равна . хi - хi,*, а в принимающей уi* - уi. Согласно правилу линейности, поток вещества можно представить так:
Gi=βx(X-Xi*)=βy( уi* - уi),
где βx и βy - коэффициенты массоотдачи, характеризующие кинетику переноса cоответственно в отдающей и принимающей фазах.
Как следует из этого уравнения, поток любого компонента в отдающей и принимающей фазах одинаков. Коэффициенты массоотдачи определяют перенос рассматриваемого вещества в одной из фаз через единицу поверхности поперечного сечения при движущей силе, равной единице.
b.
Процесс экстрагирования относится к массообменным процессам и протекает за счет диффузии из зоны с высокой концентрацией. Это, как правило, клетки животного или растительного материала, содержащие биологически активные вещества. Экстрагирование основано на диффузии биологически активных веществ из внутренних структур частиц материала в экстрагент и заканчивается при достижении равновесных концентраций. В равновесном состоянии из материала в экстрагент переходит такое же количество молекул, как и из экстрагента в материал, т. е. концентрация остается постоянной. При этом обычно в материале концентрация выше, чем в экстрагенте. Диффузия бывает молекулярная и конвективная.
Молекулярная диффузия — это процесс переноса распределяемого вещества (биологически активного вещества — БАВ) за счет хаотического движения самих молекул в неподвижной среде. Она характеризуется коэффициентом молекулярной диффузии D, который определяют из уравнения Эйнштейна:
![]()
где R — универсальная газовая постоянная, равная 8,32 Дж/(град-моль); N0 — число Авогадро (6,06 • 1023); Т— температура абсолютная, К; η — вязкость раствора, Н/с*м2; r — радиус диффундирующих частиц, м; к=R/N0 — постоянная Больцмана.
Коэффициент молекулярной диффузии характеризует способность данного вещества проникать вследствие диффузии в неподвижную среду и, как видно из уравнения, увеличивается с повышением температуры и уменьшается с увеличением вязкости среды и размера диффундирующих частиц вещества.
Следовательно, чем меньше радиус диффундирующих частиц, тем быстрее идет диффузия. Так, растворам белков, слизей, пектинов и т. п., имеющим большие молекулы, присущи очень низкие коэффициенты диффузии. Вещества с малыми размерами молекул (какими чаще бывают БАВ) диффундируют намного быстрее.
При экстрагировании из лекарственного растительного сырья идет диффузия БАВ из внутренних структур частицы материала. При этом процессе извлечение имеет свои особенности. Прежде всего, наличие пористой перегородки, межклеточного пространства и клеточных ходов снижает скорость диффузии. Далее, через поры перегородки могут пройти только те вещества, частицы которых не превышают размеров пор. Наконец, имеется еще одна существенная особенность — явление десорбции, наблюдаемое в клетке после проникновения в нее экстрагента. Поскольку вещества внутри клетки связаны силами притяжения, то необходимо прежде всего преодоление этих адсорбционных сил. Весь сложный комплекс диффузионных явлений, протекающих внутри кусочков растительного материала, называют внутренней диффузией. Для выражения коэффициента диффузии в порах растительного материала в уравнение Эйнштейна для свободной диффузии вводят поправочный коэффициент В, учитывающий все осложнения процесса. Уравнение коэффициента внутренней диффузии в этом случае будет иметь вид:
![]()
Для материала с клеточной структурой значение коэффициента внутренней диффузии значительно меньше, чем значение коэффициента свободной диффузии. Так, величина коэффициента свободной диффузии для многих природных соединений находится в пределах 10 -4—10-5 м2/с. Для этих же соединений значение коэффициента диффузии в порах материала с клеточной структурой на 2—3 порядка меньше.
Особенности извлечения биологически активных веществ из материалов с клеточной структурой связаны с тем, что на пути к веществам, содержащимся в клетке, находится клеточная стенка, физиологическое состояние которой может быть различным. Так, живая растительная клетка имеет пристенный слой протоплазмы определенной толщины. Он накладывает особый отпечаток на свойства клеточной стенки, как перегородки, отделяющей раствор внутри клетки (клеточный сок) от жидкости вне клетки.
Особенности извлечения биологически активных веществ из материалов с клеточной структурой связаны с тем, что на пути к веществам, содержащимся в клетке, находится клеточная стенка, физиологическое состояние которой может быть различным. Так, живая растительная клетка имеет пристенный слой протоплазмы определенной толщины. Он накладывает особый отпечаток на свойства клеточной стенки, как перегородки, отделяющей раствор внутри клетки (клеточный сок) от жидкости вне клетки.
Пока протоплазма жива, клеточная стенка является полупроницаемой перегородкой, не пропускающей наружу вещества, растворенные в клеточном соке. В данном случае возможно лишь проникновение экстрагента внутрь клетки (осмос).
Совершенно по-другому ведет себя мертвая клетка. Вследствие гибели протоплазмы (плазмолиза) клеточная стенка теряет характер полупроницаемой перегородки и начинает пропускать вещества в обе стороны (диализ). То есть клеточная стенка приобретает свойства пористой перегородки, через нее могут диффундировать биологически активные вещества, молекулы которых не превышают размера пор.
Подавляющее большинство экстракционных препаратов получают из высушенного растительного сырья, т. е. обезвоженного путем тепловой сушки. В случае получения препаратов из свежих растений клетки умерщвляют этиловым спиртом. Он очень гигроскопичен и при соприкосновении с растительной клеткой обезвоживает ее, вызывая сильнейший плазмолиз. Умерщвление клеток сырья животного происхождения достигается теми же способами: сушкой или обезвоживанием спиртом и ацетоном.
При получении препаратов из свежего сырья, клетки которого не обезвожены, скорее имеет место вымывание клеточного сока из разрушенных клеток и открытых пор, чем процесс экстрагирования.
В процессе экстрагирования происходит массопередача, характеризуемая переходом одного или нескольких веществ из одной фазы (сырья) в другую (экстрагент). Массопередача из сырья с клеточной структурой — сложный процесс, в котором можно выделить три стадии: 1) «внутренняя диффузия», включающая все явления переноса веществ внутри частиц сырья; 2) перенос вещества в пределах непосредственно диффузионного пограничного слоя; 3) перенос вещества движущимся экстрагентом (конвективная диффузия).
На первой стадии экстрагирование из обезвоженного сырья с клеточной структурой начинается с проникновения экстрагента в материал, смачивания веществ, находящихся внутри клетки, растворения и десорбции их. Далее следует молекулярный перенос растворенных веществ, вначале в экстрагент, находящийся в межклеточном пространстве, затем в экстрагент, заполняющий микро-и макротрещины, и наконец, на поверхность кусочков материала.
Представим в виде схемы частичку материала, находящуюся в экстрагенте, и обозначим среднюю концентрацию экстрагируемых веществ внутри частицы С1, а на ее поверхности — С2.
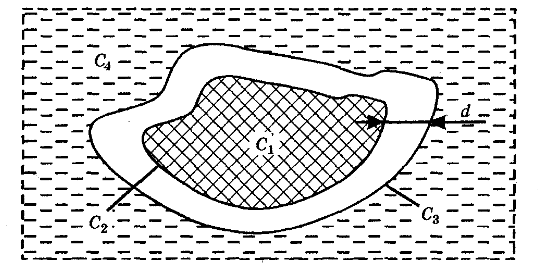
Тогда количество продиффундировавшего вещества из внутренних структур частицы на ее поверхность (первая стадия) пропорционально его коэффициенту внутренней диффузии Dвн, поверхности частицы материала F, времени т, разности концентрации внутри частицы С1 и на ее поверхности С2, обратно пропорционально размеру частиц растительного сырья l и может быть записано в виде уравнения:
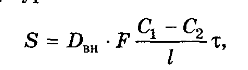
На второй стадии идет диффузия веществ от поверхности частицы (концентрация С2) к наружной поверхности диффузионного пограничного слоя (концентрация С3). В настоящее время общепризнанно существование на поверхности кусочков сырья пристенного слоя, экстрагента, называемого диффузионным пограничным слоем. Пограничный диффузионный слой оказывает большое сопротивление дальнейшему переносу экстрагируемых веществ в экстрагент. Толщина этого слоя зависит от гидродинамики процесса и, в основном, от скорости перемешивания экстрагента. Чем больше скорость перемешивания, тем меньше толщина пограничного слоя. В пределах диффузионного пограничного слоя перенос веществ осуществляется по закону свободной диффузии и может быть записан в виде первого закона Фика:
![]()
где d — толщина диффузионного пограничного слоя, м.
Далее, на третьей стадии процесса экстрагирования перенос действующих веществ осуществляется за счет движения экстрагента (конвективная диффузия). Если обозначить среднюю концентрацию экстрагента в объеме, омывающем частичку, через С4, то количество вещества, перенесенного в экстрагент за счет конвективной диффузии, может быть вычислено из уравнения:
![]()
где β — коэффициент конвективной диффузии (м/с), который тем выше, чем интенсивнее перемешивание.
Обычно коэффициент конвективной диффузии β во много раз больше коэффициента молекулярной диффузии D.
Суммарный процесс переноса вещества из частицы материала в экстрагент выражается основным уравнением массопередачи:
![]()
где К — коэффициент массопередачи (м/с), который учитывает все величины, являющиеся количественными характеристиками трех стадий процесса экстракции и определяется из уравнения: