
- •Доклад на тему: «Роль физической химии в металлургии»
- •2013 Год
- •1. Роль физической химии в металлургии
- •2.Теоретический подход
- •2.1. Введение.
- •2.2.Основы химической термодинамики.
- •2.3. Первый закон термодинамики.
- •2.4. Работа.
- •2.5. Теплота. Калорические коэффициенты
- •2.6. Термохимия.
- •2.7. Второй закон термодинамики. Энтропия.
- •2.8 Термодинамические потенциалы.
- •2.9. Гетерогенные равновесия. Правило фаз Гиббса. Фазовые равновесия
- •2.10. Химическое равновесие.
- •3. Практическая часть.
- •3.1 Термодинамический анализ
- •3.2. Закон сохранения энергии и тепловые явления
- •3.3. Растворы
- •3.4.Правило фаз и диаграммы состояния.
- •3.5.Электролиты.
- •3.6. Поверхностные явления.
- •3.7. Кинетика гетерогенных реакций.
- •3.8. Скорости металлургических процессов.
- •3.8.1. Растворение твердых тел в жидкостях
- •3.8.2. Плавление скрапа
- •3.8.3. Растворение газов и дегазация
- •3.8.4. Обезуглероживание жидкой стали
- •3.8.5. Десульфурация стали
- •3.8.6. Кристаллизация стали
- •3.9.Моделирование и использование эвм при анализе сложных металлургических систем.
2.9. Гетерогенные равновесия. Правило фаз Гиббса. Фазовые равновесия
в однокомпонентных системах.
Вещества, образующие термодинамическую систему, могут находиться в различных агрегатных состояниях - твердом, жидком и газообразном. Система, между частями которой нет поверхностей раздела, а интенсивные свойства одинаковы в любых точках, называется гомогенной. Если части системы разграничены поверхностями раздела, на которых происходит скачкообразное изменение некоторых свойств, то та-
такие системы относят к гетерогенным. Любая гетерогенная система состоит из нескольких фаз. Фаза - гомогенная часть гетерогенной системы, ограниченная поверхностью раздела. Фаза может быть образована одним или несколькими составляющими веществами. Компоненты - это минимальный набор веществ, достаточный для получения всех других составляющих.
В гетерогенных системах числа компонентов и фаз связаны между собой соотношением, получившим название правила фаз Гиббса.
Состояние системы определено, если заданы количества компонентов и параметры, характеризующие силовые контакты системы с окружением.
dU= Σ Pjdxj + Σµidni
j i
Правило фаз Гиббса:
С = m + Ф(К – 1) – К(Ф -1) – n = m – n + K – Ф.
Если m=2 (термическое и механическое равновесия) и отсутствуют дополнительные условия связи n=0, то правила фаз
C= K-Ф+2
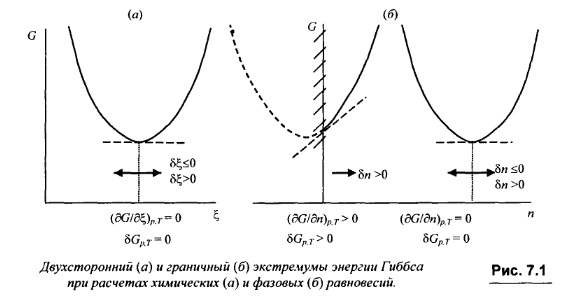
Общим условием равновесия закрытой системы при постоянстве температуры и давления является минимум энергии Гиббса системы по внутренним переменным. При расчетах гомогенных (химических) равновесий внутренними переменными являются количества составляющих веществ, гетерогенных- количества фаз и составы каждой из них.
Количество каждого из составляющих веществ в условиях динамического равновесия может изменяться в любую сторону. В этом случае условие равновесия записывается как δG p,T,n = 0



2.10. Химическое равновесие.
Химическое равновесие- такое состояние системы при фиксированных естественных переменных, при котором её характеристическая функция минимальна. Если в системе протекает обратимая химическая реакция, то при равновесии скорости прямой и обратной реакций равны, и с течением времени не происходит изменения количеств реагирующих веществ в реакционной смеси.
Условие химического равновесия записывается в виде
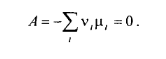
На рисунке представлена зависимость энергии Гиббса системы от химической переменной ξ при р, Т=const. Энергия Гиббса реакции, ΔrG, определяется как наклон касательной к кривой зависимости энергии Гиббса системы от степени протекания химической реакции ξ.
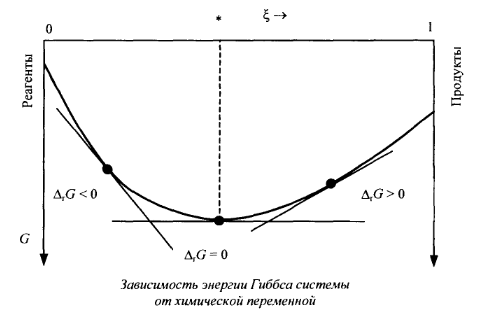
Минимум энергии Гиббса соответствует состояние, отмеченное *.
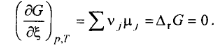
2.11. Основные понятия химической кинетики.
Химическая кинетика- раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики:
Расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача);
Определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость химической реакции в газовой фазе или в растворе определяется изменением числа молекул (или числа молей n) вещества в единицу времени в единице объёма:
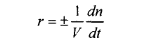
Знак + используют, если скорость определяют по продукту, а минус – по исходному веществу.
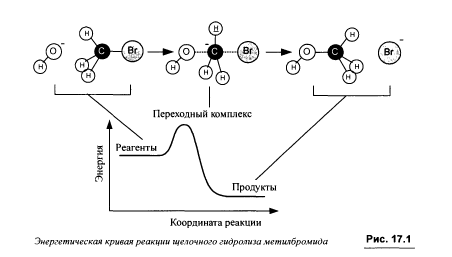
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями (единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса). Переходный комплекс- конфигурация ядер, соответствующая переходу от реагентов к продуктам. Обычно переходному комплексу отвечает область вблизи максимума на энергетической кривой химической реакции. Энергетическая кривая реакции щелочного гидролиза метилбромида

Число частиц, участвующих в элементарной реакции, называют мономолекулярностью реакции. Элементарные реакции бывают только трех типов:
Мономолекулярные реакции- элементарные реакции распада и изомеризации, в которых участвует только одна молекула:

Разрыв связей в исходной молекуле происходит под действием света или при нагревании, например:
![]()
В бимолекулярных реакциях происходит столкновение двух частиц:
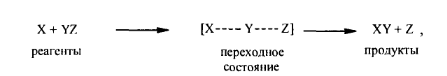
При этом одни связи разрываются, а другие образуются, например:
![]()
В тримолекулярных реакциях одновременно сталкиваются три молекулы, например:
![]()
Сложная реакция состоит из нескольких элементарных реакций.
Скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенных в некоторые степени:
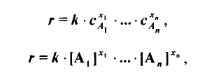
Где k – константа скорости, зависящая от температуры;
х1……хn – некоторые числа, которые называют порядком реакции по веществам А1….Аn.
