
- •Доклад на тему: «Роль физической химии в металлургии»
- •2013 Год
- •1. Роль физической химии в металлургии
- •2.Теоретический подход
- •2.1. Введение.
- •2.2.Основы химической термодинамики.
- •2.3. Первый закон термодинамики.
- •2.4. Работа.
- •2.5. Теплота. Калорические коэффициенты
- •2.6. Термохимия.
- •2.7. Второй закон термодинамики. Энтропия.
- •2.8 Термодинамические потенциалы.
- •2.9. Гетерогенные равновесия. Правило фаз Гиббса. Фазовые равновесия
- •2.10. Химическое равновесие.
- •3. Практическая часть.
- •3.1 Термодинамический анализ
- •3.2. Закон сохранения энергии и тепловые явления
- •3.3. Растворы
- •3.4.Правило фаз и диаграммы состояния.
- •3.5.Электролиты.
- •3.6. Поверхностные явления.
- •3.7. Кинетика гетерогенных реакций.
- •3.8. Скорости металлургических процессов.
- •3.8.1. Растворение твердых тел в жидкостях
- •3.8.2. Плавление скрапа
- •3.8.3. Растворение газов и дегазация
- •3.8.4. Обезуглероживание жидкой стали
- •3.8.5. Десульфурация стали
- •3.8.6. Кристаллизация стали
- •3.9.Моделирование и использование эвм при анализе сложных металлургических систем.
2.3. Первый закон термодинамики.
Первый закон термодинамики- это закон сохранения энергии. Он утверждает, что
Существует аддитивная функция состояния термодинамической системы, называемая энергией, U. Энергия изолированной системы постоянна. В закрытой системе энергия может изменяться за счёт:
а) совершения работы W над окружающей средой;
б) обмена теплотой Q с окружающей средой.
dU= δQ+ δW (дифференциальная форма)
ΔU=Q+W (интегральная форма)
где δ - бесконечно малая величина.
В системе СИ размерность работы, теплоты и энергии –[Дж]
Согласно рекомендациям ИЮПАК, принято считать положительной теплоту, полученную системой, и работу, совершенную над ней.
Первый закон справедлив для любых систем и процессов, но в случае открытых систем использовать его в дифференциальной форме уравнения нельзя, так как в процессах, сопровождающихся переносом вещества от системы к окружению или обратно, наблюдаемые изменения энергии не удается разделить на теплоту и работу.
Иногда для открытых систем первый закон записывают в виде:
dU= δQ+ δW+Σµidni,
где:
Σµidni характеризует процесс обмена веществом между системой и окружением (химическая работа- работа переноса вещества из окружения в систему);
µ- химический потенциал.
В общем случае энергия системы складывается из:
• кинетической энергии движения системы как целого;
• потенциальной энергии, обусловленной положением системы во внешнем силовом поле;
• внутренней энергии.
Обычно в химической термодинамике рассматриваются неподвижные системы в отсутствие внешних полей. В этом случае полная энергия системы равна ее внутренней энергии, которая является суммой
• кинетической энергии молекулярного движения;
• энергии межмолекулярных взаимодействий (притяжения и отталкивания составляющих систему частиц);
• энергии, эквивалентной массе покоя всех частиц согласно уравнению Эйнштейна;
• энергии излучения.
Работа - это упорядоченная форма передачи энергии, а теплота - неупорядоченная, связанная с хаотическим движением частиц.
2.4. Работа.
Работа W — форма передачи энергии от одного тела к другому, не связанная с переносом теплоты и (или) вещества. Существуют разные виды работы: механическая, электрическая, магнитная, изменения поверхности и др. Бесконечно малую работу любого вида можно представить как произведение обобщенной силы на изменение обобщенной
координаты, например:
δW мех= -pdV механическая работа (работа расширения);
δW эл= φdq работа переноса заряда; δW пов= ϬdΩ работа изменения площади поверхности;
δW магн= VHdM работа намагничивания вещества;
где φ- электрический потенциал, q - заряд, Ϭ - поверхностное натяжение, Ω — площадь поверхности, Н — напряженность магнитного поля, М-удельная намагниченность.
Сумму всех видов работ за исключением механической работы называют полезной (немеханической) работой:
δWпол= φdq+ VHdM+ Σµidni+…
Дифференциальное выражение первого закона можно представить в виде:
dU=δQ-pdV+δWпол.
Механическую работу, производимую при расширении против внешнего давления рс, рассчитывают по формуле:
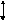 W=-ʃ
рс
dV
W=-ʃ
рс
dV
Если процесс расширения обратим, то внешнее давление отличается от давления системы (например, газа) на бесконечно малую величину:
рс = рi- δp и в формулу можно подставлять давление внутри системы, которое определяется по уравнению состояния.
В адиабатическом процессе отсутствует теплообмен с окружающей средой (Q = О,
δQ =0), поэтому работа может совершаться только за счет убыли внутренней энергии:
W = ΔU. При обратимом адиабатическом расширении идеального газа давление и объем связаны соотношением (уравнением адиабаты):
pVγ = const.
где γ = Ср/ Сv, Ср и Сv- изобарная и изохорная теплоемкости.
Это уравнение справедливо только для обратимого адиабатического процесса. Это же уравнение можно записать в эквивалентных формах:
TV γ-1 = const,
T γ p1- γ = const.
