
- •Доклад на тему: «Роль физической химии в металлургии»
- •2013 Год
- •1. Роль физической химии в металлургии
- •2.Теоретический подход
- •2.1. Введение.
- •2.2.Основы химической термодинамики.
- •2.3. Первый закон термодинамики.
- •2.4. Работа.
- •2.5. Теплота. Калорические коэффициенты
- •2.6. Термохимия.
- •2.7. Второй закон термодинамики. Энтропия.
- •2.8 Термодинамические потенциалы.
- •2.9. Гетерогенные равновесия. Правило фаз Гиббса. Фазовые равновесия
- •2.10. Химическое равновесие.
- •3. Практическая часть.
- •3.1 Термодинамический анализ
- •3.2. Закон сохранения энергии и тепловые явления
- •3.3. Растворы
- •3.4.Правило фаз и диаграммы состояния.
- •3.5.Электролиты.
- •3.6. Поверхностные явления.
- •3.7. Кинетика гетерогенных реакций.
- •3.8. Скорости металлургических процессов.
- •3.8.1. Растворение твердых тел в жидкостях
- •3.8.2. Плавление скрапа
- •3.8.3. Растворение газов и дегазация
- •3.8.4. Обезуглероживание жидкой стали
- •3.8.5. Десульфурация стали
- •3.8.6. Кристаллизация стали
- •3.9.Моделирование и использование эвм при анализе сложных металлургических систем.
3. Практическая часть.
3.1 Термодинамический анализ
Термодинамический анализ является первой ступенью исследования того или иного металлургического процесса и позволяет установить в каком направлении при заданных условиях протекает процесс, каково отклонение системы от равновесия, каков равновесный состав фаз при заданных внешних условиях, какие внешние факторы и как влияют на состояние равновесия.
Процессы диссоциации оксидов являются важными для металлургии, поскольку большинство металлов в природе встречаются в окисленном состоянии, а диссоциация оксидов- наиболее прямой путь получения металла. Кроме того, термодинамические характеристики этих процессов полезны, а часто и необходимы для анализа восстановления и ряда других процессов с участием оксидов.
Реакцию диссоциации в общем виде можно представить уравнением:
b1 Men Om = b2 Meq Op + O2 ,
где m, n,p,q – некоторые целые числа, связанные стехиометрическими соотношениями. Если продуктом диссоциации является металл, то p=0, q=1. Коэффициенты b1 и b2 обычно выбираются таким образом, чтобы изменения свойств относилось к одному молю кислорода. Если это правило выполняется, то при p, T=const по изменению энергии Гиббса можно сравнить устойчивость оксидов или способность металлов к окислению. Стандартное изменение энергии Гиббса связано с константой равновесия реакции K:
G o
=
RT
ln
K
o
=
RT
ln
K
и, следовательно, характеризует полноту её протекания. Например, для диссоциации химически прочного оксида до металла и кислорода константа равновесия мала (K <<1) , а значения ∆Go велики; значительна и склонность металла к окислению. Стандартное изменение энергии Гиббса при диссоциации низшего оксида называют нормальным химическим сродством элемента к кислороду. Диссоциация оксидов сопровождается поглощением тепла. В соответствии с принципом смещения равновесий (принцип Ле- Шателье) повышение температуры приводит к смещению равновесия в сторону образования продуктов реакции. Равновесные составы фаз зависят от начального состояния системы, взаимной растворимости веществ, от присутствия других компонентов.
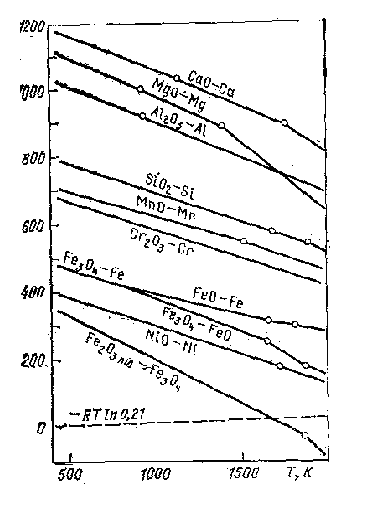
Стандартные изменения энергии Гиббса при диссоциации некоторых оксидов (изломы линий соответствуют температурам изменения агрегатного состояния исходных веществ или продуктов диссоциации).
3.2. Закон сохранения энергии и тепловые явления
Большинство производственных процессов сопровождается поглощением или выделением тепла. При рассмотрении таких процессов, которые называются тепловыми, возникают две группы задач, имеющих важное значение в металлургии.
Первая из них сводится к составлению тепловых балансов металлургических процессов. Например, чтобы рассчитать температуру металла в конвертере, необходимо найти количество тепла, выделяющегося при горении углерода, кремния и других элементов, содержащихся в чугуне при продувке его кислородом. Часть этого тепла идет на повышение температуры металла, часть на нагревание футеровки конвертера и часть тепла рассеивается в окружающем воздухе.
Другой пример относится к работе доменных печей, где восстановление железной руды коксом сопровождается поглощением тепла. Кроме того, требуется затратить тепло на процессы плавления чугуна, образования жидкого шлака из известняка и пустой породы, нагревания вдуваемых в домну газов. Поэтому при составлении теплового баланса необходимо учитывать, что затраты тепла должны компенсироваться его выделением при горении кокса. Подобные задачи решаются с помощью первого закона термодинамики, который по существу является приложением общего закона сохранения энергии к тепловым явлениям.
Вторая группа задач заключается в установлении направления металлургических реакций, вычислении их эффективности или выхода. Так, при алюминотермическом производстве феррохрома необходимо знать, возможно ли восстановление хромитовой руды алюминием, т. е. требуется выяснить направление реакции
3(FeO ∙Сr2О3)+ 8Al= 4Аl2О3 + 3Fe + 6Сr
и, кроме того, вычислить процент выхода хрома и степень использования алюминия. В рассмотренном случае необходимо заранее знать, хватит ли выделяющегося при реакции тепла, чтобы расплавить металл и получить ферросплав отделенным от образующегося шлака.
Другим примером задачи второго типа является случай подбора состава газовых смесей для нагрева стали под прокатку или штамповку с тем, чтобы не допустить ее окисления (светлый отжиг). Здесь можно использовать смесь углекислого газа и окиси углерода такого состава, при котором в условиях температуры процесса реакции
Fe + CО2 = FeO + CO не может идти в прямом направлении.
К числу подобных задач о направлении и глубине протекания процессов относятся и расчеты состава и кратности шлаков, обеспечивающих заданную степень рафинирования жидкой стали от вредных примесей.
В металлургии задачи подобного типа весьма многочисленны и разнообразны и постоянно возникают в связи с совершенствованием технологии. В основе их решения лежит второй закон термодинамики и вытекающие из него следствия.
